2.3.2原子结构 2(课件 25张PPT)
文档属性
| 名称 | 2.3.2原子结构 2(课件 25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 14.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-04-01 19:31:48 | ||
图片预览






文档简介
(共25张PPT)
第二课时
第3节 建构原子模型
原子
核外电子
原子核
(电中性)
中 子
质 子
(带正电荷)
(带正电荷)
(带负电荷)
(不带电)
在同一个原子中: 核电荷数 = 质子数 = 核外电子数
核电荷数:
科学上把原子核所带的电荷数称为核电荷数
(一个质子带一个单位正电荷)
(一个电子带一个单位负电荷)
原子种类由核电荷数(质子数)决定,因此原子中必不可少的是质子
原子的质量主要集中在原子核上,质子和中子的质量相近,电子的质量很小(可忽略)。
复习回顾
金属原子、非金属原子得失电子后,还能不能叫做原子呢 为什么
复习回顾
取一瓶氯气,用镊子夹一小块钠放入燃烧匙中,点燃钠,将燃烧匙伸入氯气瓶中,反应结束后观察瓶内的物质。
实验现象:
剧烈燃烧,发出黄色火焰,放出热量,产生大量白烟体。
化学反应文字表达式:
钠 + 氯气 氯化钠
点燃
从原子水平上来说,这个反应究竟发生了什么呢?
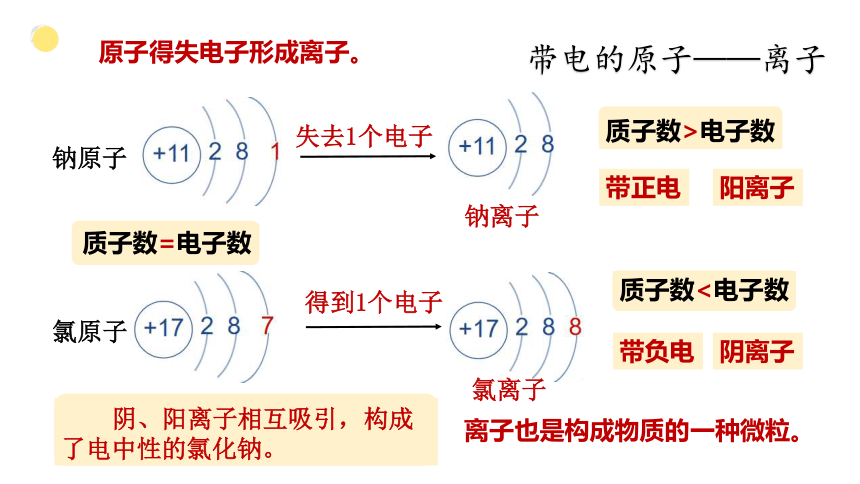
失去1个电子
钠离子
得到1个电子
质子数=电子数
质子数>电子数
带正电
阳离子
钠原子
氯原子
氯离子
质子数<电子数
带负电
阴离子
原子得失电子形成离子。
带电的原子——离子
离子也是构成物质的一种微粒。
阴、阳离子相互吸引,构成了电中性的氯化钠。
原子
失去电子
阳离子
带正电的原子
得到电子
阴离子
带负电的原子
离子是带电的原子!
一.离子
①离子的定义:
带电的原子或原子团
②离子符号的写法:
先写元素符号,在右上角标明该离子带的电荷数,注意“+、-”跟在数字后面(1可以省略不写)。
③离子符号的意义
2
Mg2+
表示每个镁离子带2个单位的正电荷
怎样表示几个离子?
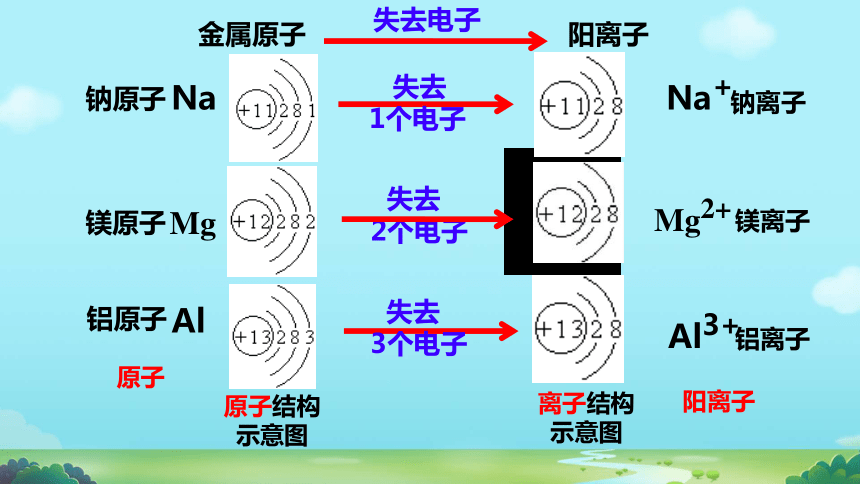
Na
Na+
失去
1个电子
Mg
失去
2个电子
Mg2+
Al
失去
3个电子
Al3+
原子
阳离子
金属原子 阳离子
失去电子
原子结构示意图
离子结构示意图
钠原子
钠离子
镁原子
镁离子
铝原子
铝离子
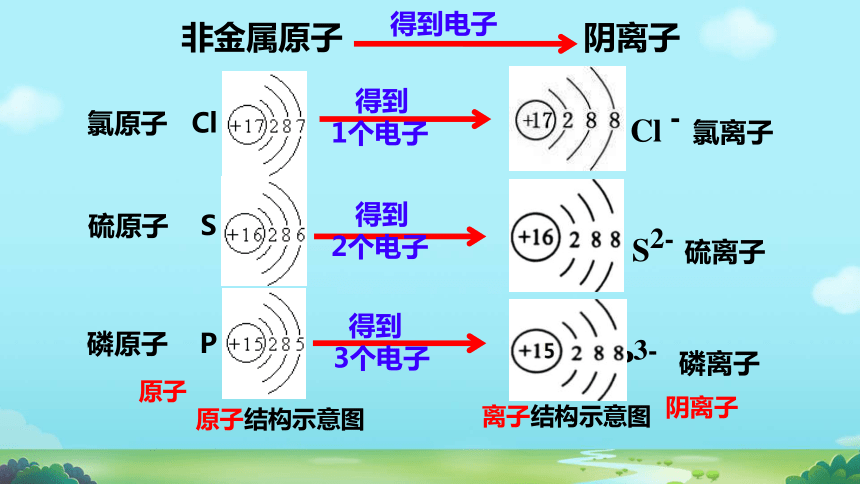
得到
1个电子
Cl - 氯离子
得到
2个电子
S2- 硫离子
得到
3个电子
P3- 磷离子
原子
阴离子
原子结构示意图
离子结构示意图
氯原子 Cl
硫原子 S
磷原子 P
非金属原子 阴离子
得到电子
比较
原子与离子的区别与联系
原子
阴离子(—)
阳离子(+)
得电子
得电子
失电子
失电子
克和千克是日常生活中最常使用的质量单位。
一个苹果的质量约是300 g
一名中学生的体重约是50 kg
微观粒子—原子虽然很小,但也有质量,怎么表示原子质量方便记忆和书写呢?
二、相对原子质量
科学家测得一些原子的质量,这么小的原子如何表示呢?
1个原子 真实质量/kg
氢原子 0.000 000 000 000 000 000 000 000 001674 kg
碳原子 0.000 000 000 000 000 000 000 000 01993 kg
氧原子 0.000 000 000 000 000 000 000 000 02657 kg
铁原子 0.000 000 000 000 000 000 000 000 09288 kg
1.67×10-27 kg
1.993×10-26 kg
9.288×10-26 kg
2.657×10-26 kg
即使用科学记数法,原子的质量也非常难记忆。
科学计数法表示
相对原子质量
一、相对原子质量
(1)什么是相对原子质量?
(2)相对原子质量的计算公式?
观察视频,思考下列问题:
定义:以一种碳原子质量的1/12作为标准,其他原子的质量与这一标准的比值,称为这种原子的相对原子质量。
碳12,它质量的1/12约等于1.66×10-27 kg
把一个C—12原子的质量分为12等份,
即一份为1.661×10-27千克
碳原子
碳原子的1/12
(2)把其他原子质量与这个标准进行比较,所得比值就是相对原子质量。
氧原子
16等份
碳原子的1/12
(1)标准:
一、相对原子质量
已知一个碳原子的质量是1.993×10-26千克,
一个氧原子的质量是2.657×10-26 千克,
一个氢原子的质量是1.674×10-27 千克,
求出碳、氧、氢的相对原子质量。
碳的相对原子质量 =
1.993×10-26千克
1.661×10-27千克
=
12
氧的相对原子质量 =
1.661×10-27千克
=
2.657×10-26千克
16
氢的相对原子质量 =
1.674×10-27千克
1.661×10-27千克
=
1
3、相对原子质量计算公式
相对原子质量
=
某原子的质量
C-12原子的质量
×
1
12
=
某原子的质量
C-12原子的质量
×
12
m实
mC
m相
=
1
12
=
m实
12
mC
1. 相对原子质量不是原子的真实质量,而是相对质量。
2. 相对原子质量是一个比值,没有质量单位。
3. 原子质量大的,相对原子质量也大。
原子质量与相对原子质量的比较:
项目 原子的质量 相对原子质量
得出与性质
数值与单位
联系 实验测出的,是一个原子的实际质量
比较得出的,是相对质量
非常小,单位是千克
是比值,无单位
1、如果以一种碳原子质量的1/10作为标准,则氧原子的相对原子质量还是16吗?比16大吗?
标准变 。
大
标准变了,相对原子质量也要改变。不是16。
相对原子质量变 。
小
比16小。
2、如C-12的质量是a,某原子的质量是b,那么这个原子的相对质量可以怎样表示?
12b/a
这个原子的相对质量
=
=
b
a
×
1
12
从表中的数据,你能获得什么启示?
微 粒 质量/千克 相对质量 说 明
碳原子 1.993×10-26 12 6个质子,6个中子
质子 1.6726×10-27 1 质子质量≈中子质量
中子 1.6748×10-27 1 电子 9.1176×10-31 1/1834 电子质量是质子质量的1/1834
1、质子和中子的质量大约相等,且都约等于一种碳原子的质量的1/12,相对质量都约等于1。
2、电子的质量很小,可以忽略,原子的质量几乎集中在原子核上。
3.相对原子质量
质子数
中子数
≈
+
完成下表,能否找到一个简单的数量关系?
原子种类 核电荷数 质子数 中子数 电子数 相对原子质量
1 0
氧 8 8
11 12 23
12 12
13 14 27
铁 26 30 56
氢
1
1
1
8
8
16
钠
11
11
镁
12
12
24
铝
13
13
26
26
相对原子质量
4.相对原子质量的近似计算:
质子数
中子数
=
+
新课教学
请查阅核电荷数1~18元素的相对原子质量,并填在表中。
1
4
7
9
11
12
14
16
19
20
23
24
27
28
31
32
35.5
40
相对原子质量可以从元素周期表*中查到。在一般的计算中多采用相对原子质量的近似值。
张青莲教授与相对原子质量
相对原子质量只是一个比值,所有元素的相对原子质量均已被测出。我国科学家、北京大学的张青莲教授1983年当选为国际原子量委员会委员,他主持的科研小组在测定相对原子质量方面作出了突出贡献,国际上有7种元素的相对原子质量采用了他测的数据。表2-13是他所测的部分元素的相对原子质量新标准值。
巩固练习
1.构成物质的微观粒子有哪些?请举例说明。
水、氢气、氧气等
石墨、金刚石、金属等
氯化钠、硫酸、氢氧化钠等
巩固练习
2.下表是某同学收集的一些微粒的资料,请根据表格数据回答下列问题。
(1)上述粒子中哪些属于原子?
(2)根据表格信息,写出C的带电情况。
(3)有同学认为,D粒子的质量比C粒子大,你同意吗?为什么?
巩固练习
3.原子在形成离子过程中发生变化的是( )
A. 原子核 B. 质子数 C. 中子数 D. 电子数
D
4. 国产大型客机C919部分机身采用了新型的铝锂合金,这种材料具有较高的强度和适宜的延展性。铝锂合金中的铝(Al)元素与锂(Li)元素的本质区别是 ( )A.元素符号不同 B.原子质量不同C.原子的质子数不同 D.原子的电子数不同
C
第二课时
第3节 建构原子模型
原子
核外电子
原子核
(电中性)
中 子
质 子
(带正电荷)
(带正电荷)
(带负电荷)
(不带电)
在同一个原子中: 核电荷数 = 质子数 = 核外电子数
核电荷数:
科学上把原子核所带的电荷数称为核电荷数
(一个质子带一个单位正电荷)
(一个电子带一个单位负电荷)
原子种类由核电荷数(质子数)决定,因此原子中必不可少的是质子
原子的质量主要集中在原子核上,质子和中子的质量相近,电子的质量很小(可忽略)。
复习回顾
金属原子、非金属原子得失电子后,还能不能叫做原子呢 为什么
复习回顾
取一瓶氯气,用镊子夹一小块钠放入燃烧匙中,点燃钠,将燃烧匙伸入氯气瓶中,反应结束后观察瓶内的物质。
实验现象:
剧烈燃烧,发出黄色火焰,放出热量,产生大量白烟体。
化学反应文字表达式:
钠 + 氯气 氯化钠
点燃
从原子水平上来说,这个反应究竟发生了什么呢?
失去1个电子
钠离子
得到1个电子
质子数=电子数
质子数>电子数
带正电
阳离子
钠原子
氯原子
氯离子
质子数<电子数
带负电
阴离子
原子得失电子形成离子。
带电的原子——离子
离子也是构成物质的一种微粒。
阴、阳离子相互吸引,构成了电中性的氯化钠。
原子
失去电子
阳离子
带正电的原子
得到电子
阴离子
带负电的原子
离子是带电的原子!
一.离子
①离子的定义:
带电的原子或原子团
②离子符号的写法:
先写元素符号,在右上角标明该离子带的电荷数,注意“+、-”跟在数字后面(1可以省略不写)。
③离子符号的意义
2
Mg2+
表示每个镁离子带2个单位的正电荷
怎样表示几个离子?
Na
Na+
失去
1个电子
Mg
失去
2个电子
Mg2+
Al
失去
3个电子
Al3+
原子
阳离子
金属原子 阳离子
失去电子
原子结构示意图
离子结构示意图
钠原子
钠离子
镁原子
镁离子
铝原子
铝离子
得到
1个电子
Cl - 氯离子
得到
2个电子
S2- 硫离子
得到
3个电子
P3- 磷离子
原子
阴离子
原子结构示意图
离子结构示意图
氯原子 Cl
硫原子 S
磷原子 P
非金属原子 阴离子
得到电子
比较
原子与离子的区别与联系
原子
阴离子(—)
阳离子(+)
得电子
得电子
失电子
失电子
克和千克是日常生活中最常使用的质量单位。
一个苹果的质量约是300 g
一名中学生的体重约是50 kg
微观粒子—原子虽然很小,但也有质量,怎么表示原子质量方便记忆和书写呢?
二、相对原子质量
科学家测得一些原子的质量,这么小的原子如何表示呢?
1个原子 真实质量/kg
氢原子 0.000 000 000 000 000 000 000 000 001674 kg
碳原子 0.000 000 000 000 000 000 000 000 01993 kg
氧原子 0.000 000 000 000 000 000 000 000 02657 kg
铁原子 0.000 000 000 000 000 000 000 000 09288 kg
1.67×10-27 kg
1.993×10-26 kg
9.288×10-26 kg
2.657×10-26 kg
即使用科学记数法,原子的质量也非常难记忆。
科学计数法表示
相对原子质量
一、相对原子质量
(1)什么是相对原子质量?
(2)相对原子质量的计算公式?
观察视频,思考下列问题:
定义:以一种碳原子质量的1/12作为标准,其他原子的质量与这一标准的比值,称为这种原子的相对原子质量。
碳12,它质量的1/12约等于1.66×10-27 kg
把一个C—12原子的质量分为12等份,
即一份为1.661×10-27千克
碳原子
碳原子的1/12
(2)把其他原子质量与这个标准进行比较,所得比值就是相对原子质量。
氧原子
16等份
碳原子的1/12
(1)标准:
一、相对原子质量
已知一个碳原子的质量是1.993×10-26千克,
一个氧原子的质量是2.657×10-26 千克,
一个氢原子的质量是1.674×10-27 千克,
求出碳、氧、氢的相对原子质量。
碳的相对原子质量 =
1.993×10-26千克
1.661×10-27千克
=
12
氧的相对原子质量 =
1.661×10-27千克
=
2.657×10-26千克
16
氢的相对原子质量 =
1.674×10-27千克
1.661×10-27千克
=
1
3、相对原子质量计算公式
相对原子质量
=
某原子的质量
C-12原子的质量
×
1
12
=
某原子的质量
C-12原子的质量
×
12
m实
mC
m相
=
1
12
=
m实
12
mC
1. 相对原子质量不是原子的真实质量,而是相对质量。
2. 相对原子质量是一个比值,没有质量单位。
3. 原子质量大的,相对原子质量也大。
原子质量与相对原子质量的比较:
项目 原子的质量 相对原子质量
得出与性质
数值与单位
联系 实验测出的,是一个原子的实际质量
比较得出的,是相对质量
非常小,单位是千克
是比值,无单位
1、如果以一种碳原子质量的1/10作为标准,则氧原子的相对原子质量还是16吗?比16大吗?
标准变 。
大
标准变了,相对原子质量也要改变。不是16。
相对原子质量变 。
小
比16小。
2、如C-12的质量是a,某原子的质量是b,那么这个原子的相对质量可以怎样表示?
12b/a
这个原子的相对质量
=
=
b
a
×
1
12
从表中的数据,你能获得什么启示?
微 粒 质量/千克 相对质量 说 明
碳原子 1.993×10-26 12 6个质子,6个中子
质子 1.6726×10-27 1 质子质量≈中子质量
中子 1.6748×10-27 1 电子 9.1176×10-31 1/1834 电子质量是质子质量的1/1834
1、质子和中子的质量大约相等,且都约等于一种碳原子的质量的1/12,相对质量都约等于1。
2、电子的质量很小,可以忽略,原子的质量几乎集中在原子核上。
3.相对原子质量
质子数
中子数
≈
+
完成下表,能否找到一个简单的数量关系?
原子种类 核电荷数 质子数 中子数 电子数 相对原子质量
1 0
氧 8 8
11 12 23
12 12
13 14 27
铁 26 30 56
氢
1
1
1
8
8
16
钠
11
11
镁
12
12
24
铝
13
13
26
26
相对原子质量
4.相对原子质量的近似计算:
质子数
中子数
=
+
新课教学
请查阅核电荷数1~18元素的相对原子质量,并填在表中。
1
4
7
9
11
12
14
16
19
20
23
24
27
28
31
32
35.5
40
相对原子质量可以从元素周期表*中查到。在一般的计算中多采用相对原子质量的近似值。
张青莲教授与相对原子质量
相对原子质量只是一个比值,所有元素的相对原子质量均已被测出。我国科学家、北京大学的张青莲教授1983年当选为国际原子量委员会委员,他主持的科研小组在测定相对原子质量方面作出了突出贡献,国际上有7种元素的相对原子质量采用了他测的数据。表2-13是他所测的部分元素的相对原子质量新标准值。
巩固练习
1.构成物质的微观粒子有哪些?请举例说明。
水、氢气、氧气等
石墨、金刚石、金属等
氯化钠、硫酸、氢氧化钠等
巩固练习
2.下表是某同学收集的一些微粒的资料,请根据表格数据回答下列问题。
(1)上述粒子中哪些属于原子?
(2)根据表格信息,写出C的带电情况。
(3)有同学认为,D粒子的质量比C粒子大,你同意吗?为什么?
巩固练习
3.原子在形成离子过程中发生变化的是( )
A. 原子核 B. 质子数 C. 中子数 D. 电子数
D
4. 国产大型客机C919部分机身采用了新型的铝锂合金,这种材料具有较高的强度和适宜的延展性。铝锂合金中的铝(Al)元素与锂(Li)元素的本质区别是 ( )A.元素符号不同 B.原子质量不同C.原子的质子数不同 D.原子的电子数不同
C
同课章节目录
