3.1 课时1 金属键与金属特性(19页)课件 2024-2025学年高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 3.1 课时1 金属键与金属特性(19页)课件 2024-2025学年高二化学苏教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 31.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-01 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
专题3 微粒间作用力与物质性质
金属键与金属特性
1.知道金属键的特点与金属某些性质的关系
2.建构金属键模型,并运用模型解释金属的某些性质
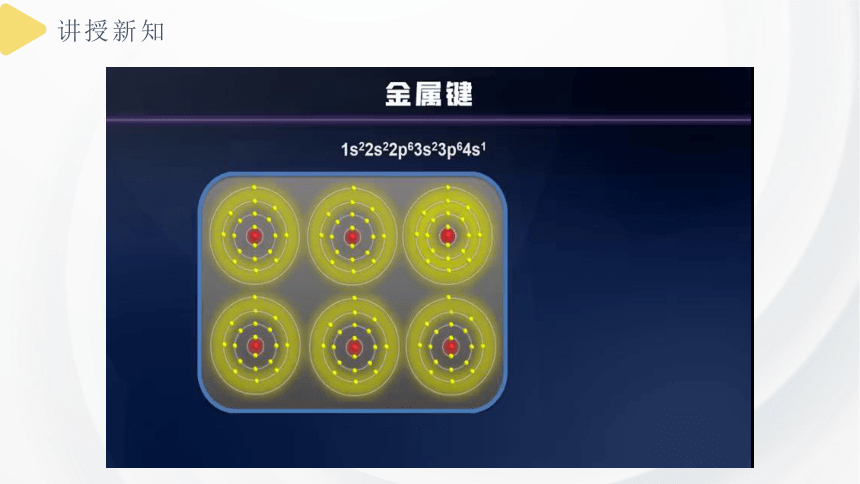
一、金属键
除汞等少数金属外,大多数金属单质具有较高的熔点,说明金属晶体中存在着强烈的相互作用。
金属具有导电性,是因为金属晶体中存在着能够自由移动的电子。
一、金属键
金属晶体中的金属键示意图
金属原子失去部分或全部外围电子形成的金属离子与自由电子之间存在着强烈的相互作用,化学上把这种金属离子与自由电子之间强烈的相互作用称为金属键。
①成键微粒:金属阳离子、自由电子
②成键本质:金属阳离子与自由电子之间的强烈的静电作用
电子气理论
由于金属原子的最外层电子数较少,容易失去电子成为金属离子,金属原子释放出的价电子不专门属于某个特定的金属离子,而为许多金属离子所共有,并在整个金属中自由运动,这些电子又称为自由电子。
金属脱落下来的价电子几乎均匀分布在整个晶体中,像遍布整块金属的“电子气”,从而把所有金属原子维系在一起。
③特征:金属键无方向性和饱和性,成键电子可以在金属中自由流动
金属特性——导电性
通常情况下,金属内部自由电子的运动不具有固定的方向性。但在外电场作用下,自由电子在金属内部会发生定向运动,从而形成电流,所以金属具有导电性。
思考:金属的导电性和电解质的导电性有何不同?
类型 电解质 金属
导电时的状态
导电粒子
导电时发生的变化
导电能力随温度的变化
水溶液或熔融状态下
晶体状态
自由移动的离子
自由电子
化学变化
物理变化
增强
减弱
金属特性——导热性
当金属某一部分受热时,该区域里自由电子的能量增加,运动速率加快,自由电子与金属离子(或金属原子)的碰撞频率增加,自由电子把能量传给金属离子(或金属原子)。
金属的导热性就是通过自由电子的运动把能量从温度高的区域传到温度低的区域,从而使整块金属达到同样的温度。
金属特性——延展性
金属键没有方向性,当金属受到外力作用时,金属原子之间发生相对滑动,各层金属原子之间仍然保持金属键的作用。
因此,在一定强度的外力作用下,金属可以发生形变,表现出良好的延展性。
思考:金属的光泽铁块、镁条、铜片具有我们常说的金属光泽,但铁粉、镁粉、铜粉没有金属光泽。这是为什么呢?
铁块
镁条
铜片
铁粉
镁粉
铜粉
金属特性——金属光泽
金属粉末往往没有金属光泽,这是因为在粉末状时,金属的晶面分布在各个方向,非常杂乱,晶格排列也不规则,吸收可见光后辐射不出去,所以失去光泽。
金属中的自由电子容易吸收可见光的能量跃迁到较高能级,在返回原能级时以光的形式放出能量。铁、镁能吸收各种波长的可见光,吸收后又把它们几乎全部反射出去,所以呈钢灰色或银白色光泽。金属对某种波长的光吸收程度较大,该金属就呈现与其对应的某种颜色。如金属铜容易吸收绿色光,即呈现出对应的紫红色。
金属单质 熔点/℃
Li 180.5
Na 97.81
K 63.65
Rb 38.89
Cs 28.40
思考:金属的熔点和硬度差别很大,和什么因素有关?
金属的硬度和熔、沸点等物理性质与金属键的强弱有关。
可用来衡量金属键的强弱。
金属的原子化热
指1 mol金属固体完全气化成相互远离的气态原子时吸收的能量。
金属键强弱的主要影响因素
金属元素的原子半径
单位体积内自由电子的数目
金属元素的原子半径越小,金属键越强。
单位体积内自由电子的数目越多,金属键越强。
或金属阳离子所带电荷或价电子数
或金属阳离子半径的大小
同主族元素,随着核电荷数的增大,金属原子的半径增大,金属键减弱;
同周期元素,随着核电荷数的增大,金属原子半径减小,金属键增强,熔、沸点升高。
金属键的强弱差别较大。
如钠、钾的熔、沸点低,存在的金属键较弱;铬的硬度大,熔、沸点高,存在的金属键较强。
金属键越强,金属晶体的硬度越大,熔、沸点越高。
同主族金属单质,从上至下,熔、沸点依次降低。
如碱金属Li、Na、K等;
思考:同周期、同主族的金属的熔、沸点有什么规律?
同周期金属单质,从左到右,熔、沸点依次升高。
如:Na、Mg、Al;
一般情况下,合金的熔、沸点比各成分金属都低。
1.关于金属键的叙述错误的是( )
A.金属键没有方向性和饱和性
B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C.金属键中的电子属于整块金属
D.金属的性质和金属固体的形成都与金属键有关
B
专题3 微粒间作用力与物质性质
金属键与金属特性
1.知道金属键的特点与金属某些性质的关系
2.建构金属键模型,并运用模型解释金属的某些性质
一、金属键
除汞等少数金属外,大多数金属单质具有较高的熔点,说明金属晶体中存在着强烈的相互作用。
金属具有导电性,是因为金属晶体中存在着能够自由移动的电子。
一、金属键
金属晶体中的金属键示意图
金属原子失去部分或全部外围电子形成的金属离子与自由电子之间存在着强烈的相互作用,化学上把这种金属离子与自由电子之间强烈的相互作用称为金属键。
①成键微粒:金属阳离子、自由电子
②成键本质:金属阳离子与自由电子之间的强烈的静电作用
电子气理论
由于金属原子的最外层电子数较少,容易失去电子成为金属离子,金属原子释放出的价电子不专门属于某个特定的金属离子,而为许多金属离子所共有,并在整个金属中自由运动,这些电子又称为自由电子。
金属脱落下来的价电子几乎均匀分布在整个晶体中,像遍布整块金属的“电子气”,从而把所有金属原子维系在一起。
③特征:金属键无方向性和饱和性,成键电子可以在金属中自由流动
金属特性——导电性
通常情况下,金属内部自由电子的运动不具有固定的方向性。但在外电场作用下,自由电子在金属内部会发生定向运动,从而形成电流,所以金属具有导电性。
思考:金属的导电性和电解质的导电性有何不同?
类型 电解质 金属
导电时的状态
导电粒子
导电时发生的变化
导电能力随温度的变化
水溶液或熔融状态下
晶体状态
自由移动的离子
自由电子
化学变化
物理变化
增强
减弱
金属特性——导热性
当金属某一部分受热时,该区域里自由电子的能量增加,运动速率加快,自由电子与金属离子(或金属原子)的碰撞频率增加,自由电子把能量传给金属离子(或金属原子)。
金属的导热性就是通过自由电子的运动把能量从温度高的区域传到温度低的区域,从而使整块金属达到同样的温度。
金属特性——延展性
金属键没有方向性,当金属受到外力作用时,金属原子之间发生相对滑动,各层金属原子之间仍然保持金属键的作用。
因此,在一定强度的外力作用下,金属可以发生形变,表现出良好的延展性。
思考:金属的光泽铁块、镁条、铜片具有我们常说的金属光泽,但铁粉、镁粉、铜粉没有金属光泽。这是为什么呢?
铁块
镁条
铜片
铁粉
镁粉
铜粉
金属特性——金属光泽
金属粉末往往没有金属光泽,这是因为在粉末状时,金属的晶面分布在各个方向,非常杂乱,晶格排列也不规则,吸收可见光后辐射不出去,所以失去光泽。
金属中的自由电子容易吸收可见光的能量跃迁到较高能级,在返回原能级时以光的形式放出能量。铁、镁能吸收各种波长的可见光,吸收后又把它们几乎全部反射出去,所以呈钢灰色或银白色光泽。金属对某种波长的光吸收程度较大,该金属就呈现与其对应的某种颜色。如金属铜容易吸收绿色光,即呈现出对应的紫红色。
金属单质 熔点/℃
Li 180.5
Na 97.81
K 63.65
Rb 38.89
Cs 28.40
思考:金属的熔点和硬度差别很大,和什么因素有关?
金属的硬度和熔、沸点等物理性质与金属键的强弱有关。
可用来衡量金属键的强弱。
金属的原子化热
指1 mol金属固体完全气化成相互远离的气态原子时吸收的能量。
金属键强弱的主要影响因素
金属元素的原子半径
单位体积内自由电子的数目
金属元素的原子半径越小,金属键越强。
单位体积内自由电子的数目越多,金属键越强。
或金属阳离子所带电荷或价电子数
或金属阳离子半径的大小
同主族元素,随着核电荷数的增大,金属原子的半径增大,金属键减弱;
同周期元素,随着核电荷数的增大,金属原子半径减小,金属键增强,熔、沸点升高。
金属键的强弱差别较大。
如钠、钾的熔、沸点低,存在的金属键较弱;铬的硬度大,熔、沸点高,存在的金属键较强。
金属键越强,金属晶体的硬度越大,熔、沸点越高。
同主族金属单质,从上至下,熔、沸点依次降低。
如碱金属Li、Na、K等;
思考:同周期、同主族的金属的熔、沸点有什么规律?
同周期金属单质,从左到右,熔、沸点依次升高。
如:Na、Mg、Al;
一般情况下,合金的熔、沸点比各成分金属都低。
1.关于金属键的叙述错误的是( )
A.金属键没有方向性和饱和性
B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C.金属键中的电子属于整块金属
D.金属的性质和金属固体的形成都与金属键有关
B
