3.4 课时2 分子晶体(21页)课件 2024-2025学年高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 3.4 课时2 分子晶体(21页)课件 2024-2025学年高二化学苏教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-01 17:21:11 | ||
图片预览




文档简介
(共21张PPT)
分子晶体
1.从微观角度认识分子晶体的结构特征,培养宏观辨识与微观探析核心素养。能描述典型分子晶体的结构特点。
2.能区分分子晶体和共价晶体,建立认知模型,并运用认知模型分析解决实际问题。
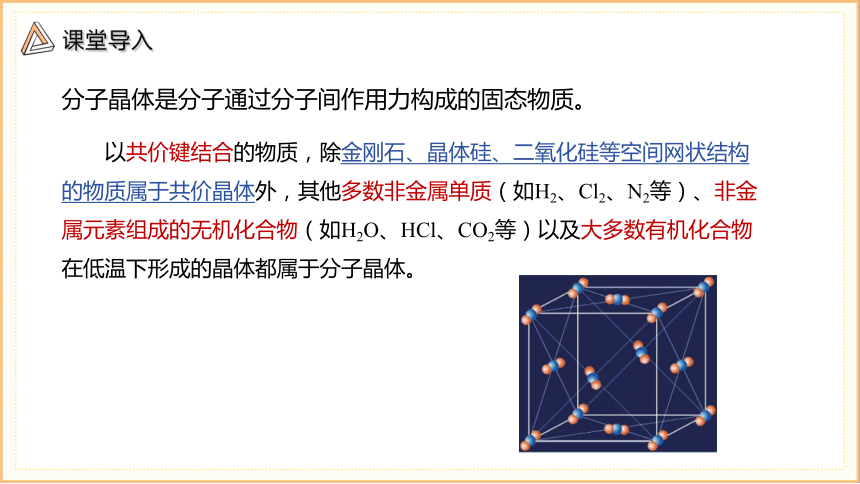
分子晶体是分子通过分子间作用力构成的固态物质。
以共价键结合的物质,除金刚石、晶体硅、二氧化硅等空间网状结构的物质属于共价晶体外,其他多数非金属单质(如H2、Cl2、N2等)、非金属元素组成的无机化合物(如H2O、HCl、CO2等)以及大多数有机化合物在低温下形成的晶体都属于分子晶体。
一、分子晶体
分子晶体
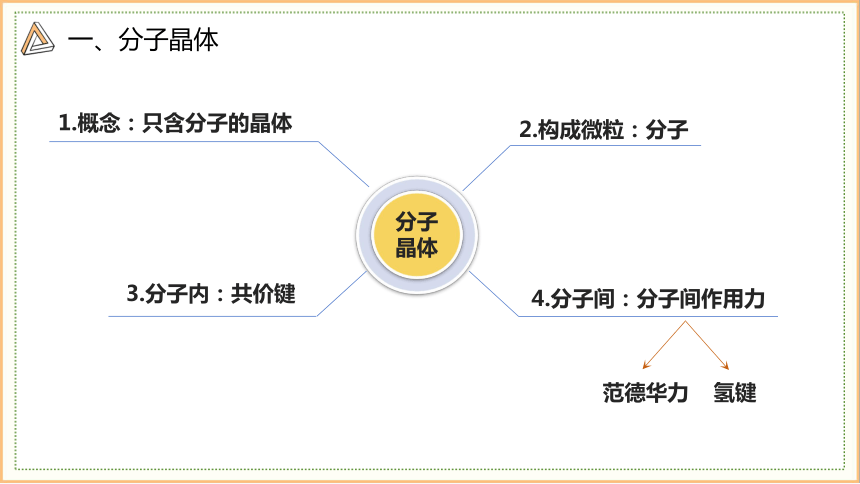
1.概念:只含分子的晶体
2.构成微粒:分子
3.分子内:共价键
4.分子间:分子间作用力
范德华力
氢键
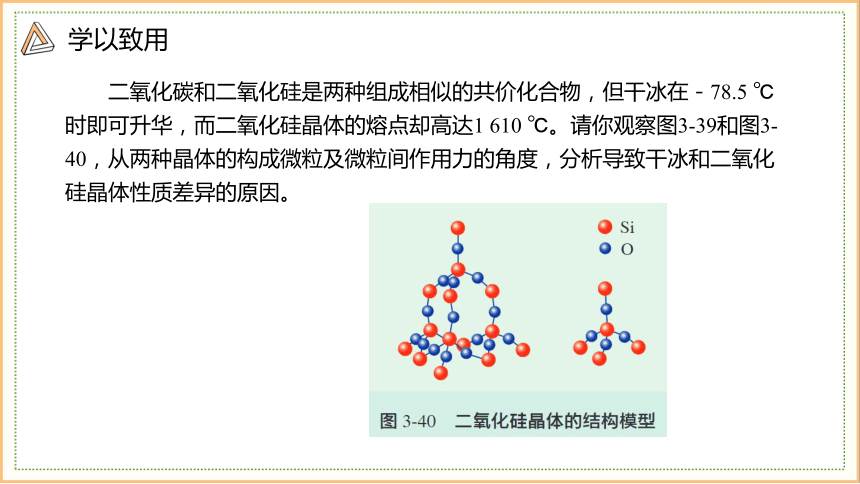
二氧化碳和二氧化硅是两种组成相似的共价化合物,但干冰在-78.5 ℃时即可升华,而二氧化硅晶体的熔点却高达1 610 ℃。请你观察图3-39和图3-40,从两种晶体的构成微粒及微粒间作用力的角度,分析导致干冰和二氧化硅晶体性质差异的原因。
学以致用
典型分子晶体的结构特征
(1)构成干冰晶体的结构微粒是 ,微粒间的相互作用力是 。
CO2分子
范德华力
(2)从结构模型可以看出:干冰晶体是一种面心立方结构。每个CO2分子周围,离该分子最近且距离相等的CO2分子有 个。每个晶胞中有 个CO2分子。
12
4
干冰晶胞
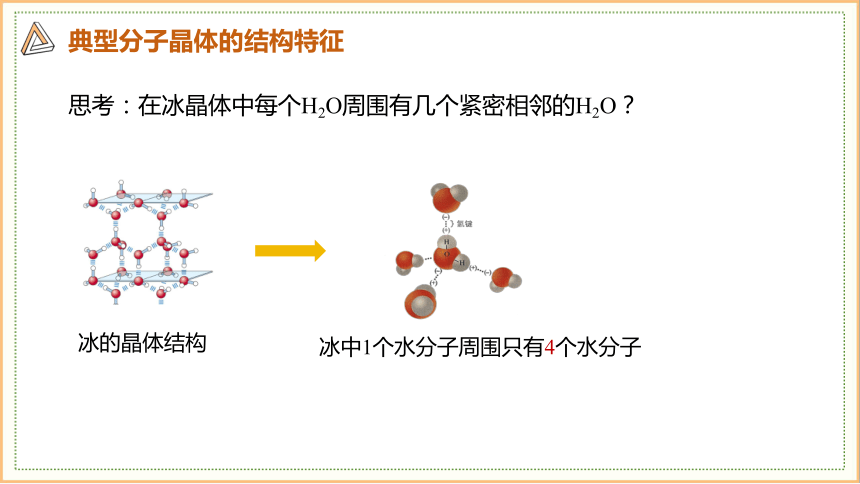
思考:在冰晶体中每个H2O周围有几个紧密相邻的H2O?
冰的晶体结构
典型分子晶体的结构特征
冰中1个水分子周围只有4个水分子
冰晶体中水分子之间的作用力有范德华力、氢键,但主要是氢键。
氢键的作用力远大于范德华力。且氢键具有方向性和饱和性。
使四面体中心的每个水分子与四面体顶点的4个相邻的水分子相互吸引。
典型分子晶体的结构特征
分子的形状、分子的极性以及分子之间是否存在氢键等,都会影响分子的堆积方式。
一、分子晶体
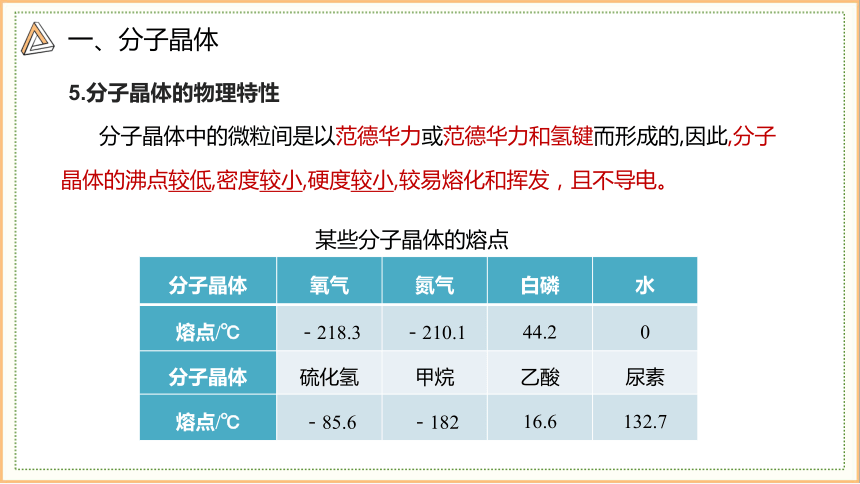
5.分子晶体的物理特性
分子晶体 氧气 氮气 白磷 水
熔点/℃ -218.3 -210.1 44.2 0
分子晶体 硫化氢 甲烷 乙酸 尿素
熔点/℃ -85.6 -182 16.6 132.7
某些分子晶体的熔点
分子晶体中的微粒间是以范德华力或范德华力和氢键而形成的,因此,分子晶体的沸点较低,密度较小,硬度较小,较易熔化和挥发,且不导电。
分子晶体熔、沸点高低的判断方法
组成和结构
相似
不相似:
含氢键:
不含氢键:
熔沸点高
范德华力越大,熔沸点越高
分子的极性越大,熔沸点越高
支链越多,熔沸点越低
碳原子数越多,熔沸点越高
有机物
同分异构体:
同系物:
分子晶体的判断方法
①部分非金属单质、②所有非金属氢化物、③部分非金属氧化物、④几乎所有的酸、⑤绝大多数有机物的晶体都是分子晶体。
1、依据物质的类别判断
组成分子晶体的粒子是分子,粒子间作用是分子间作用力。
2、依据组成晶体的粒子及粒子间作用判断
分子晶体的硬度小,熔、沸点低,在熔融状态或固体时均不导电。
3、依据物质的性质判断
实验测定,石墨的熔点高达 3850 ℃,质地很软并且能导电,是非常好的润滑剂。石墨究竟属于哪种类型的晶体呢
石墨的层状结构
二、混合晶体
石墨的层状结构
石墨晶体
①石墨晶体为层状结构。层与层之间以
结合。故石墨质软,有滑腻感。
②在同一层内,碳原子以 彼此结合,故石墨熔点较高。
分子间作用力
共价键
③在同一层内,每个碳原子以C-C键与3个碳原子结合,形成六元环。每个六元环平均 个 C原子。
④每个六元环中有 个C-C键,故1mol石墨晶体中C-C键为 。
2
1.5NA
3
石墨晶体中层内的π键
层内碳原子的这些p轨道相互平行,相邻碳原子的p轨道相互重叠,形成大π键。
在石墨的二维结构平面内,每个碳原子以C—C键与3个碳原子结合,形成六元环层。
这些电子比较自由,相当于金属中的自由电子,所以石墨能导热和导电。
二、混合晶体
石墨晶体
石墨晶体的性质
1.石墨具有导电性,具有一定的方向性。
①层内p轨道形成大π键,电子可以整个层内运动(导电性)
2.石墨质软,具有具有良好的润滑性。
石墨晶体中层与层之间发生相对滑动
②电子不能从一层跳跃到另一层(方向性)
二、混合晶体
晶体的共性
(1)晶体物质各个部分的宏观性质总是相同的,例如具有相同的密度、相同的化学组成等;
(2)晶体总能自发地形成多面体外形;
(3)晶体都具有确定的熔点。
本质:晶体具有周期性结构
几种类型晶体的结构和性质
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
结 构 构成微粒 金属阳离子、自由电子 阴、阳离子 原子 分子
微粒间作用力 金属键 离子键 共价键 分子间作用力
性 质 熔、沸点 差异较大 高 很高 低
硬 度 差异较大 硬而脆 很大 小
导电性 导电 熔化或溶于水导电 一般不导电,硅是半导体 固体及熔融状态不导电,有的溶于水能导电。
举 例 金属、 金属合金 离子化合物 金刚石、Si、SiO2、SiC 硫、干冰、冰、
冰醋酸、蔗糖
1.SiCl4的分子结构与CCl4相似,对其进行下列推测,不正确的是( )
A.SiCl4晶体是分子晶体
B.常温、常压下SiCl4是气体
C.SiCl4的分子中只含极性键
D.SiCl4的熔点高于CCl4
B
2.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、HD、C2H2 B.PCl3、CO2、H2SO4
C.SO2、BN、P2O5 D.CCl4、Na2S、H2O2
B
3.下列物质,按沸点降低顺序排列的一组是( )
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
D
4.下列物质的熔点高低顺序正确的是( )
A.金刚石>晶体硅>碳化硅
B.K>Na>Li
C.NaBr>NaCl>NaF
D.CI4>CBr4>CCl4>CH4
D
分子晶体
1.从微观角度认识分子晶体的结构特征,培养宏观辨识与微观探析核心素养。能描述典型分子晶体的结构特点。
2.能区分分子晶体和共价晶体,建立认知模型,并运用认知模型分析解决实际问题。
分子晶体是分子通过分子间作用力构成的固态物质。
以共价键结合的物质,除金刚石、晶体硅、二氧化硅等空间网状结构的物质属于共价晶体外,其他多数非金属单质(如H2、Cl2、N2等)、非金属元素组成的无机化合物(如H2O、HCl、CO2等)以及大多数有机化合物在低温下形成的晶体都属于分子晶体。
一、分子晶体
分子晶体
1.概念:只含分子的晶体
2.构成微粒:分子
3.分子内:共价键
4.分子间:分子间作用力
范德华力
氢键
二氧化碳和二氧化硅是两种组成相似的共价化合物,但干冰在-78.5 ℃时即可升华,而二氧化硅晶体的熔点却高达1 610 ℃。请你观察图3-39和图3-40,从两种晶体的构成微粒及微粒间作用力的角度,分析导致干冰和二氧化硅晶体性质差异的原因。
学以致用
典型分子晶体的结构特征
(1)构成干冰晶体的结构微粒是 ,微粒间的相互作用力是 。
CO2分子
范德华力
(2)从结构模型可以看出:干冰晶体是一种面心立方结构。每个CO2分子周围,离该分子最近且距离相等的CO2分子有 个。每个晶胞中有 个CO2分子。
12
4
干冰晶胞
思考:在冰晶体中每个H2O周围有几个紧密相邻的H2O?
冰的晶体结构
典型分子晶体的结构特征
冰中1个水分子周围只有4个水分子
冰晶体中水分子之间的作用力有范德华力、氢键,但主要是氢键。
氢键的作用力远大于范德华力。且氢键具有方向性和饱和性。
使四面体中心的每个水分子与四面体顶点的4个相邻的水分子相互吸引。
典型分子晶体的结构特征
分子的形状、分子的极性以及分子之间是否存在氢键等,都会影响分子的堆积方式。
一、分子晶体
5.分子晶体的物理特性
分子晶体 氧气 氮气 白磷 水
熔点/℃ -218.3 -210.1 44.2 0
分子晶体 硫化氢 甲烷 乙酸 尿素
熔点/℃ -85.6 -182 16.6 132.7
某些分子晶体的熔点
分子晶体中的微粒间是以范德华力或范德华力和氢键而形成的,因此,分子晶体的沸点较低,密度较小,硬度较小,较易熔化和挥发,且不导电。
分子晶体熔、沸点高低的判断方法
组成和结构
相似
不相似:
含氢键:
不含氢键:
熔沸点高
范德华力越大,熔沸点越高
分子的极性越大,熔沸点越高
支链越多,熔沸点越低
碳原子数越多,熔沸点越高
有机物
同分异构体:
同系物:
分子晶体的判断方法
①部分非金属单质、②所有非金属氢化物、③部分非金属氧化物、④几乎所有的酸、⑤绝大多数有机物的晶体都是分子晶体。
1、依据物质的类别判断
组成分子晶体的粒子是分子,粒子间作用是分子间作用力。
2、依据组成晶体的粒子及粒子间作用判断
分子晶体的硬度小,熔、沸点低,在熔融状态或固体时均不导电。
3、依据物质的性质判断
实验测定,石墨的熔点高达 3850 ℃,质地很软并且能导电,是非常好的润滑剂。石墨究竟属于哪种类型的晶体呢
石墨的层状结构
二、混合晶体
石墨的层状结构
石墨晶体
①石墨晶体为层状结构。层与层之间以
结合。故石墨质软,有滑腻感。
②在同一层内,碳原子以 彼此结合,故石墨熔点较高。
分子间作用力
共价键
③在同一层内,每个碳原子以C-C键与3个碳原子结合,形成六元环。每个六元环平均 个 C原子。
④每个六元环中有 个C-C键,故1mol石墨晶体中C-C键为 。
2
1.5NA
3
石墨晶体中层内的π键
层内碳原子的这些p轨道相互平行,相邻碳原子的p轨道相互重叠,形成大π键。
在石墨的二维结构平面内,每个碳原子以C—C键与3个碳原子结合,形成六元环层。
这些电子比较自由,相当于金属中的自由电子,所以石墨能导热和导电。
二、混合晶体
石墨晶体
石墨晶体的性质
1.石墨具有导电性,具有一定的方向性。
①层内p轨道形成大π键,电子可以整个层内运动(导电性)
2.石墨质软,具有具有良好的润滑性。
石墨晶体中层与层之间发生相对滑动
②电子不能从一层跳跃到另一层(方向性)
二、混合晶体
晶体的共性
(1)晶体物质各个部分的宏观性质总是相同的,例如具有相同的密度、相同的化学组成等;
(2)晶体总能自发地形成多面体外形;
(3)晶体都具有确定的熔点。
本质:晶体具有周期性结构
几种类型晶体的结构和性质
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
结 构 构成微粒 金属阳离子、自由电子 阴、阳离子 原子 分子
微粒间作用力 金属键 离子键 共价键 分子间作用力
性 质 熔、沸点 差异较大 高 很高 低
硬 度 差异较大 硬而脆 很大 小
导电性 导电 熔化或溶于水导电 一般不导电,硅是半导体 固体及熔融状态不导电,有的溶于水能导电。
举 例 金属、 金属合金 离子化合物 金刚石、Si、SiO2、SiC 硫、干冰、冰、
冰醋酸、蔗糖
1.SiCl4的分子结构与CCl4相似,对其进行下列推测,不正确的是( )
A.SiCl4晶体是分子晶体
B.常温、常压下SiCl4是气体
C.SiCl4的分子中只含极性键
D.SiCl4的熔点高于CCl4
B
2.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、HD、C2H2 B.PCl3、CO2、H2SO4
C.SO2、BN、P2O5 D.CCl4、Na2S、H2O2
B
3.下列物质,按沸点降低顺序排列的一组是( )
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
D
4.下列物质的熔点高低顺序正确的是( )
A.金刚石>晶体硅>碳化硅
B.K>Na>Li
C.NaBr>NaCl>NaF
D.CI4>CBr4>CCl4>CH4
D
