4.2 课时1 配合物的形成与空间结构(27页)课件 2024-2025学年高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 4.2 课时1 配合物的形成与空间结构(27页)课件 2024-2025学年高二化学苏教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-01 18:34:50 | ||
图片预览






文档简介
(共27张PPT)
配合物的形成
与空间结构
1.认识简单配位化合物的成键特征。
2.能正确运用化学符号描述配合物的组成。
3.学会简单配合物的实验制备。
配合物的形成
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色。
[Cu(NH3)4]SO4
硫酸四氨合铜
将[Cu(NH3)4]SO4溶于水,[Cu(NH3)4]SO4发生下列电离:
[Cu(NH3)4]SO4=== [Cu(NH3)4]2++ SO42-
说明[Cu(NH3)4]2+中Cu2+和NH3分子之间存在较为强烈的相互作用。
四氨合铜离子
配合物的形成
配合物的形成
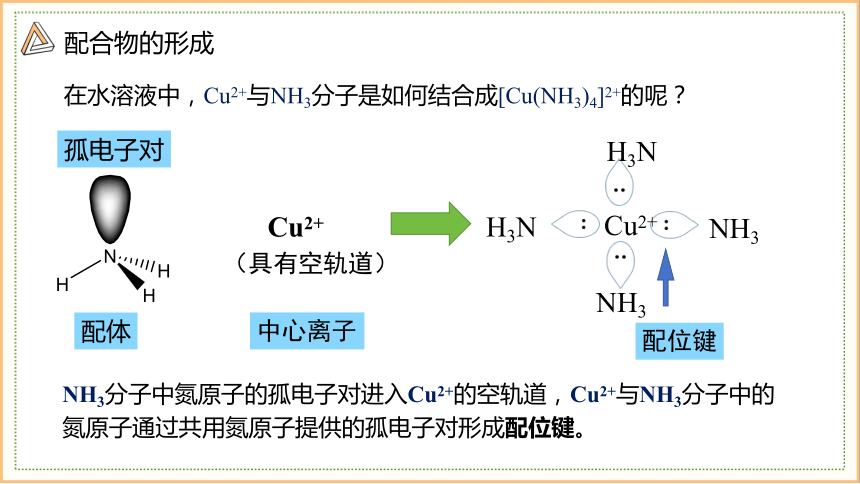
在水溶液中,Cu2+与NH3分子是如何结合成[Cu(NH3)4]2+的呢?
配体
中心离子
Cu2+
(具有空轨道)
Cu2+
NH3
H3N
H3N
NH3
配位键
孤电子对
NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。
配合物的形成
Cu
NH3
NH3
H3N
NH3
2+
SO4
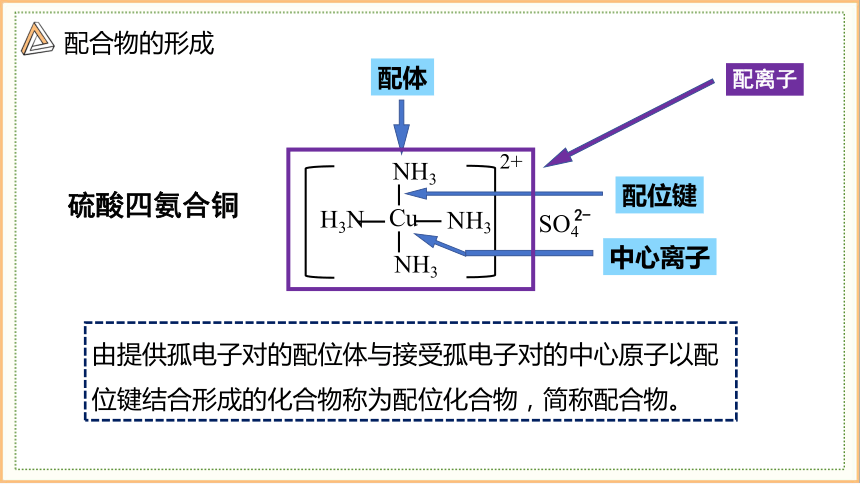
配体
配位键
配离子
中心离子
由提供孤电子对的配位体与接受孤电子对的中心原子以配位键结合形成的化合物称为配位化合物,简称配合物。
2-
硫酸四氨合铜
配合物的形成
配位数
[Cu(NH3)4]SO4
配位体
中心原子
外界(离子)
内界(配离子)
硫酸四氨合铜
①配离子念法:配位数→配体名称→合→中心原子(离子)名称
②配合物→类似于盐(酸、碱)的念法
配合物的命名
配合物中外界中的离子能电离出来,而内界中的离子不能电离出来。
配合物的形成
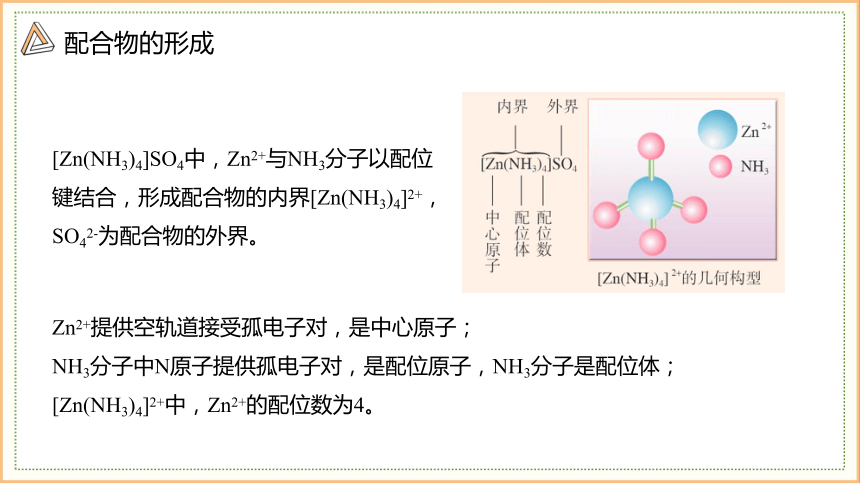
Zn2+提供空轨道接受孤电子对,是中心原子;
NH3分子中N原子提供孤电子对,是配位原子,NH3分子是配位体;
[Zn(NH3)4]2+中,Zn2+的配位数为4。
[Zn(NH3)4]SO4中,Zn2+与NH3分子以配位键结合,形成配合物的内界[Zn(NH3)4]2+,SO42-为配合物的外界。
配合物的形成
思考:配位键形成的条件是什么?
一方提供孤电子对(配体)
一方提供空轨道
在Fe3+、Cu2+、Zn2+、Ag+、H2O、NH3、CO、F-、CN-中
中心原子:
配位体:
Fe3+、Cu2+、Zn2+、Ag+
H2O、NH3、CO、F-、CN-
配合物的形成
中心原子(离子):提供空轨道,接受孤电子对。
通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等;
其他可提供空轨道的粒子有H+、B、Al。
配位体:提供孤电子对的分子或离子,
通常是含第ⅤA、ⅥA、ⅦA族元素形成的分子或离子,如NH3、CO、H2O、F-、Cl-、OH-、CN-、SCN-等。
中心原子
具有空轨道的原子或离子,常是过渡金属的原子或离子。
配位原子
提供孤电子对的原子,常是ⅤA ⅥA ⅦA族原子。
不一定,有的配合物没有外界。如Fe(CO)5、Fe(SCN)3。
有的配合物有多种配体。如[Cu(NH3)2(H2O)2] SO4、[Co(SO4)(NH3)5]Br、[Co(NH3)5Br]SO4。
思考:配合物一定是由内界和外界组成吗?
配合物的形成
配合物整体(包括内界和外界)显电中性,外界离子所带电荷总数等于配离子的电荷数。
如K3[Fe(CN)6],外界总电荷数为+3,内界为-3,又知CN-为-1价,中心原子Fe为+3价。
如[Cr(H2O)5Cl]Cl2·H2O,配位体是H2O和Cl-,配位数为6。
一个中心原子(离子)可同时结合多种配位体。
配合物的结构特点
配合物的结构特点
配合物的内界不仅可为阳离子、阴离子,还可以是中性分子。
如K3[Fe(CN)6],内界为[Fe(CN)6]3-,Fe(CO)5为电中性,没有外界。
对于具有内外界的配合物,中心原子和配位体通过配位键结合,一般很难发生解离;内、外界之间以离子键结合,在水溶液中较易电离。
可以通过实验方法确定有些配合物的内界和外界,如[Co(NH3)5Cl]Cl2,由于外界的Cl-易电离,可以通过实验测定外界含有的Cl-个数,从而确定配合物的化学式。
配合物 配离子 中心原子(离子) 配位原子 配位体 配位数
[Co(NH3)6]Cl3
[Cu(H2O)4]SO4
[Fe(H2O)6]2(SO4)3
[Ag(NH3)2]OH
[Cu(NH3)4]SO4
6
Co3+
N
[Cu(H2O)4]2+
Cu2+
O
H2O
4
[Fe(H2O)6]3+
Fe3+
O
H2O
6
[Ag(NH3)2]+
Ag+
N
NH3
2
[Cu(NH3)4]2+
Cu2+
N
NH3
4
[Co(NH3)6]3+
NH3
配位键的表示方法
H
O
H
H
Cu
H2O
H2O
H2O
OH2
2+
[Cu(H2O)4]2+
(电子对给予体)A→B(电子对接受体)或A—B
+
Cu
NH3
NH3
H3N
NH3
2+
SO4
[Cu(NH3)4]SO4
H3O+
配位键
②配位键同样具有饱和性和方向性,一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
①配位键是一种特殊的共价键,配位键与共价键性质完全相同。
③H3O+、NH4+中含有配位键。
判断配位键的常用方法
①看成键原子(或离子)的特点,一方提供空轨道,另一方有孤电子对;
②看成键原子(或离子)双方的成键能力,成键能力一般等于8-最外层电子数,或等于最外层电子数,超出成键能力的键为配位键;
③看化学式的写法,一般“·H2O”这样含结晶水类的微粒中均含有配位键。
思考与讨论
NH3有孤电子对,H+有空轨道,NH3中的孤电子对进入H+的空轨道,两者共用形成配位键。
共价键有饱和性,但NH3为什么仍能与H+结合生成NH4+呢
配合物的空间结构
含有两种或两种以上配位体的配合物,若配位体在空间的排列方式不同,就能形成不同几何构型的配合物。
如Pt(NH3)2Cl2就有顺式和反式两种异构体。
顺式Pt(NH3)2Cl2和反式Pt(NH3)2Cl2的颜色、在水中的溶解性等性质有一定差异。
配合物的空间结构
配合物离子的空间结构
过渡金属元素(特别是过渡金属元素的离子)一般都能形成配合物。因为过渡金属原子或离子都有接受电子对的空轨道,它们都能与可提供孤电子对的分子或离子以配位键结合形成配合物。
配合物的中心原子、配位体的种类和数目不同,可以形成不同空间结构的配合物。
配位数 杂化轨道类型 空间结构 结构示意图 实例
2 sp 直线形 [Ag(NH3)2]+ [Cu(NH3)2]+
4 sp3 正四面 体形 [Zn(NH3)4]2+ [ZnCl4]2-
sp2d (dsp2) 平面正 方形 [Ni(CN)4]2- [Cu(NH3)4]2+
6 sp3d2 (d2sp3) 正八 面体 [AlF6]3- [Co(NH3)6]3+
配合物离子的空间结构
配合物内界中共价键数目的判断
若配位体为单核离子如Cl-等,可以不予计入;
若为分子,需要用配位体分子内的共价键数乘以该配位体的个数;
此外,还要加上中心原子与配位体形成的配位键,这也是共价键。
例如:配合物[Co(NH3)4Cl2]Cl的共价键数为
3×4+4+2=18
1.向盛有CuSO4溶液的试管中滴加浓氨水,先生成难溶物,继续滴加浓氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(H2O)4]2+
C.该实验能证明[Cu(NH3)4]2+比Cu(OH)2稳定
D.在配离子[Cu(NH3)4]2+中,Cu2+提供孤电子对,NH3提供空轨道
C
2.关于配合物[Zn(NH3)4]Cl2的说法正确的是( )
A.配位数为6
B.配位体为NH3和Cl-
C.[Zn(NH3)4]2+为内界
D.Zn2+和NH3以离子键结合
C
3. 某配合物W的化学式为[TiCl(H2O)5]Cl2·H2O,下列说法正确的是( )
A.中心离子Ti4+提供空轨道
B.0.01 mol·L-1的W溶液中c(Cl-)=0.02 mol·L-1
C.基态钛原子的外围电子数为2
D.该配合物的配体为H2O
B
配合物的形成
与空间结构
1.认识简单配位化合物的成键特征。
2.能正确运用化学符号描述配合物的组成。
3.学会简单配合物的实验制备。
配合物的形成
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色。
[Cu(NH3)4]SO4
硫酸四氨合铜
将[Cu(NH3)4]SO4溶于水,[Cu(NH3)4]SO4发生下列电离:
[Cu(NH3)4]SO4=== [Cu(NH3)4]2++ SO42-
说明[Cu(NH3)4]2+中Cu2+和NH3分子之间存在较为强烈的相互作用。
四氨合铜离子
配合物的形成
配合物的形成
在水溶液中,Cu2+与NH3分子是如何结合成[Cu(NH3)4]2+的呢?
配体
中心离子
Cu2+
(具有空轨道)
Cu2+
NH3
H3N
H3N
NH3
配位键
孤电子对
NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。
配合物的形成
Cu
NH3
NH3
H3N
NH3
2+
SO4
配体
配位键
配离子
中心离子
由提供孤电子对的配位体与接受孤电子对的中心原子以配位键结合形成的化合物称为配位化合物,简称配合物。
2-
硫酸四氨合铜
配合物的形成
配位数
[Cu(NH3)4]SO4
配位体
中心原子
外界(离子)
内界(配离子)
硫酸四氨合铜
①配离子念法:配位数→配体名称→合→中心原子(离子)名称
②配合物→类似于盐(酸、碱)的念法
配合物的命名
配合物中外界中的离子能电离出来,而内界中的离子不能电离出来。
配合物的形成
Zn2+提供空轨道接受孤电子对,是中心原子;
NH3分子中N原子提供孤电子对,是配位原子,NH3分子是配位体;
[Zn(NH3)4]2+中,Zn2+的配位数为4。
[Zn(NH3)4]SO4中,Zn2+与NH3分子以配位键结合,形成配合物的内界[Zn(NH3)4]2+,SO42-为配合物的外界。
配合物的形成
思考:配位键形成的条件是什么?
一方提供孤电子对(配体)
一方提供空轨道
在Fe3+、Cu2+、Zn2+、Ag+、H2O、NH3、CO、F-、CN-中
中心原子:
配位体:
Fe3+、Cu2+、Zn2+、Ag+
H2O、NH3、CO、F-、CN-
配合物的形成
中心原子(离子):提供空轨道,接受孤电子对。
通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等;
其他可提供空轨道的粒子有H+、B、Al。
配位体:提供孤电子对的分子或离子,
通常是含第ⅤA、ⅥA、ⅦA族元素形成的分子或离子,如NH3、CO、H2O、F-、Cl-、OH-、CN-、SCN-等。
中心原子
具有空轨道的原子或离子,常是过渡金属的原子或离子。
配位原子
提供孤电子对的原子,常是ⅤA ⅥA ⅦA族原子。
不一定,有的配合物没有外界。如Fe(CO)5、Fe(SCN)3。
有的配合物有多种配体。如[Cu(NH3)2(H2O)2] SO4、[Co(SO4)(NH3)5]Br、[Co(NH3)5Br]SO4。
思考:配合物一定是由内界和外界组成吗?
配合物的形成
配合物整体(包括内界和外界)显电中性,外界离子所带电荷总数等于配离子的电荷数。
如K3[Fe(CN)6],外界总电荷数为+3,内界为-3,又知CN-为-1价,中心原子Fe为+3价。
如[Cr(H2O)5Cl]Cl2·H2O,配位体是H2O和Cl-,配位数为6。
一个中心原子(离子)可同时结合多种配位体。
配合物的结构特点
配合物的结构特点
配合物的内界不仅可为阳离子、阴离子,还可以是中性分子。
如K3[Fe(CN)6],内界为[Fe(CN)6]3-,Fe(CO)5为电中性,没有外界。
对于具有内外界的配合物,中心原子和配位体通过配位键结合,一般很难发生解离;内、外界之间以离子键结合,在水溶液中较易电离。
可以通过实验方法确定有些配合物的内界和外界,如[Co(NH3)5Cl]Cl2,由于外界的Cl-易电离,可以通过实验测定外界含有的Cl-个数,从而确定配合物的化学式。
配合物 配离子 中心原子(离子) 配位原子 配位体 配位数
[Co(NH3)6]Cl3
[Cu(H2O)4]SO4
[Fe(H2O)6]2(SO4)3
[Ag(NH3)2]OH
[Cu(NH3)4]SO4
6
Co3+
N
[Cu(H2O)4]2+
Cu2+
O
H2O
4
[Fe(H2O)6]3+
Fe3+
O
H2O
6
[Ag(NH3)2]+
Ag+
N
NH3
2
[Cu(NH3)4]2+
Cu2+
N
NH3
4
[Co(NH3)6]3+
NH3
配位键的表示方法
H
O
H
H
Cu
H2O
H2O
H2O
OH2
2+
[Cu(H2O)4]2+
(电子对给予体)A→B(电子对接受体)或A—B
+
Cu
NH3
NH3
H3N
NH3
2+
SO4
[Cu(NH3)4]SO4
H3O+
配位键
②配位键同样具有饱和性和方向性,一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
①配位键是一种特殊的共价键,配位键与共价键性质完全相同。
③H3O+、NH4+中含有配位键。
判断配位键的常用方法
①看成键原子(或离子)的特点,一方提供空轨道,另一方有孤电子对;
②看成键原子(或离子)双方的成键能力,成键能力一般等于8-最外层电子数,或等于最外层电子数,超出成键能力的键为配位键;
③看化学式的写法,一般“·H2O”这样含结晶水类的微粒中均含有配位键。
思考与讨论
NH3有孤电子对,H+有空轨道,NH3中的孤电子对进入H+的空轨道,两者共用形成配位键。
共价键有饱和性,但NH3为什么仍能与H+结合生成NH4+呢
配合物的空间结构
含有两种或两种以上配位体的配合物,若配位体在空间的排列方式不同,就能形成不同几何构型的配合物。
如Pt(NH3)2Cl2就有顺式和反式两种异构体。
顺式Pt(NH3)2Cl2和反式Pt(NH3)2Cl2的颜色、在水中的溶解性等性质有一定差异。
配合物的空间结构
配合物离子的空间结构
过渡金属元素(特别是过渡金属元素的离子)一般都能形成配合物。因为过渡金属原子或离子都有接受电子对的空轨道,它们都能与可提供孤电子对的分子或离子以配位键结合形成配合物。
配合物的中心原子、配位体的种类和数目不同,可以形成不同空间结构的配合物。
配位数 杂化轨道类型 空间结构 结构示意图 实例
2 sp 直线形 [Ag(NH3)2]+ [Cu(NH3)2]+
4 sp3 正四面 体形 [Zn(NH3)4]2+ [ZnCl4]2-
sp2d (dsp2) 平面正 方形 [Ni(CN)4]2- [Cu(NH3)4]2+
6 sp3d2 (d2sp3) 正八 面体 [AlF6]3- [Co(NH3)6]3+
配合物离子的空间结构
配合物内界中共价键数目的判断
若配位体为单核离子如Cl-等,可以不予计入;
若为分子,需要用配位体分子内的共价键数乘以该配位体的个数;
此外,还要加上中心原子与配位体形成的配位键,这也是共价键。
例如:配合物[Co(NH3)4Cl2]Cl的共价键数为
3×4+4+2=18
1.向盛有CuSO4溶液的试管中滴加浓氨水,先生成难溶物,继续滴加浓氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(H2O)4]2+
C.该实验能证明[Cu(NH3)4]2+比Cu(OH)2稳定
D.在配离子[Cu(NH3)4]2+中,Cu2+提供孤电子对,NH3提供空轨道
C
2.关于配合物[Zn(NH3)4]Cl2的说法正确的是( )
A.配位数为6
B.配位体为NH3和Cl-
C.[Zn(NH3)4]2+为内界
D.Zn2+和NH3以离子键结合
C
3. 某配合物W的化学式为[TiCl(H2O)5]Cl2·H2O,下列说法正确的是( )
A.中心离子Ti4+提供空轨道
B.0.01 mol·L-1的W溶液中c(Cl-)=0.02 mol·L-1
C.基态钛原子的外围电子数为2
D.该配合物的配体为H2O
B
