7.2 课时2 硝酸(20页) 课件 2024-2025学年高一化学苏教版(2019)必修2
文档属性
| 名称 | 7.2 课时2 硝酸(20页) 课件 2024-2025学年高一化学苏教版(2019)必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 31.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-01 18:36:20 | ||
图片预览






文档简介
(共20张PPT)
硝酸
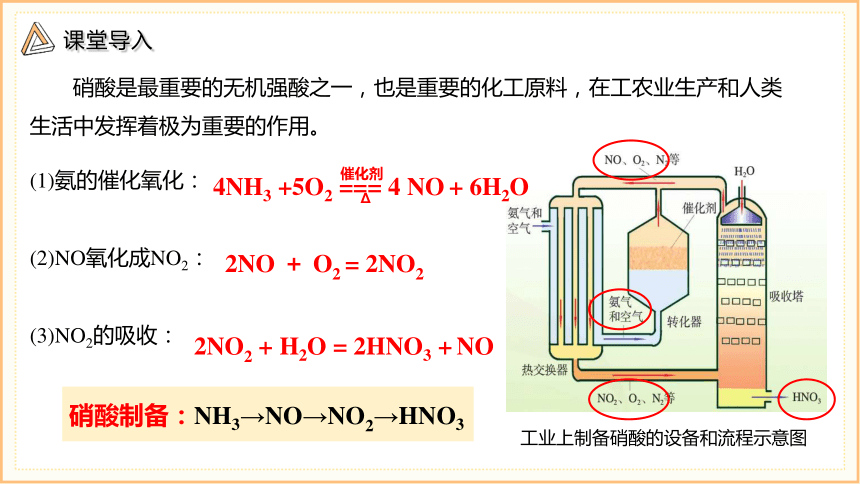
硝酸是最重要的无机强酸之一,也是重要的化工原料,在工农业生产和人类生活中发挥着极为重要的作用。
工业上制备硝酸的设备和流程示意图
(1)氨的催化氧化:
(2)NO氧化成NO2:
(3)NO2的吸收:
4NH3 +5O2 === 4 NO + 6H2O
催化剂
Δ
2NO + O2 = 2NO2
2NO2 + H2O = 2HNO3 + NO
硝酸制备:NH3→NO→NO2→HNO3
一、硝酸的物理性质
硝酸是一种无色、易挥发、具有刺激性气味的液体,沸点为83℃,密度为1.42g·cm-3,能与水以任意比互溶。市售浓硝酸的质量分数约为69%。
开瓶瓶口有白雾
发烟硝酸(ω>98%)
参与化学反应温度不宜过高
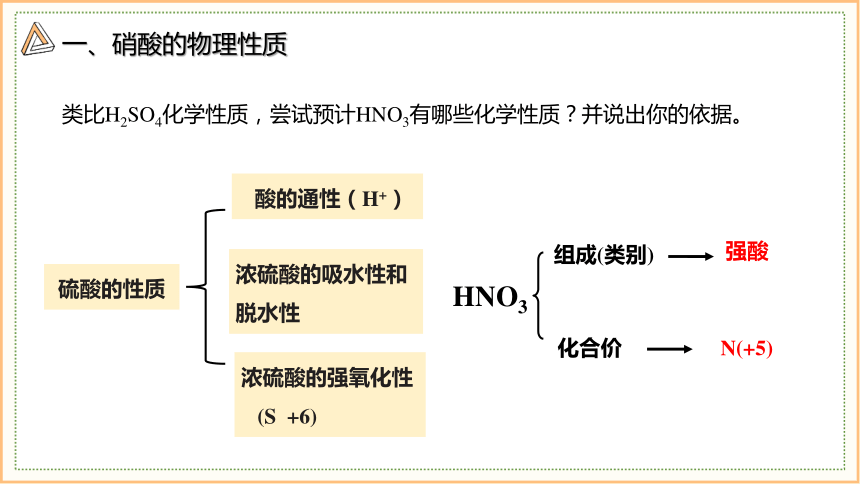
类比H2SO4化学性质,尝试预计HNO3有哪些化学性质?并说出你的依据。
硫酸的性质
酸的通性(H+)
浓硫酸的吸水性和脱水性
浓硫酸的强氧化性
(S +6)
组成(类别)
化合价
强酸
N(+5)
HNO3
一、硝酸的物理性质
1、浓/稀硝酸的强酸性
(1)HNO3=H++NO3-(酸的通性)
(2)和CuO反应(碱性氧化物)
(3)和Fe(OH)3反应(碱)
(4) 和Na2CO3反应(弱酸的盐)
二、硝酸的化学性质
NaOH + HNO3 = NaNO3 + H2O
Fe(OH)3 + 3HNO3 = Fe(NO3)3+ 3H2O
Na2CO3 + 2HNO3 = 2NaNO3 + H2O+CO2↑
CuO + 2HNO3 = Cu(NO3)2 + H2O
不能和金属反应制备H2
2、不稳定性
见光或受热分解
市售浓硝酸常因溶有少量NO2而显黄色
思考:怎样去除黄色,怎样保存硝酸呢?
向硝酸缓慢通入O2,能消除黄色,原理:4NO2 + O2 + 2H2O = 4HNO3
硝酸密封贮存棕色细口瓶,并置于低温、避光处。
见光易分解的物质 :氯水、AgNO3、AgBr、AgI等
性质决定储存
二、硝酸的化学性质
学以致用
浓硝酸的泄漏
升起大股黄烟,黄烟带有强烈刺鼻味
如果你是消防人员,你将如何处理?
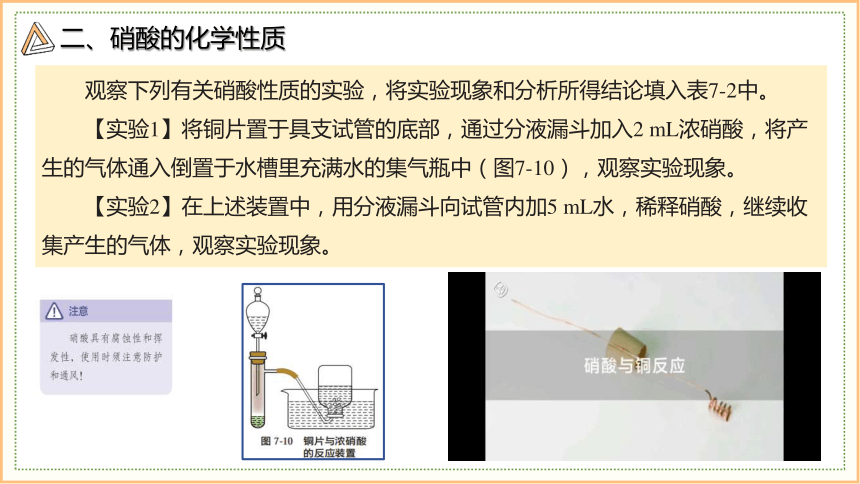
观察下列有关硝酸性质的实验,将实验现象和分析所得结论填入表7-2中。
【实验1】将铜片置于具支试管的底部,通过分液漏斗加入2 mL浓硝酸,将产生的气体通入倒置于水槽里充满水的集气瓶中(图7-10),观察实验现象。
【实验2】在上述装置中,用分液漏斗向试管内加5 mL水,稀释硝酸,继续收集产生的气体,观察实验现象。
二、硝酸的化学性质
实验序号 实验现象 化学方程式
实验1
实验2
产生红棕色气体,溶液变蓝绿色,收集到无色气体
Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O
3NO2 + H2O = 2HNO3 + NO(无色气体)
产生无色气体,溶液变蓝绿色,收集到无色气体
3Cu + 8HNO3(稀)= 3Cu(NO3)2 +2NO↑ + 4H2O
二、硝酸的化学性质
3、强氧化性
(1)与金属反应(除Au、Pt外)
Cu + 4HNO3 (浓)= Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3 (稀)= 3Cu(NO3)2 + 2NO↑ + 4H2O
Cu + 4H+ + 2NO3- = Cu2+ + 2NO2 ↑+ 2H2O
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O
硝酸表现强氧化性外,还有酸性
控制反应的发生和停止
吸收NO2,
防止污染空气
铜丝弯曲为螺旋状,是增大与硝酸的接触面积,加快反应速率。
二、硝酸的化学性质
注:常温下,铁、铝遇浓硝酸钝化,形成一层致密的氧化膜,阻止继续反应。故能用铁制或铝制容器盛装浓硝酸。加热时,铁、铝可以与浓硝酸反应。
二、硝酸的化学性质
Fe + 4H++NO3 - = Fe3+ + NO↑ + 2H2O
3Fe + 8H++2NO3- = 3 Fe2++ 2NO↑ + 4H2O
Fe与稀硝酸反应:
硝酸过量
硝酸少量
Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑+ 2H2O
Fe + 2Fe(NO3)3 = 3Fe(NO3)2
×2
+
铁粉过量
3Fe + 8HNO3(稀) = 3Fe(NO3)2 + 2NO↑+ 4H2O
二、硝酸的化学性质
注意:
1、硝酸几乎可以使所有金属(金、铂 除外)氧化而生成硝酸盐。
2、硝酸与金属反应不放出氢气,反应中表现出氧化性和酸性;
3、一般情况下: 浓硝酸被还原为NO2 稀硝酸被还原为NO;
4、氧化性:浓硝酸>稀硝酸
二、硝酸的化学性质
劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,受人之托的玻尔急得团团转。同在实验室工作的一位匈牙利化学家赫维西(1943年化学奖得主)帮他想了个好主意:将奖牌放入“王水” 中,纯金奖牌便溶解了。玻尔于是将溶液瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,溶液瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造,于1949年完璧归赵。
能使不溶于硝酸的金属如金、铂等溶解。
浓硝酸和浓盐酸按体积比为1∶3混合得到的混合物。
王 水
【资料卡片】
(2)与非金属反应
实验现象:产生红棕色气体
C + 4HNO3(浓) = CO2 ↑+ 4NO2↑ + 2H2O
Δ
思考:反应中浓硝酸除有强氧化性外,还有其他性质吗?
S + 6HNO3(浓) = 6NO2↑ +H2SO4 + 2H2O
△
二、硝酸的化学性质
(3)与其他还原性物质反应
硝酸的强氧化性还表现在可以氧化具有还原性的化合物或离子,如HI、HBr、SO2、Fe2+、FeO、Br-、I-、S2-、SO32-等均能被HNO3氧化。
3Fe2+ + 4H+ + NO3- = 3Fe3+ + NO↑ + 2H2O
3FeO +10HNO3 = 3Fe(NO3)3 + NO↑+ 5H2O
二、硝酸的化学性质
硝酸甘油用于治疗冠心病
硝化纤维塑料
黄色炸药
三、硝酸的用途
硝酸是一种重要的化工原料,常用来制造氮肥、燃料、塑料、炸药、硝酸盐等。
氮 肥
染 料
1、将硝酸表现出的性质(代号字母)填在下列各反应操作或现象后:
A.氧化性 B.酸性 C.还原性 D.不稳定性
(1)久置的浓硝酸变黄色________。
(2)用硝酸浸洗附有银的试管________。
(3)常温下用铁制或铝制容器贮存、运输浓HNO3____________。
(4)用稀HNO3浸洗久置石灰水试剂瓶上的固体____________。
(5)用Cu和稀HNO3制NO气体________。
2、工业上用洗净的废铜屑作原料制取硝酸铜。为节约原料和防止环境污染,宜采取的方法是( )
C
课堂总结
HNO3
组成(类别)
化合价
特性:
强酸
氧化性
N(+5)
和金属反应
Cu; Fe/Al;
和非金属反应
C、S
钝化
受热或见光分解
NH3→NO→NO2→HNO3
-3 +2 +4 +5
硝酸
硝酸是最重要的无机强酸之一,也是重要的化工原料,在工农业生产和人类生活中发挥着极为重要的作用。
工业上制备硝酸的设备和流程示意图
(1)氨的催化氧化:
(2)NO氧化成NO2:
(3)NO2的吸收:
4NH3 +5O2 === 4 NO + 6H2O
催化剂
Δ
2NO + O2 = 2NO2
2NO2 + H2O = 2HNO3 + NO
硝酸制备:NH3→NO→NO2→HNO3
一、硝酸的物理性质
硝酸是一种无色、易挥发、具有刺激性气味的液体,沸点为83℃,密度为1.42g·cm-3,能与水以任意比互溶。市售浓硝酸的质量分数约为69%。
开瓶瓶口有白雾
发烟硝酸(ω>98%)
参与化学反应温度不宜过高
类比H2SO4化学性质,尝试预计HNO3有哪些化学性质?并说出你的依据。
硫酸的性质
酸的通性(H+)
浓硫酸的吸水性和脱水性
浓硫酸的强氧化性
(S +6)
组成(类别)
化合价
强酸
N(+5)
HNO3
一、硝酸的物理性质
1、浓/稀硝酸的强酸性
(1)HNO3=H++NO3-(酸的通性)
(2)和CuO反应(碱性氧化物)
(3)和Fe(OH)3反应(碱)
(4) 和Na2CO3反应(弱酸的盐)
二、硝酸的化学性质
NaOH + HNO3 = NaNO3 + H2O
Fe(OH)3 + 3HNO3 = Fe(NO3)3+ 3H2O
Na2CO3 + 2HNO3 = 2NaNO3 + H2O+CO2↑
CuO + 2HNO3 = Cu(NO3)2 + H2O
不能和金属反应制备H2
2、不稳定性
见光或受热分解
市售浓硝酸常因溶有少量NO2而显黄色
思考:怎样去除黄色,怎样保存硝酸呢?
向硝酸缓慢通入O2,能消除黄色,原理:4NO2 + O2 + 2H2O = 4HNO3
硝酸密封贮存棕色细口瓶,并置于低温、避光处。
见光易分解的物质 :氯水、AgNO3、AgBr、AgI等
性质决定储存
二、硝酸的化学性质
学以致用
浓硝酸的泄漏
升起大股黄烟,黄烟带有强烈刺鼻味
如果你是消防人员,你将如何处理?
观察下列有关硝酸性质的实验,将实验现象和分析所得结论填入表7-2中。
【实验1】将铜片置于具支试管的底部,通过分液漏斗加入2 mL浓硝酸,将产生的气体通入倒置于水槽里充满水的集气瓶中(图7-10),观察实验现象。
【实验2】在上述装置中,用分液漏斗向试管内加5 mL水,稀释硝酸,继续收集产生的气体,观察实验现象。
二、硝酸的化学性质
实验序号 实验现象 化学方程式
实验1
实验2
产生红棕色气体,溶液变蓝绿色,收集到无色气体
Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O
3NO2 + H2O = 2HNO3 + NO(无色气体)
产生无色气体,溶液变蓝绿色,收集到无色气体
3Cu + 8HNO3(稀)= 3Cu(NO3)2 +2NO↑ + 4H2O
二、硝酸的化学性质
3、强氧化性
(1)与金属反应(除Au、Pt外)
Cu + 4HNO3 (浓)= Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3 (稀)= 3Cu(NO3)2 + 2NO↑ + 4H2O
Cu + 4H+ + 2NO3- = Cu2+ + 2NO2 ↑+ 2H2O
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O
硝酸表现强氧化性外,还有酸性
控制反应的发生和停止
吸收NO2,
防止污染空气
铜丝弯曲为螺旋状,是增大与硝酸的接触面积,加快反应速率。
二、硝酸的化学性质
注:常温下,铁、铝遇浓硝酸钝化,形成一层致密的氧化膜,阻止继续反应。故能用铁制或铝制容器盛装浓硝酸。加热时,铁、铝可以与浓硝酸反应。
二、硝酸的化学性质
Fe + 4H++NO3 - = Fe3+ + NO↑ + 2H2O
3Fe + 8H++2NO3- = 3 Fe2++ 2NO↑ + 4H2O
Fe与稀硝酸反应:
硝酸过量
硝酸少量
Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑+ 2H2O
Fe + 2Fe(NO3)3 = 3Fe(NO3)2
×2
+
铁粉过量
3Fe + 8HNO3(稀) = 3Fe(NO3)2 + 2NO↑+ 4H2O
二、硝酸的化学性质
注意:
1、硝酸几乎可以使所有金属(金、铂 除外)氧化而生成硝酸盐。
2、硝酸与金属反应不放出氢气,反应中表现出氧化性和酸性;
3、一般情况下: 浓硝酸被还原为NO2 稀硝酸被还原为NO;
4、氧化性:浓硝酸>稀硝酸
二、硝酸的化学性质
劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,受人之托的玻尔急得团团转。同在实验室工作的一位匈牙利化学家赫维西(1943年化学奖得主)帮他想了个好主意:将奖牌放入“王水” 中,纯金奖牌便溶解了。玻尔于是将溶液瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,溶液瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造,于1949年完璧归赵。
能使不溶于硝酸的金属如金、铂等溶解。
浓硝酸和浓盐酸按体积比为1∶3混合得到的混合物。
王 水
【资料卡片】
(2)与非金属反应
实验现象:产生红棕色气体
C + 4HNO3(浓) = CO2 ↑+ 4NO2↑ + 2H2O
Δ
思考:反应中浓硝酸除有强氧化性外,还有其他性质吗?
S + 6HNO3(浓) = 6NO2↑ +H2SO4 + 2H2O
△
二、硝酸的化学性质
(3)与其他还原性物质反应
硝酸的强氧化性还表现在可以氧化具有还原性的化合物或离子,如HI、HBr、SO2、Fe2+、FeO、Br-、I-、S2-、SO32-等均能被HNO3氧化。
3Fe2+ + 4H+ + NO3- = 3Fe3+ + NO↑ + 2H2O
3FeO +10HNO3 = 3Fe(NO3)3 + NO↑+ 5H2O
二、硝酸的化学性质
硝酸甘油用于治疗冠心病
硝化纤维塑料
黄色炸药
三、硝酸的用途
硝酸是一种重要的化工原料,常用来制造氮肥、燃料、塑料、炸药、硝酸盐等。
氮 肥
染 料
1、将硝酸表现出的性质(代号字母)填在下列各反应操作或现象后:
A.氧化性 B.酸性 C.还原性 D.不稳定性
(1)久置的浓硝酸变黄色________。
(2)用硝酸浸洗附有银的试管________。
(3)常温下用铁制或铝制容器贮存、运输浓HNO3____________。
(4)用稀HNO3浸洗久置石灰水试剂瓶上的固体____________。
(5)用Cu和稀HNO3制NO气体________。
2、工业上用洗净的废铜屑作原料制取硝酸铜。为节约原料和防止环境污染,宜采取的方法是( )
C
课堂总结
HNO3
组成(类别)
化合价
特性:
强酸
氧化性
N(+5)
和金属反应
Cu; Fe/Al;
和非金属反应
C、S
钝化
受热或见光分解
NH3→NO→NO2→HNO3
-3 +2 +4 +5
