7.3 课时1 常见氮肥及其使用 氮氧化物的无害化处理(30页) 课件 2024-2025学年高一化学苏教版(2019)必修2
文档属性
| 名称 | 7.3 课时1 常见氮肥及其使用 氮氧化物的无害化处理(30页) 课件 2024-2025学年高一化学苏教版(2019)必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 67.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-01 18:37:15 | ||
图片预览








文档简介
(共31张PPT)
常见氮肥及其使用
氮氧化物的无害化处理
1、能以含氮化合物之间的转化为例,分析和探讨化学工业对人类健康、社会可持续发展可能带来的影响,树立实事求是的科学态度;
2、能运用绿色化学的思想对化学品的生产和使用进行初步的评估,提出处理环境污染物的建议。
含氮化合物的生产和使用,也会给我们的生活和社会发展带来一些不利的影响。如过量和不当施用氮肥引起的土壤和水体污染,汽车发动机尾气中的氮氧化物导致空气污染等。合理使用含氮化合物必须首先了解其性质,以减少或消除有害环境的物质。
一、铵盐的性质
1、定义:
由铵根离子(NH4+)与酸根离子形成的离子化合物
NH4Cl
(NH4)2SO4
NH4HCO3
(NH4)2CO3
NH4NO3
颜色 溶解性 状态
2、铵盐物理性质
无色
易溶于水
晶体
性质类似
思考:从铵盐的组成分析为什么它们的物理性质相似?
仔细观察下列实验现象,并将有关反应的化学方程式填入表7-3中。
【实验1】取少量氯化铵和碳酸氢铵,分别放入两支试管中,在酒精灯火焰上微热,观察发生的现象。
3、铵盐化学性质
一、铵盐的性质
3、铵盐化学性质
实验现象:
实验结论:
实验现象:
实验结论:
固体逐渐减少,产生有刺激性气味气体,试管口有白色固体生成。
NH4Cl受热分解产生NH3
NH4Cl NH3↑+HCl↑
试管中固体逐渐减少,试纸变蓝
NH4HCO3分解产生NH3
NH4HCO3 NH3↑+CO2↑+H2O
一、铵盐的性质
硝酸铵受热分解
铵盐受热分解都产生氨气吗?
汽车安全气囊内就有NH NO ,受到剧烈的撞击后会放出大量的气体,从而保护司机免受二次伤害。NH NO 在有可燃物存在或撞击的条件下,会产生爆炸反应:2NH NO = 2N2 ↑+O ↑+4H O↑。
500℃
思考:怎样存放铵态氮肥?
密封包装并放在阴凉通风干燥处
一、铵盐的性质
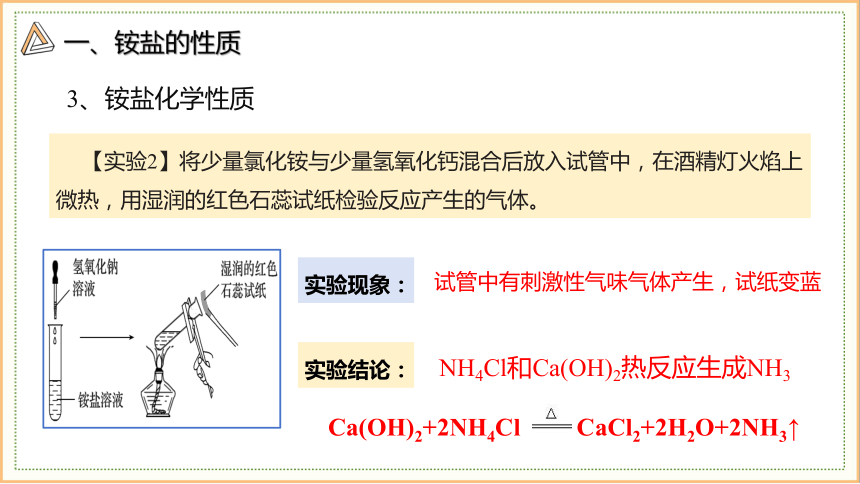
【实验2】将少量氯化铵与少量氢氧化钙混合后放入试管中,在酒精灯火焰上微热,用湿润的红色石蕊试纸检验反应产生的气体。
3、铵盐化学性质
实验现象:
实验结论:
试管中有刺激性气味气体产生,试纸变蓝
NH4Cl和Ca(OH)2热反应生成NH3
Ca(OH)2+2NH4Cl CaCl2+2H2O+2NH3↑
一、铵盐的性质
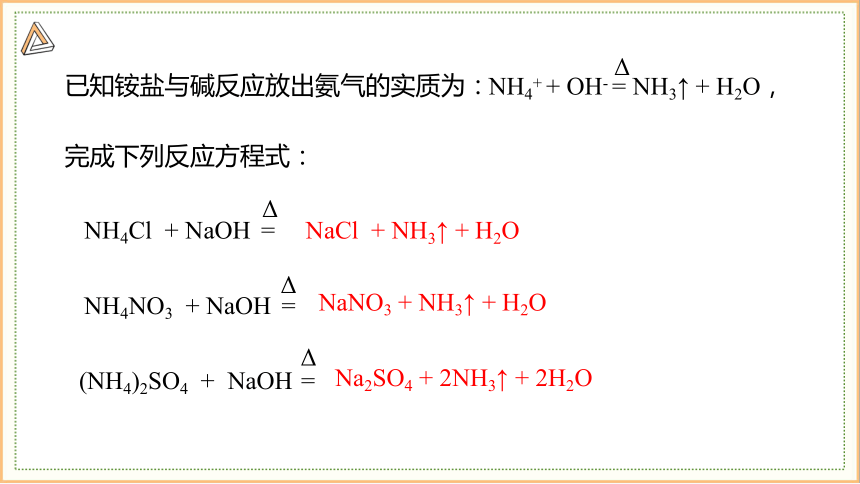
已知铵盐与碱反应放出氨气的实质为:
NH4NO3 + NaOH =
Δ
NH4Cl + NaOH =
Δ
(NH4)2SO4 + NaOH =
Δ
完成下列反应方程式:
NH4+ + OH- = NH3↑ + H2O,
Δ
NaCl + NH3↑ + H2O
NaNO3 + NH3↑ + H2O
Na2SO4 + 2NH3↑ + 2H2O
实质:
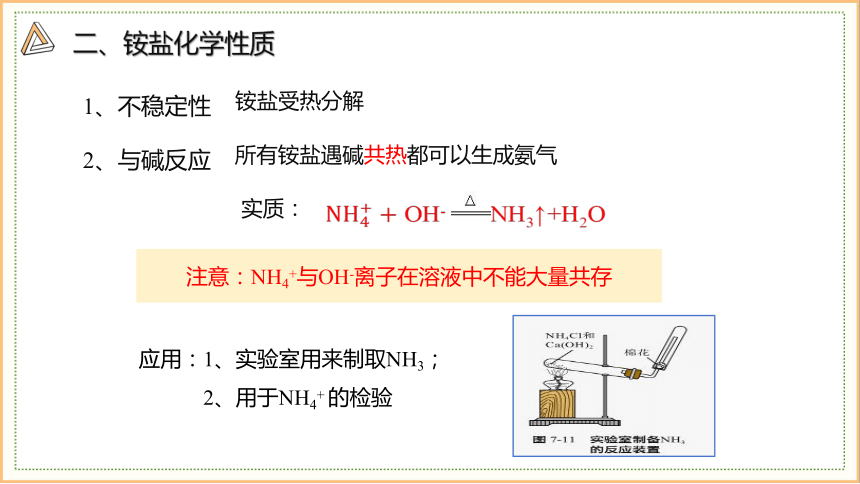
二、铵盐化学性质
2、与碱反应
1、不稳定性
所有铵盐遇碱共热都可以生成氨气
铵盐受热分解
OH- NH3↑+H2O
应用:1、实验室用来制取NH3;
2、用于NH4+ 的检验
注意:NH4+与OH-离子在溶液中不能大量共存
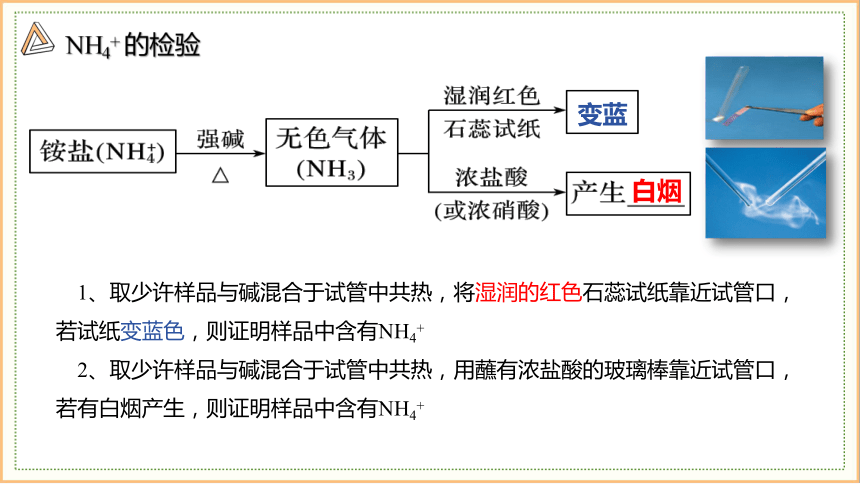
NH4+ 的检验
变蓝
白烟
1、取少许样品与碱混合于试管中共热,将湿润的红色石蕊试纸靠近试管口,若试纸变蓝色,则证明样品中含有NH4+
2、取少许样品与碱混合于试管中共热,用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+
1、下列叙述中的实验操作所对应的结论正确的是( )
选项 实验操作 结论
A 向某无色溶液中滴加NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体 则该无色溶液中一定不含NH4+
B 某小组进行NH3催化氧化实验时,产生了红棕色气体 NH3催化氧化的产物为NO2
C 加热NH4Cl固体可分解产生NH3和HCl 该法可用于实验室制取NH3
D 通入SO2可使滴有酚酞的氨水褪色 氨水呈碱性
D
2、能鉴别Na2SO4、NH4NO3、KCl、(NH4)2SO4四种溶液(可以加热)的一种试剂是( )
A.BaCl2溶液 B.Ba(NO3)2溶液
C.Ba(OH)2溶液 D.AgNO3溶液
C
3、下列离子方程式书写正确的是( )
A.在实验室用氯化铵和熟石灰制氨:NH4++OH- NH3↑+H2O
B.NaOH溶液与NH4Cl溶液混合加热:NH4++OH- NH3·H2O
C.氨水中加盐酸:NH3·H2O+H+=NH4++H2O
D.氨水中加氯化铁溶液:Fe3++3OH-=Fe(OH)3↓
C
充足的氮能使植物枝叶茂盛,叶片增大,光合作用增强,促进氨基酸和蛋白质的形成,从而使农作物的产量和产品质量得以提高。
如果不施化肥,中国只能养活2亿多人口,剩下12亿人就没饭吃。
氮肥,是指以氮(N)为主要成分,施于土壤可提供植物氮素营养的肥料。氮肥是世界化肥生产和使用量最大的肥料品种;适宜的氮肥用量对于提高作物产量、改善农产品质量有重要作用。化学氮肥生产的主要原料是合成氨。20世纪四五十年代,硫酸铵是最主要的氮肥品种;60年代,增加了硝酸铵;70年代以来,尿素成为主导的氮肥品种。碳酸氢铵是中国80年代主要生产的氮肥品种之一。
(NH4)2SO4
NH4HCO3
尿素CO(NH2)2
NH4NO3
三、常见氮肥及其应用
1、分类
铵态氮肥
硝态氮肥
有机氮肥
氮肥
主要成分NH4+
主要成分NO3-
主要是尿素CO(NH2)2
课堂活动:请阅读教材第46、47页内容,归纳整理不同氮肥的使用注意事项。
2、氮肥的使用
(1)、铵态氮肥
结合NH4HCO3、NH4Cl使用说明,归纳铵态氮肥使用时要注意什么?
深施盖土,避免受热
低温保存,防止受潮
不可以跟碱性物质(如草木灰等)混合使用
三、常见氮肥及其应用
(2)硝态氮肥
优点:硝态氮肥包括硝酸钠、硝酸钙等,易溶于水。NO3-不易被以带负电荷为主的土壤胶粒所吸附,在潮湿的土壤中流动性大,容易被植物吸收。
缺点:在土壤湿度大的情况下,硝酸根经微生物作用可还原成气体(NO、N2O、N2)逸出,这种反硝化作用往往导致硝态氮肥的损失。
(1)为什么硝态氮肥不宜在高温天气、多雨的水田区施用,而多用于冷凉的旱地?
(2)为什么适应在pH较高的石灰性土壤中生长的植物优先使用硝态氮肥,而适应在酸性土境中生长的植物优先使用铵态氮肥?
性质决定用途,用途反应性质
三、常见氮肥及其应用
(3)有机氮肥——尿素
性质:尿素的分子式为CO(NH2)2,属于有机氮肥,是一种白色晶体,其中氮的质量分数约为46.7%,是目前固态氮肥中含氮量最高的一种化肥。
特点:中性肥料,适用于各种土壤和作物。肥效高、易保存、使用方便,长期使用对土壤的破坏作用小,所以它是目前使用量最大的一种氮肥。
三、常见氮肥及其应用
C
2、施用氮肥能促进作物生长,并能提高作物中蛋白质的含量。下列关于氮肥的说法错误的是( )
A.尿素CO(NH2)2是一种有机氮肥
B.储存碳酸氢铵时,应密封并置于阴凉通风处
C.铵态氮肥不能与碱性物质如草木灰等混合施用
D.氮肥溶于水,其中的氮元素均以铵根离子形式存在
D
3、化学肥料对环境的影响
对环境的影响:长期使用化肥的土壤,容易酸化、板结。雨水冲刷使肥料离开土壤,进入溪水、河水和湖泊。水中的肥料会使细菌和藻类迅速生长,并消耗水中的氧气,严重时导致水中含氧量减少,许多水生生物随之死亡、腐烂,水质下降。
含有大量的氮、磷的污水排向湖泊,和海域,造成了水体富营养化,出现藻类物质大量繁殖形成赤潮,水华等严重污染问题。
三、常见氮肥及其应用
三、常见氮肥及其应用
2、氮氧化物的来源
(1)化石燃料的燃烧
(2)硝酸生产等排放的废气
(3)机动车辆排放的尾气
四、氮氧化物的无害化处理
1、氮氧化物(NOx):主要包括一氧化氮(NO)、二氧化氮(NO2)
3、光化学烟雾:二氧化氮在日光照射下还能使氧气经过复杂的反应生成臭氧(O3)。臭氧与空气中的氮氧化物和一些碳氢化合物在紫外线的照射下发生作用后,产生了一种有毒的烟雾。光化学烟雾具有特殊气味,刺激眼睛,对人体健康、植物生长等都有很大的危害。
酸雨:3NO2+H2O=2HNO3+NO
四、氮氧化物的无害化处理
4、减少汽车尾气危害的措施
(1)以甲醇、液化气代替汽油;
(2)安装汽车尾气净化装置,将NOx转化为中性的、无污染的氮气;
(3)使用以液化天然气(LNG)或高效燃料电池作为动力的新型环保汽车。
四、氮氧化物的无害化处理
碱液吸收法:
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
实验室尾气处理方法
1、大气中下列气体含量的升高会对环境产生一定的影响,请用物质的序号填空。
①二氧化碳 ②二氧化硫 ③氮氧化物NOx
(1)过量会导致温室效应加剧的主要物质是___________。
(2)会造成酸雨的物质是_____________。
(3)会导致光化学烟雾的物质是__________。
①
②③
③
2、氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对含有氮氧化物的废气进行处理。用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O ①
2NO2+2NaOH=NaNO2+NaNO3+H2O ②
在反应①中,氧化剂是______,还原剂是______。在反应②中,氧化剂是_______,还原剂是_______。
NO2
NO
NO2
NO2
课堂总结
常见氮肥及其使用
氮氧化物的无害化处理
1、能以含氮化合物之间的转化为例,分析和探讨化学工业对人类健康、社会可持续发展可能带来的影响,树立实事求是的科学态度;
2、能运用绿色化学的思想对化学品的生产和使用进行初步的评估,提出处理环境污染物的建议。
含氮化合物的生产和使用,也会给我们的生活和社会发展带来一些不利的影响。如过量和不当施用氮肥引起的土壤和水体污染,汽车发动机尾气中的氮氧化物导致空气污染等。合理使用含氮化合物必须首先了解其性质,以减少或消除有害环境的物质。
一、铵盐的性质
1、定义:
由铵根离子(NH4+)与酸根离子形成的离子化合物
NH4Cl
(NH4)2SO4
NH4HCO3
(NH4)2CO3
NH4NO3
颜色 溶解性 状态
2、铵盐物理性质
无色
易溶于水
晶体
性质类似
思考:从铵盐的组成分析为什么它们的物理性质相似?
仔细观察下列实验现象,并将有关反应的化学方程式填入表7-3中。
【实验1】取少量氯化铵和碳酸氢铵,分别放入两支试管中,在酒精灯火焰上微热,观察发生的现象。
3、铵盐化学性质
一、铵盐的性质
3、铵盐化学性质
实验现象:
实验结论:
实验现象:
实验结论:
固体逐渐减少,产生有刺激性气味气体,试管口有白色固体生成。
NH4Cl受热分解产生NH3
NH4Cl NH3↑+HCl↑
试管中固体逐渐减少,试纸变蓝
NH4HCO3分解产生NH3
NH4HCO3 NH3↑+CO2↑+H2O
一、铵盐的性质
硝酸铵受热分解
铵盐受热分解都产生氨气吗?
汽车安全气囊内就有NH NO ,受到剧烈的撞击后会放出大量的气体,从而保护司机免受二次伤害。NH NO 在有可燃物存在或撞击的条件下,会产生爆炸反应:2NH NO = 2N2 ↑+O ↑+4H O↑。
500℃
思考:怎样存放铵态氮肥?
密封包装并放在阴凉通风干燥处
一、铵盐的性质
【实验2】将少量氯化铵与少量氢氧化钙混合后放入试管中,在酒精灯火焰上微热,用湿润的红色石蕊试纸检验反应产生的气体。
3、铵盐化学性质
实验现象:
实验结论:
试管中有刺激性气味气体产生,试纸变蓝
NH4Cl和Ca(OH)2热反应生成NH3
Ca(OH)2+2NH4Cl CaCl2+2H2O+2NH3↑
一、铵盐的性质
已知铵盐与碱反应放出氨气的实质为:
NH4NO3 + NaOH =
Δ
NH4Cl + NaOH =
Δ
(NH4)2SO4 + NaOH =
Δ
完成下列反应方程式:
NH4+ + OH- = NH3↑ + H2O,
Δ
NaCl + NH3↑ + H2O
NaNO3 + NH3↑ + H2O
Na2SO4 + 2NH3↑ + 2H2O
实质:
二、铵盐化学性质
2、与碱反应
1、不稳定性
所有铵盐遇碱共热都可以生成氨气
铵盐受热分解
OH- NH3↑+H2O
应用:1、实验室用来制取NH3;
2、用于NH4+ 的检验
注意:NH4+与OH-离子在溶液中不能大量共存
NH4+ 的检验
变蓝
白烟
1、取少许样品与碱混合于试管中共热,将湿润的红色石蕊试纸靠近试管口,若试纸变蓝色,则证明样品中含有NH4+
2、取少许样品与碱混合于试管中共热,用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+
1、下列叙述中的实验操作所对应的结论正确的是( )
选项 实验操作 结论
A 向某无色溶液中滴加NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体 则该无色溶液中一定不含NH4+
B 某小组进行NH3催化氧化实验时,产生了红棕色气体 NH3催化氧化的产物为NO2
C 加热NH4Cl固体可分解产生NH3和HCl 该法可用于实验室制取NH3
D 通入SO2可使滴有酚酞的氨水褪色 氨水呈碱性
D
2、能鉴别Na2SO4、NH4NO3、KCl、(NH4)2SO4四种溶液(可以加热)的一种试剂是( )
A.BaCl2溶液 B.Ba(NO3)2溶液
C.Ba(OH)2溶液 D.AgNO3溶液
C
3、下列离子方程式书写正确的是( )
A.在实验室用氯化铵和熟石灰制氨:NH4++OH- NH3↑+H2O
B.NaOH溶液与NH4Cl溶液混合加热:NH4++OH- NH3·H2O
C.氨水中加盐酸:NH3·H2O+H+=NH4++H2O
D.氨水中加氯化铁溶液:Fe3++3OH-=Fe(OH)3↓
C
充足的氮能使植物枝叶茂盛,叶片增大,光合作用增强,促进氨基酸和蛋白质的形成,从而使农作物的产量和产品质量得以提高。
如果不施化肥,中国只能养活2亿多人口,剩下12亿人就没饭吃。
氮肥,是指以氮(N)为主要成分,施于土壤可提供植物氮素营养的肥料。氮肥是世界化肥生产和使用量最大的肥料品种;适宜的氮肥用量对于提高作物产量、改善农产品质量有重要作用。化学氮肥生产的主要原料是合成氨。20世纪四五十年代,硫酸铵是最主要的氮肥品种;60年代,增加了硝酸铵;70年代以来,尿素成为主导的氮肥品种。碳酸氢铵是中国80年代主要生产的氮肥品种之一。
(NH4)2SO4
NH4HCO3
尿素CO(NH2)2
NH4NO3
三、常见氮肥及其应用
1、分类
铵态氮肥
硝态氮肥
有机氮肥
氮肥
主要成分NH4+
主要成分NO3-
主要是尿素CO(NH2)2
课堂活动:请阅读教材第46、47页内容,归纳整理不同氮肥的使用注意事项。
2、氮肥的使用
(1)、铵态氮肥
结合NH4HCO3、NH4Cl使用说明,归纳铵态氮肥使用时要注意什么?
深施盖土,避免受热
低温保存,防止受潮
不可以跟碱性物质(如草木灰等)混合使用
三、常见氮肥及其应用
(2)硝态氮肥
优点:硝态氮肥包括硝酸钠、硝酸钙等,易溶于水。NO3-不易被以带负电荷为主的土壤胶粒所吸附,在潮湿的土壤中流动性大,容易被植物吸收。
缺点:在土壤湿度大的情况下,硝酸根经微生物作用可还原成气体(NO、N2O、N2)逸出,这种反硝化作用往往导致硝态氮肥的损失。
(1)为什么硝态氮肥不宜在高温天气、多雨的水田区施用,而多用于冷凉的旱地?
(2)为什么适应在pH较高的石灰性土壤中生长的植物优先使用硝态氮肥,而适应在酸性土境中生长的植物优先使用铵态氮肥?
性质决定用途,用途反应性质
三、常见氮肥及其应用
(3)有机氮肥——尿素
性质:尿素的分子式为CO(NH2)2,属于有机氮肥,是一种白色晶体,其中氮的质量分数约为46.7%,是目前固态氮肥中含氮量最高的一种化肥。
特点:中性肥料,适用于各种土壤和作物。肥效高、易保存、使用方便,长期使用对土壤的破坏作用小,所以它是目前使用量最大的一种氮肥。
三、常见氮肥及其应用
C
2、施用氮肥能促进作物生长,并能提高作物中蛋白质的含量。下列关于氮肥的说法错误的是( )
A.尿素CO(NH2)2是一种有机氮肥
B.储存碳酸氢铵时,应密封并置于阴凉通风处
C.铵态氮肥不能与碱性物质如草木灰等混合施用
D.氮肥溶于水,其中的氮元素均以铵根离子形式存在
D
3、化学肥料对环境的影响
对环境的影响:长期使用化肥的土壤,容易酸化、板结。雨水冲刷使肥料离开土壤,进入溪水、河水和湖泊。水中的肥料会使细菌和藻类迅速生长,并消耗水中的氧气,严重时导致水中含氧量减少,许多水生生物随之死亡、腐烂,水质下降。
含有大量的氮、磷的污水排向湖泊,和海域,造成了水体富营养化,出现藻类物质大量繁殖形成赤潮,水华等严重污染问题。
三、常见氮肥及其应用
三、常见氮肥及其应用
2、氮氧化物的来源
(1)化石燃料的燃烧
(2)硝酸生产等排放的废气
(3)机动车辆排放的尾气
四、氮氧化物的无害化处理
1、氮氧化物(NOx):主要包括一氧化氮(NO)、二氧化氮(NO2)
3、光化学烟雾:二氧化氮在日光照射下还能使氧气经过复杂的反应生成臭氧(O3)。臭氧与空气中的氮氧化物和一些碳氢化合物在紫外线的照射下发生作用后,产生了一种有毒的烟雾。光化学烟雾具有特殊气味,刺激眼睛,对人体健康、植物生长等都有很大的危害。
酸雨:3NO2+H2O=2HNO3+NO
四、氮氧化物的无害化处理
4、减少汽车尾气危害的措施
(1)以甲醇、液化气代替汽油;
(2)安装汽车尾气净化装置,将NOx转化为中性的、无污染的氮气;
(3)使用以液化天然气(LNG)或高效燃料电池作为动力的新型环保汽车。
四、氮氧化物的无害化处理
碱液吸收法:
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
实验室尾气处理方法
1、大气中下列气体含量的升高会对环境产生一定的影响,请用物质的序号填空。
①二氧化碳 ②二氧化硫 ③氮氧化物NOx
(1)过量会导致温室效应加剧的主要物质是___________。
(2)会造成酸雨的物质是_____________。
(3)会导致光化学烟雾的物质是__________。
①
②③
③
2、氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对含有氮氧化物的废气进行处理。用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O ①
2NO2+2NaOH=NaNO2+NaNO3+H2O ②
在反应①中,氧化剂是______,还原剂是______。在反应②中,氧化剂是_______,还原剂是_______。
NO2
NO
NO2
NO2
课堂总结
