8.2 课时1 乙醇(25页) 课件 2024-2025学年高一化学苏教版(2019)必修2
文档属性
| 名称 | 8.2 课时1 乙醇(25页) 课件 2024-2025学年高一化学苏教版(2019)必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 33.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-01 18:38:40 | ||
图片预览





文档简介
(共25张PPT)
乙 醇
1.能识别乙醇结构中起关键作用的原子或原子团,并将其与整体进行联系,揭示醇类物质的有关性质。
2.认识乙醇对人类生活和生命活动的重要意义。
酒是人类生活中的主要饮料之一。中国制酒历史源远流长,品种繁多。约在三千多年前,商周时代,中国人独创酒曲复式发酵法,开始大量酿制黄酒。酒渗透于整个中华五千年的文明史中,从文学艺术创作、文化娱乐到饮食烹饪、养生保健、现代工农业生产、科技、医疗等各方面都起到了重要的作用。
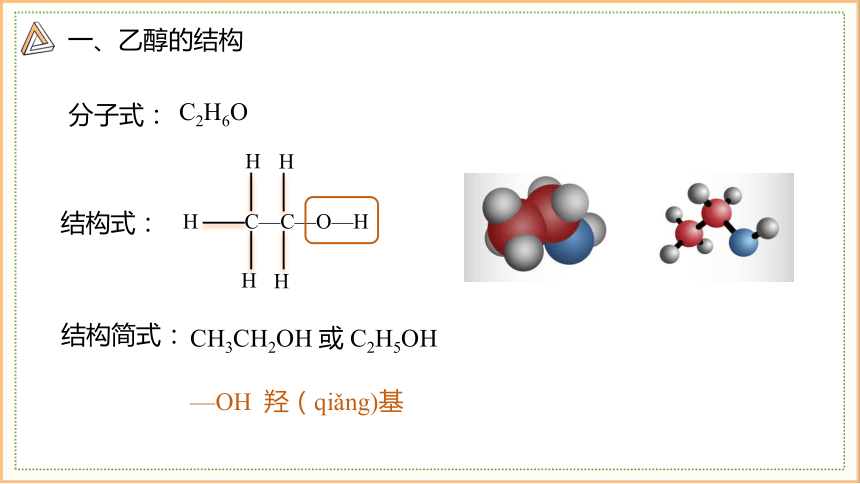
一、乙醇的结构
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH 或 C2H5OH
分子式:
C2H6O
结构简式:
—OH 羟(qiǎng)基
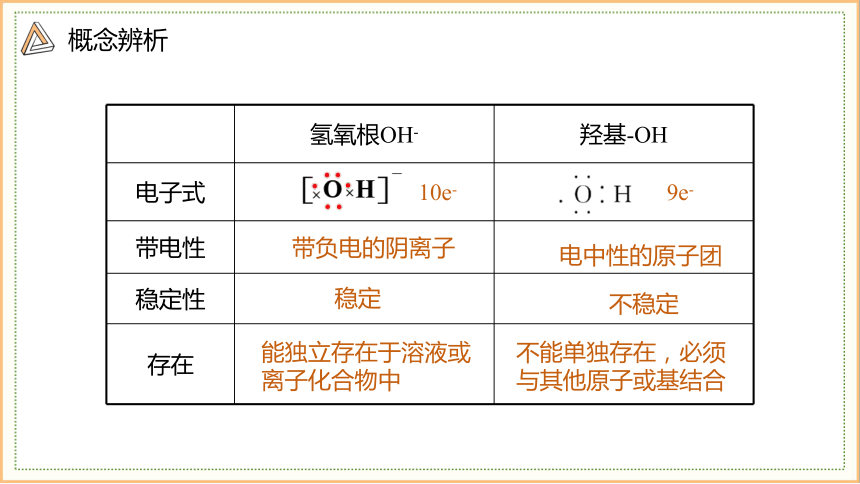
概念辨析
氢氧根OH- 羟基-OH
电子式
带电性
稳定性
存在
带负电的阴离子
电中性的原子团
稳定
不稳定
能独立存在于溶液或离子化合物中
不能单独存在,必须与其他原子或基结合
10e-
9e-
二、乙醇的物理性质
颜色 状态 气味 水溶性 密度 挥发性
无色
液体
特殊香味
任意比互溶
密度比水小
易挥发
制浓度不等酒类饮料
酒的度数:
乙醇的体积分数
含酒精99.5%以上
结合日常生活中有关酒精的认识,归纳总结乙醇的物理性质。
下列有关乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分
C.乙醇能够与水以任意比例互溶
D.由于乙醇容易挥发,所以才有俗语“酒香不怕巷子深”的说法
A
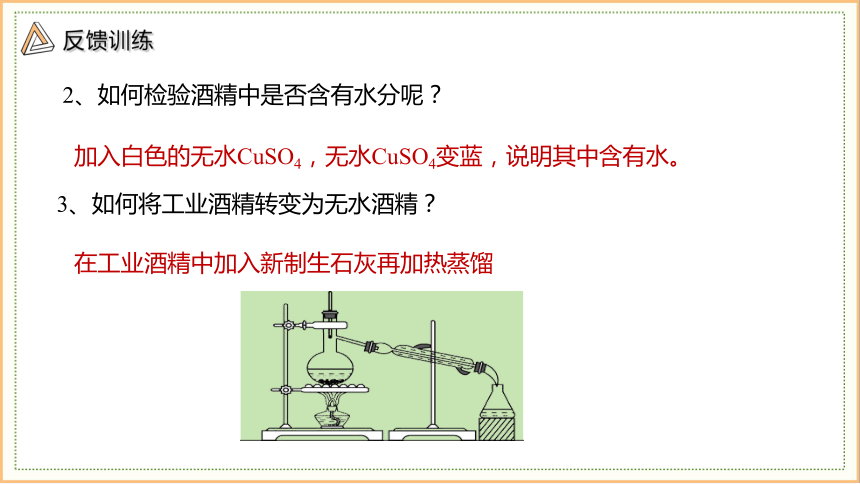
2、如何检验酒精中是否含有水分呢?
3、如何将工业酒精转变为无水酒精?
在工业酒精中加入新制生石灰再加热蒸馏
加入白色的无水CuSO4,无水CuSO4变蓝,说明其中含有水。
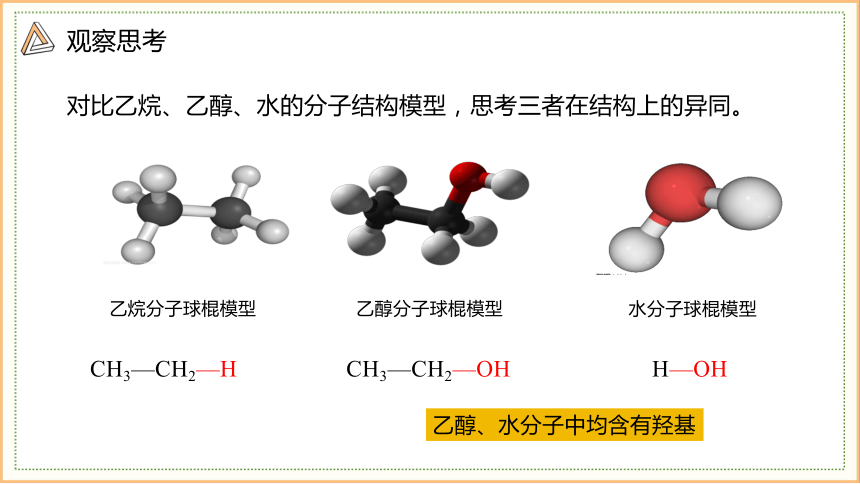
观察思考
对比乙烷、乙醇、水的分子结构模型,思考三者在结构上的异同。
乙烷分子球棍模型
乙醇分子球棍模型
水分子球棍模型
CH3—CH2—H
CH3—CH2—OH
H—OH
乙醇、水分子中均含有羟基
【实验1】取一小块钠,用滤纸吸干钠表面的煤油(多种烃的混合物),并用小刀切去钠的表层,然后投入到盛有1~2 mL无水乙醇的试管中,观察实验现象。
实验1中金属钠与煤油、无水乙醇是否发生反应?从实验中你能得到什么启示?
实验现象:
钠沉在液面下,大量气泡产生
三、乙醇的化学性质
1、与金属钠反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇钠
置换反应
煤油是多种烃的混合物,烷烃分子中与碳原子相连的氢不能被金属钠置换。
观察思考:取适量钠分别投入盛有水和无水乙醇的试管中,观察对比现象,并解释原因。
2H-O-H + 2Na = 2NaOH + H2↑
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇分子中羟基(—OH)上的氢原子能被金属钠置换生成氢气,但反应比钠与水要缓慢得多。
思考
2 -OH~2Na~ H2
1、醇中羟基与足量的钠反应,羟基和生成的H2之间有怎样的定量关系?
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
2、已知1mol某醇与足量的金属钠反应生成2mol H2,则该醇分子中含有____个羟基;
已知1mol某醇能与2 mol 金属钠反应,则该醇分子中含有____个羟基;
4
2
3、已知分子中含有羟基的物质都能与钠反应产生氢气。乙醇、乙二醇( )、
丙三醇( )分别与足量金属钠作用,产生氢气在相同条件下体积之比为6∶2∶3。则这三种醇的物质的量之比( )
A.6∶3∶2 B.1∶2∶3 C.3∶2∶1 D.6∶1∶1
D
【实验2】向一支洁净的小试管中加入3~4 mL无水乙醇,将该试管浸入50℃左右的热水中。另取一根一端已经卷曲好的铜丝,将铜丝在酒精灯上烧至红热状态,迅速插入乙醇中,反复多次,观察铜丝颜色的变化,并感受整个实验过程中乙醇气味的变化。
三、乙醇的化学性质
在进行实验2的过程中,铜丝的颜色先后发生什么变化?乙醇在实验中是被氧化还是被还原?综合整个反应过程, 说明铜丝所起的作用。
CuO
黑色
Cu
红色
O2
加热
乙醇
Cu
红色
铜做催化剂
或CH3CHO
乙醛 有特殊气味
醛基
Cu或Ag
加热
O2
Cu
CuO
CH3CH2OH
CH3CHO+H2O
乙醛
2Cu+O2 CuO
CH3CH2OH+ CuO CH3CHO+Cu+H2O
铜做催化剂
氧化铜做中间产物
催化剂
中间产物
三、乙醇的化学性质
思考
根据乙醇催化氧化的化学键的断裂和生成的特点实质,推测 下列物质催化氧化产物分别是什么?
CH3—CH—CH2OH、
∣
CH3
不是所有的醇都能够催化氧化,-OH所连接的碳上没有H,不能氧化;能催化氧化的其产物也不一定都为醛。
乙醇
乙醛
乙酸
乙醇脱氢酶
CO2+H2O
乙醛脱氢酶
(ALDH)
人喝酒后会产生恶心欲吐、昏迷不适等症状。你知道酒精中毒的罪魁祸首是什么吗?
乙醛的毒性是乙醇的10倍。高浓度乙醛有麻醉作用,使体内某些反应停止,部分组织坏死。从而令人头晕头痛、嗜睡昏迷。 伤及肝脏、心脑血管及脑神经系统。
酒变酸(醋) 与空气中存在的醋酸菌大有关系,在酒跟空气接触中,醋酸菌进入酒中并大量繁殖, 在醋酸菌作用下,乙醇跟氧气起反应,先生成乙醛后变为乙酸。
酿酒成
乙醛有较强的还原性。在适当条件下,乙醛可以进一步被氧气氧化生成乙酸。
2CH3CHO+O2 2CH3COOH
催化剂
三、乙醇的化学性质
乙醇的燃烧
现象:发出淡蓝色火焰,并放出大量热
三、乙醇的化学性质
四、乙醇的用途
1、作杀菌、消毒剂 — 医用酒精等
2、作燃料 — 火锅、乙醇汽油等
3、制浓度不等酒类饮料
化学特性
官能团
(1)定义:决定有机化合物 的原子或原子团。
物质 CH3CH2OH CH3COOH CH3CHO CH2=CH2 CH≡CH
所含官能团 —OH —COOH —CHO —C≡C—
官能团的名称 羟基 羧基 醛基 碳碳双键 碳碳三键
1、下列说法正确的是( )
A.乙醇在水中能电离出少量的H+,所以乙醇是电解质
B.乙醇与O2发生不完全燃烧生成乙醛
C.乙醇分子中所有的氢原子都可被钠置换出来
D.乙醇是一种很好的溶剂,能溶解多种物质
D
2、乙醇分子中的各种化学键如下图所示,关于乙醇在各种反应中断键情况的说法不正确的是( )
A.和金属钠反应时①键断裂
B.在铜催化共热下与O2反应时断裂①和③键
C.在铜催化共热下与O2反应时断裂①和⑤键
D.在空气中完全燃烧时断裂①②③④⑤键
C
下列关于该有机物的叙述中,不正确的是( )
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与H2发生加成反应
C.不能使酸性KMnO4溶液褪色
D.在铜作催化剂条件下能发生催化氧化反应生成醛
3、某有机物的结构简式为:
C
乙醇的结构
性质
2CH3CH2OH + 2Na→2CH3CH2ONa + H2↑
用途
乙 醇
1.能识别乙醇结构中起关键作用的原子或原子团,并将其与整体进行联系,揭示醇类物质的有关性质。
2.认识乙醇对人类生活和生命活动的重要意义。
酒是人类生活中的主要饮料之一。中国制酒历史源远流长,品种繁多。约在三千多年前,商周时代,中国人独创酒曲复式发酵法,开始大量酿制黄酒。酒渗透于整个中华五千年的文明史中,从文学艺术创作、文化娱乐到饮食烹饪、养生保健、现代工农业生产、科技、医疗等各方面都起到了重要的作用。
一、乙醇的结构
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH 或 C2H5OH
分子式:
C2H6O
结构简式:
—OH 羟(qiǎng)基
概念辨析
氢氧根OH- 羟基-OH
电子式
带电性
稳定性
存在
带负电的阴离子
电中性的原子团
稳定
不稳定
能独立存在于溶液或离子化合物中
不能单独存在,必须与其他原子或基结合
10e-
9e-
二、乙醇的物理性质
颜色 状态 气味 水溶性 密度 挥发性
无色
液体
特殊香味
任意比互溶
密度比水小
易挥发
制浓度不等酒类饮料
酒的度数:
乙醇的体积分数
含酒精99.5%以上
结合日常生活中有关酒精的认识,归纳总结乙醇的物理性质。
下列有关乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分
C.乙醇能够与水以任意比例互溶
D.由于乙醇容易挥发,所以才有俗语“酒香不怕巷子深”的说法
A
2、如何检验酒精中是否含有水分呢?
3、如何将工业酒精转变为无水酒精?
在工业酒精中加入新制生石灰再加热蒸馏
加入白色的无水CuSO4,无水CuSO4变蓝,说明其中含有水。
观察思考
对比乙烷、乙醇、水的分子结构模型,思考三者在结构上的异同。
乙烷分子球棍模型
乙醇分子球棍模型
水分子球棍模型
CH3—CH2—H
CH3—CH2—OH
H—OH
乙醇、水分子中均含有羟基
【实验1】取一小块钠,用滤纸吸干钠表面的煤油(多种烃的混合物),并用小刀切去钠的表层,然后投入到盛有1~2 mL无水乙醇的试管中,观察实验现象。
实验1中金属钠与煤油、无水乙醇是否发生反应?从实验中你能得到什么启示?
实验现象:
钠沉在液面下,大量气泡产生
三、乙醇的化学性质
1、与金属钠反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇钠
置换反应
煤油是多种烃的混合物,烷烃分子中与碳原子相连的氢不能被金属钠置换。
观察思考:取适量钠分别投入盛有水和无水乙醇的试管中,观察对比现象,并解释原因。
2H-O-H + 2Na = 2NaOH + H2↑
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
乙醇分子中羟基(—OH)上的氢原子能被金属钠置换生成氢气,但反应比钠与水要缓慢得多。
思考
2 -OH~2Na~ H2
1、醇中羟基与足量的钠反应,羟基和生成的H2之间有怎样的定量关系?
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
2、已知1mol某醇与足量的金属钠反应生成2mol H2,则该醇分子中含有____个羟基;
已知1mol某醇能与2 mol 金属钠反应,则该醇分子中含有____个羟基;
4
2
3、已知分子中含有羟基的物质都能与钠反应产生氢气。乙醇、乙二醇( )、
丙三醇( )分别与足量金属钠作用,产生氢气在相同条件下体积之比为6∶2∶3。则这三种醇的物质的量之比( )
A.6∶3∶2 B.1∶2∶3 C.3∶2∶1 D.6∶1∶1
D
【实验2】向一支洁净的小试管中加入3~4 mL无水乙醇,将该试管浸入50℃左右的热水中。另取一根一端已经卷曲好的铜丝,将铜丝在酒精灯上烧至红热状态,迅速插入乙醇中,反复多次,观察铜丝颜色的变化,并感受整个实验过程中乙醇气味的变化。
三、乙醇的化学性质
在进行实验2的过程中,铜丝的颜色先后发生什么变化?乙醇在实验中是被氧化还是被还原?综合整个反应过程, 说明铜丝所起的作用。
CuO
黑色
Cu
红色
O2
加热
乙醇
Cu
红色
铜做催化剂
或CH3CHO
乙醛 有特殊气味
醛基
Cu或Ag
加热
O2
Cu
CuO
CH3CH2OH
CH3CHO+H2O
乙醛
2Cu+O2 CuO
CH3CH2OH+ CuO CH3CHO+Cu+H2O
铜做催化剂
氧化铜做中间产物
催化剂
中间产物
三、乙醇的化学性质
思考
根据乙醇催化氧化的化学键的断裂和生成的特点实质,推测 下列物质催化氧化产物分别是什么?
CH3—CH—CH2OH、
∣
CH3
不是所有的醇都能够催化氧化,-OH所连接的碳上没有H,不能氧化;能催化氧化的其产物也不一定都为醛。
乙醇
乙醛
乙酸
乙醇脱氢酶
CO2+H2O
乙醛脱氢酶
(ALDH)
人喝酒后会产生恶心欲吐、昏迷不适等症状。你知道酒精中毒的罪魁祸首是什么吗?
乙醛的毒性是乙醇的10倍。高浓度乙醛有麻醉作用,使体内某些反应停止,部分组织坏死。从而令人头晕头痛、嗜睡昏迷。 伤及肝脏、心脑血管及脑神经系统。
酒变酸(醋) 与空气中存在的醋酸菌大有关系,在酒跟空气接触中,醋酸菌进入酒中并大量繁殖, 在醋酸菌作用下,乙醇跟氧气起反应,先生成乙醛后变为乙酸。
酿酒成
乙醛有较强的还原性。在适当条件下,乙醛可以进一步被氧气氧化生成乙酸。
2CH3CHO+O2 2CH3COOH
催化剂
三、乙醇的化学性质
乙醇的燃烧
现象:发出淡蓝色火焰,并放出大量热
三、乙醇的化学性质
四、乙醇的用途
1、作杀菌、消毒剂 — 医用酒精等
2、作燃料 — 火锅、乙醇汽油等
3、制浓度不等酒类饮料
化学特性
官能团
(1)定义:决定有机化合物 的原子或原子团。
物质 CH3CH2OH CH3COOH CH3CHO CH2=CH2 CH≡CH
所含官能团 —OH —COOH —CHO —C≡C—
官能团的名称 羟基 羧基 醛基 碳碳双键 碳碳三键
1、下列说法正确的是( )
A.乙醇在水中能电离出少量的H+,所以乙醇是电解质
B.乙醇与O2发生不完全燃烧生成乙醛
C.乙醇分子中所有的氢原子都可被钠置换出来
D.乙醇是一种很好的溶剂,能溶解多种物质
D
2、乙醇分子中的各种化学键如下图所示,关于乙醇在各种反应中断键情况的说法不正确的是( )
A.和金属钠反应时①键断裂
B.在铜催化共热下与O2反应时断裂①和③键
C.在铜催化共热下与O2反应时断裂①和⑤键
D.在空气中完全燃烧时断裂①②③④⑤键
C
下列关于该有机物的叙述中,不正确的是( )
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与H2发生加成反应
C.不能使酸性KMnO4溶液褪色
D.在铜作催化剂条件下能发生催化氧化反应生成醛
3、某有机物的结构简式为:
C
乙醇的结构
性质
2CH3CH2OH + 2Na→2CH3CH2ONa + H2↑
用途
