专题九 金属与人类文明(26页) 课件 2024-2025学年高一化学苏教版(2019)必修2
文档属性
| 名称 | 专题九 金属与人类文明(26页) 课件 2024-2025学年高一化学苏教版(2019)必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 983.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-01 18:42:10 | ||
图片预览








文档简介
(共26张PPT)
章末复习
一、金属的冶炼方法
金属的冶炼:
利用化学反应使金属元素从化合态变为游离态的过程。
实质:
金属离子 金属单质,即Mn++ne-M。
步骤:矿物的采集、富集、除杂→冶炼→精炼。
3.冶炼方法
热分
解法
如:Hg Ag
适用于金属活动性顺序表中氢以后的金属冶炼。
2Ag2O 4Ag+O2↑
2HgO 2Hg+O2↑。
一、金属的冶炼方法
一、金属的冶炼方法
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
高温
还原法
如:Zn Fe Sn Pb Cu
用还原剂(CO、C、H2和活泼金属等)还原金属氧化物,适合冶炼金属活动性顺序表中锌到铜之间的大多数金属。
Fe2O3+3CO====2Fe+3CO2
高温
Fe2O3+2Al === 2Fe+Al2O3
高温
高炉炼铁
铝热法炼铁
一、金属的冶炼方法
①还原剂的生成:C+O2 CO2,C+CO2 2CO;
②铁矿石的还原:Fe2O3+3CO 2Fe+3CO2;
③炉渣的形成:a.CaCO3 CaO+CO2↑,b.CaO+SiO2 CaSiO3。
高炉炼铁反应原理:用还原剂将铁从其化合物中还原出来。
主要反应的化学方程式:
一、金属的冶炼方法
铝热法炼铁
实验现象
①镁条剧烈燃烧;
②氧化铁粉末和铝粉发生剧烈的反应;
③反应放出大量的热,并发出耀眼的白光;
④纸漏斗的下部被烧穿,有熔融物落入沙中
Fe2O3+2Al === 2Fe+Al2O3
一、金属的冶炼方法
铝热法炼铁
①冶炼熔点较高、活动性弱于Al的金属,如钒、铬、锰等。
②金属焊接,如焊接钢轨等
应用
(1)在高温条件下进行。
(2)反应迅速并放出大量的热。
(3)新生成的金属单质呈熔融态且易与Al2O3分离。
特点
一、金属的冶炼方法
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
电解法
如:K Ca Na Mg Al
适合冶炼金属活动性较强的金属(一般为金属活动性顺序表中铝及铝前面的金属)。
MgCl2 (熔融) Mg+Cl2↑,2NaCl (熔融) 2Na+Cl2↑,
2Al2O3 === 4Al + 3O2↑
通电
冰晶石
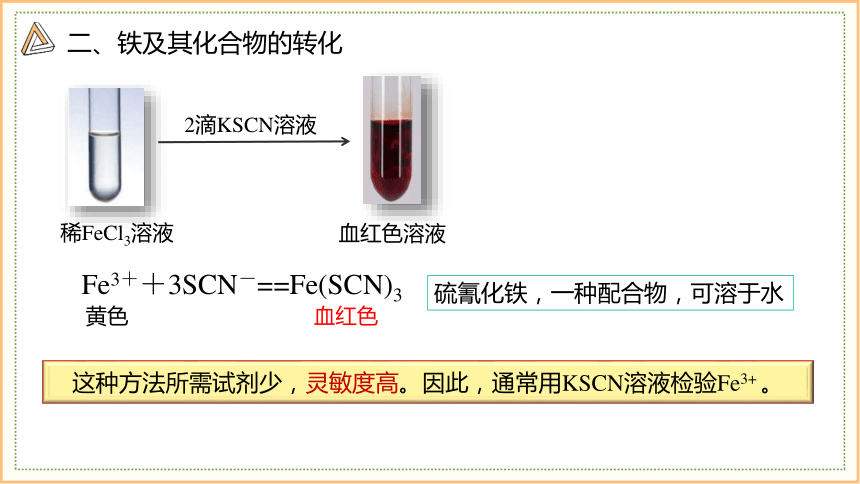
二、铁及其化合物的转化
2滴KSCN溶液
稀FeCl3溶液
血红色溶液
这种方法所需试剂少,灵敏度高。因此,通常用KSCN溶液检验Fe3+ 。
Fe3++3SCN-==Fe(SCN)3
黄色
血红色
硫氰化铁,一种配合物,可溶于水
二、铁及其化合物的转化
无明显现象
滴加2滴
KSCN溶液
Fe2+与KSCN溶液不反应
FeCl2溶液
滴加几滴氯水
溶液呈红色
上述方法可用于检验溶液中Fe2+的存在,但要注意试剂的滴加顺序。
Fe2+ 的检验
2Fe2++Cl22Fe3++2Cl-
Fe3++3SCN-==Fe(SCN)3
二、铁及其化合物的转化
具有氧化性
既有氧化性
又有还原性
Fe2+、Fe3+的相互转化
Fe2+
Fe3+
氧化剂
还原剂
强氧化剂:Cl2、Br2、HNO3、HClO等
双氧水:2Fe2++H2O2+2H+===2Fe3++2H2O
新制氯水或氯气:2Fe2++Cl2 === 2Fe3++2Cl-
氧化剂还可以是:O2、 HNO3等
二、铁及其化合物的转化
具有氧化性
既有氧化性
又有还原性
Fe2+、Fe3+的相互转化
Fe2+
Fe3+
氧化剂
还原剂
还原剂:Cu、Fe、S2-、I-、SO2等
2Fe3++Fe === 3Fe2+
2Fe3++Cu === 2Fe2++Cu2+
2Fe3++2I- === 2Fe2++I2
“铁三角”的转化关系
三、反应的合理选择
以铁屑为原料制取FeCl 3的可能反应途径
Fe
FeO
Fe2O3
Fe(OH)3
Fe(OH)2
FeCl3
FeCl2
1.Fe→FeCl3
3.Fe→Fe2O3→ FeCl3
2.Fe→ FeCl2→FeCl3
+3
+2
氢氧化物
盐
氧化物
单质
0
类别
化合价
Fe
FeCl3
在氯气中点燃
路径一
从反应炉中排出并经冷凝得到固体FeCl3
2Fe+3Cl2=== 2FeCl3
点燃
Fe
FeCl3
盐酸溶解铁
路径二
FeCl2
Fe+2HCl== FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
氯气氧化后分离提纯
Fe
FeCl3
缓慢氧化
路径三
Fe2O3
盐酸溶解后分离提纯
4Fe+3O2==2Fe2O3
Fe2O3 +6HCl ==2FeCl3+3H2O
三、反应的合理选择
四、探究铁的氢氧化物的制备
实验
现象
有灰绿色和红褐色沉淀生成,最终沉淀全部变成红褐色。
先有白色沉淀生成,在空气中迅速变成灰绿色,最后变成红褐色。
四、探究铁的氢氧化物的制备
Fe2++2OH===Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O===4Fe(OH)3(红褐色)
1、生成白色沉淀
2、白色沉淀在空气中迅速变成灰绿色,最后变成红褐色。
思考:制备Fe(OH)2需注意什么?
隔绝氧气
四、探究铁的氢氧化物的制备
制备氢氧化亚铁的改进装置
五、铁的氢氧化物的性质
Fe(OH)2 Fe(OH)3
颜色 白色 固体 红褐色 固体
溶解性 难溶于水 难溶于水
稳定性 在空气中不稳定,易被氧化: 4Fe(OH)2+O2+2H2O = 4Fe(OH)3 不稳定,受热易分解: 2Fe(OH)3 Fe2O3+3H2O
五、铁的氢氧化物的性质
六、金属材料
1、金属的物理性质
性质 表现
状态
颜色
延展性
导电、导热性
常温下,除汞是液态外,其余都是固态
不透明,有金属光泽,大多数是银白色,个别为其他颜色(如Au呈金黄色,Cu呈红色)
大多数较好,且延性与展性常一致,但不全一致,如Au的展性最好,Pt的延性最好
易导电、导热,导电性:Ag>Cu>Au>Al>Fe
六、金属材料
硬度一般高于它的成分金属
熔点一般低于它的成分金属
合金相比纯金属材料具有优良的物理、化学或机械性能
2、合金性能
导电性和导热性一般低于它的成分金属
六、金属材料
3、常见的合金及其应用
(1)焊锡是锡和铅的合金
(2)
六、金属材料
3、常见的合金及其应用
(3)其他常见合金
名称 主要特性 主要用途
铝合金 成本低,性能优异,密度小、强度大、塑性好。优良的导电性、导热性,抗腐蚀能力,装饰效果好 用于航空、航天、汽车、机械制造、船舶及化学工业中
六、金属材料
3、常见的合金及其应用
名称 主要特性 主要用途
硬铝 强度和硬度都比纯铝大,密度小 用于飞机部件和门窗等受力构件的制造
钛合金 强度高,密度小,耐热性好,易于加工,抗腐蚀性强 用于飞机、火箭、导弹、人造卫星、宇宙飞船、汽车、核潜艇、深潜器、破冰船、扫雷艇等尖端领域,作人体的植入物,制造网球拍、轮椅、眼镜架等
七、无机非金属材料
①硅的导电性介于导体和绝缘体之间,是一种重要的半导体材料。
②光导纤维的主要成分是二氧化硅,光导纤维导光能力非常强。
③新型陶瓷:结构陶瓷(如高温结构陶瓷)和功能陶瓷(如压电陶瓷)。
(1)传统无机非金属材料:水泥、玻璃、陶瓷。
(2)新型无机非金属材料
章末复习
一、金属的冶炼方法
金属的冶炼:
利用化学反应使金属元素从化合态变为游离态的过程。
实质:
金属离子 金属单质,即Mn++ne-M。
步骤:矿物的采集、富集、除杂→冶炼→精炼。
3.冶炼方法
热分
解法
如:Hg Ag
适用于金属活动性顺序表中氢以后的金属冶炼。
2Ag2O 4Ag+O2↑
2HgO 2Hg+O2↑。
一、金属的冶炼方法
一、金属的冶炼方法
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
高温
还原法
如:Zn Fe Sn Pb Cu
用还原剂(CO、C、H2和活泼金属等)还原金属氧化物,适合冶炼金属活动性顺序表中锌到铜之间的大多数金属。
Fe2O3+3CO====2Fe+3CO2
高温
Fe2O3+2Al === 2Fe+Al2O3
高温
高炉炼铁
铝热法炼铁
一、金属的冶炼方法
①还原剂的生成:C+O2 CO2,C+CO2 2CO;
②铁矿石的还原:Fe2O3+3CO 2Fe+3CO2;
③炉渣的形成:a.CaCO3 CaO+CO2↑,b.CaO+SiO2 CaSiO3。
高炉炼铁反应原理:用还原剂将铁从其化合物中还原出来。
主要反应的化学方程式:
一、金属的冶炼方法
铝热法炼铁
实验现象
①镁条剧烈燃烧;
②氧化铁粉末和铝粉发生剧烈的反应;
③反应放出大量的热,并发出耀眼的白光;
④纸漏斗的下部被烧穿,有熔融物落入沙中
Fe2O3+2Al === 2Fe+Al2O3
一、金属的冶炼方法
铝热法炼铁
①冶炼熔点较高、活动性弱于Al的金属,如钒、铬、锰等。
②金属焊接,如焊接钢轨等
应用
(1)在高温条件下进行。
(2)反应迅速并放出大量的热。
(3)新生成的金属单质呈熔融态且易与Al2O3分离。
特点
一、金属的冶炼方法
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
电解法
如:K Ca Na Mg Al
适合冶炼金属活动性较强的金属(一般为金属活动性顺序表中铝及铝前面的金属)。
MgCl2 (熔融) Mg+Cl2↑,2NaCl (熔融) 2Na+Cl2↑,
2Al2O3 === 4Al + 3O2↑
通电
冰晶石
二、铁及其化合物的转化
2滴KSCN溶液
稀FeCl3溶液
血红色溶液
这种方法所需试剂少,灵敏度高。因此,通常用KSCN溶液检验Fe3+ 。
Fe3++3SCN-==Fe(SCN)3
黄色
血红色
硫氰化铁,一种配合物,可溶于水
二、铁及其化合物的转化
无明显现象
滴加2滴
KSCN溶液
Fe2+与KSCN溶液不反应
FeCl2溶液
滴加几滴氯水
溶液呈红色
上述方法可用于检验溶液中Fe2+的存在,但要注意试剂的滴加顺序。
Fe2+ 的检验
2Fe2++Cl22Fe3++2Cl-
Fe3++3SCN-==Fe(SCN)3
二、铁及其化合物的转化
具有氧化性
既有氧化性
又有还原性
Fe2+、Fe3+的相互转化
Fe2+
Fe3+
氧化剂
还原剂
强氧化剂:Cl2、Br2、HNO3、HClO等
双氧水:2Fe2++H2O2+2H+===2Fe3++2H2O
新制氯水或氯气:2Fe2++Cl2 === 2Fe3++2Cl-
氧化剂还可以是:O2、 HNO3等
二、铁及其化合物的转化
具有氧化性
既有氧化性
又有还原性
Fe2+、Fe3+的相互转化
Fe2+
Fe3+
氧化剂
还原剂
还原剂:Cu、Fe、S2-、I-、SO2等
2Fe3++Fe === 3Fe2+
2Fe3++Cu === 2Fe2++Cu2+
2Fe3++2I- === 2Fe2++I2
“铁三角”的转化关系
三、反应的合理选择
以铁屑为原料制取FeCl 3的可能反应途径
Fe
FeO
Fe2O3
Fe(OH)3
Fe(OH)2
FeCl3
FeCl2
1.Fe→FeCl3
3.Fe→Fe2O3→ FeCl3
2.Fe→ FeCl2→FeCl3
+3
+2
氢氧化物
盐
氧化物
单质
0
类别
化合价
Fe
FeCl3
在氯气中点燃
路径一
从反应炉中排出并经冷凝得到固体FeCl3
2Fe+3Cl2=== 2FeCl3
点燃
Fe
FeCl3
盐酸溶解铁
路径二
FeCl2
Fe+2HCl== FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
氯气氧化后分离提纯
Fe
FeCl3
缓慢氧化
路径三
Fe2O3
盐酸溶解后分离提纯
4Fe+3O2==2Fe2O3
Fe2O3 +6HCl ==2FeCl3+3H2O
三、反应的合理选择
四、探究铁的氢氧化物的制备
实验
现象
有灰绿色和红褐色沉淀生成,最终沉淀全部变成红褐色。
先有白色沉淀生成,在空气中迅速变成灰绿色,最后变成红褐色。
四、探究铁的氢氧化物的制备
Fe2++2OH===Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O===4Fe(OH)3(红褐色)
1、生成白色沉淀
2、白色沉淀在空气中迅速变成灰绿色,最后变成红褐色。
思考:制备Fe(OH)2需注意什么?
隔绝氧气
四、探究铁的氢氧化物的制备
制备氢氧化亚铁的改进装置
五、铁的氢氧化物的性质
Fe(OH)2 Fe(OH)3
颜色 白色 固体 红褐色 固体
溶解性 难溶于水 难溶于水
稳定性 在空气中不稳定,易被氧化: 4Fe(OH)2+O2+2H2O = 4Fe(OH)3 不稳定,受热易分解: 2Fe(OH)3 Fe2O3+3H2O
五、铁的氢氧化物的性质
六、金属材料
1、金属的物理性质
性质 表现
状态
颜色
延展性
导电、导热性
常温下,除汞是液态外,其余都是固态
不透明,有金属光泽,大多数是银白色,个别为其他颜色(如Au呈金黄色,Cu呈红色)
大多数较好,且延性与展性常一致,但不全一致,如Au的展性最好,Pt的延性最好
易导电、导热,导电性:Ag>Cu>Au>Al>Fe
六、金属材料
硬度一般高于它的成分金属
熔点一般低于它的成分金属
合金相比纯金属材料具有优良的物理、化学或机械性能
2、合金性能
导电性和导热性一般低于它的成分金属
六、金属材料
3、常见的合金及其应用
(1)焊锡是锡和铅的合金
(2)
六、金属材料
3、常见的合金及其应用
(3)其他常见合金
名称 主要特性 主要用途
铝合金 成本低,性能优异,密度小、强度大、塑性好。优良的导电性、导热性,抗腐蚀能力,装饰效果好 用于航空、航天、汽车、机械制造、船舶及化学工业中
六、金属材料
3、常见的合金及其应用
名称 主要特性 主要用途
硬铝 强度和硬度都比纯铝大,密度小 用于飞机部件和门窗等受力构件的制造
钛合金 强度高,密度小,耐热性好,易于加工,抗腐蚀性强 用于飞机、火箭、导弹、人造卫星、宇宙飞船、汽车、核潜艇、深潜器、破冰船、扫雷艇等尖端领域,作人体的植入物,制造网球拍、轮椅、眼镜架等
七、无机非金属材料
①硅的导电性介于导体和绝缘体之间,是一种重要的半导体材料。
②光导纤维的主要成分是二氧化硅,光导纤维导光能力非常强。
③新型陶瓷:结构陶瓷(如高温结构陶瓷)和功能陶瓷(如压电陶瓷)。
(1)传统无机非金属材料:水泥、玻璃、陶瓷。
(2)新型无机非金属材料
