专题七 氮与社会可持续发展(21页) 课件 2024-2025学年高一化学苏教版(2019)必修2
文档属性
| 名称 | 专题七 氮与社会可持续发展(21页) 课件 2024-2025学年高一化学苏教版(2019)必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-01 18:43:12 | ||
图片预览





文档简介
(共21张PPT)
章末复习
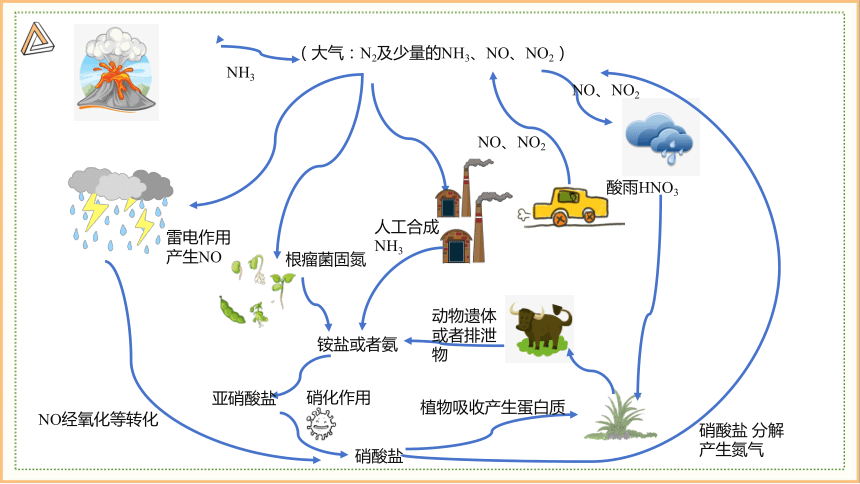
(大气:N2及少量的NH3、NO、NO2)
雷电作用
产生NO
NH3
根瘤菌固氮
人工合成NH3
酸雨HNO3
动物遗体或者排泄物
铵盐或者氨
硝酸盐
NO经氧化等转化
亚硝酸盐
植物吸收产生蛋白质
硝酸盐 分解产生氮气
硝化作用
NO、NO2
NO、NO2
一、氮的固定
概念:将大气中 的氮转化为 的过程
游离态
氮的化合物
氮的固定
分类
自然固氮
高能固氮(雷雨或者火山喷发)
生物固氮(如豆科植物的根瘤菌固氮)
人工固氮
合成氨(工业上合成氨)
仿生固氮(某些金属有机化合物可起到根瘤菌作用)
二、一氧化氮和二氧化氮
NO NO2
氧化物类别
转化 无色无味气体
红棕色有刺激性气味的气体
不溶于水
易溶于水
排水法
向上排空气法
色、味、态
溶解性
收集方法
2NO+O2 2NO2
3NO2+H2O NO+2HNO3
非酸性氧化物(不成盐氧化物)
非酸性氧化物(不成盐氧化物)
二、一氧化氮和二氧化氮
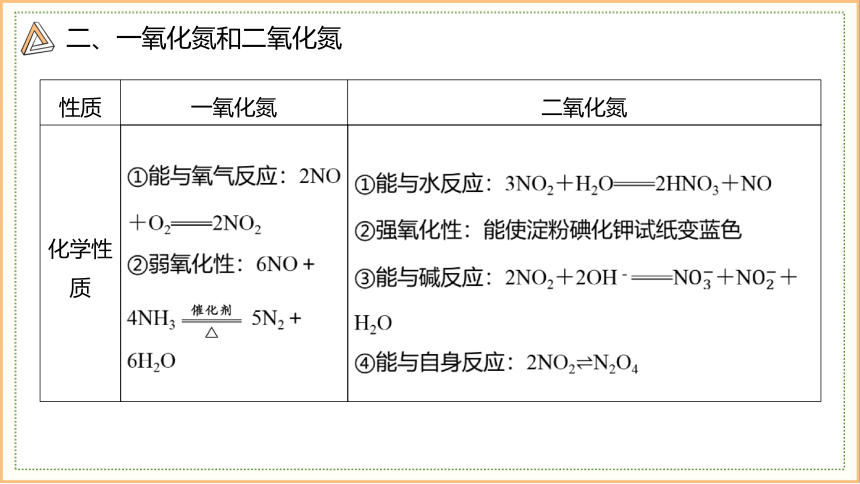
性质 一氧化氮 二氧化氮
化学性质 ①能与氧气反应:2NO+O22NO2 ②弱氧化性:6NO+4NH3 5N2+6H2O ①能与水反应:3NO2+H2O2HNO3+NO
②强氧化性:能使淀粉碘化钾试纸变蓝色
③能与碱反应:2NO2+2OH-N+N+H2O
④能与自身反应:2NO2N2O4
氮的氧化物溶于水的计算规律
(1)相关反应原理
3NO2+H2O2HNO3+NO a
2NO+O22NO2 b
由化学方程式a×2+b得:
4NO2+O2+2H2O4HNO3 c
由化学方程式a×2+b×3得:
4NO+3O2+2H2O4HNO3 d
二、一氧化氮和二氧化氮
三、氨气
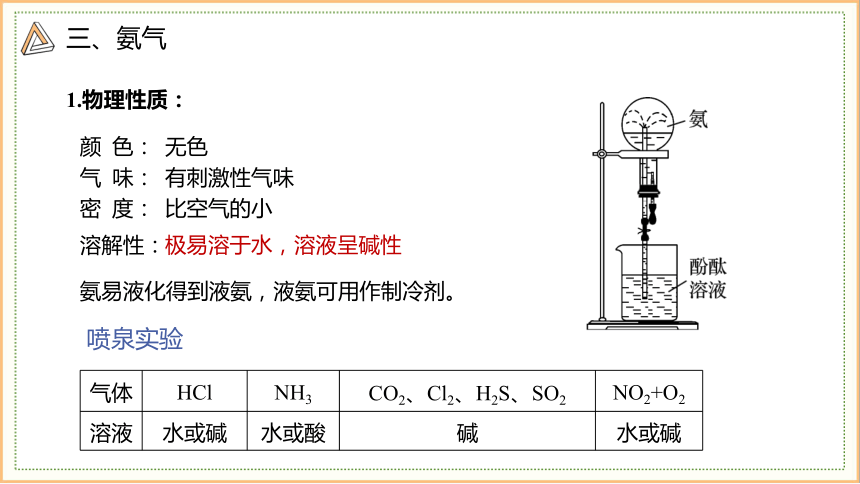
溶解性:
颜 色:
气 味:
密 度:
无色
有刺激性气味
比空气的小
1.物理性质:
氨易液化得到液氨,液氨可用作制冷剂。
极易溶于水,溶液呈碱性
气体 HCl NH3 CO2、Cl2、H2S、SO2 NO2+O2
溶液 水或碱 水或酸 碱 水或碱
喷泉实验
三、氨气
2.化学性质:
(1)与水反应:
NH3 + H2O NH3·H2O
+ OH-
NH4
+
【检验氨气】
(一水合氨)
NH3·H2O能使酚酞溶液变红或者使紫色的石蕊溶液变蓝。
氨水中的微粒:
分子:NH3·H2O、NH3、H2O
离子:NH4+、OH-、H+(极少量)
三、氨气
2.化学性质:
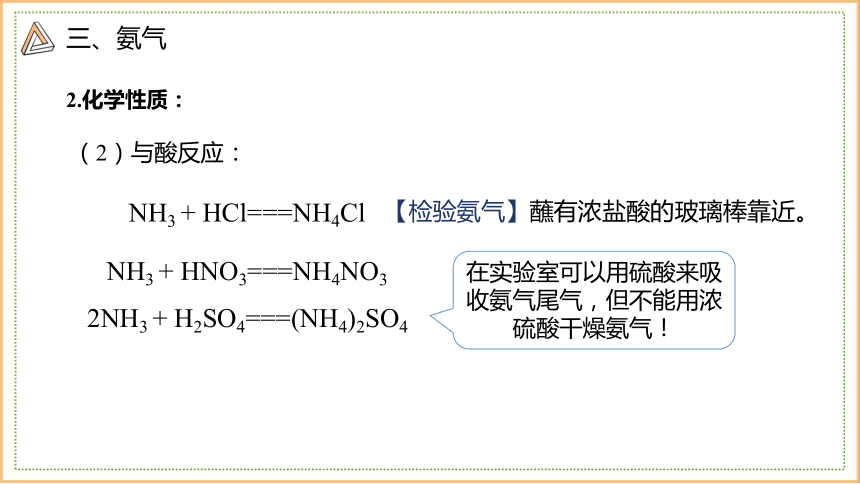
NH3 + HCl===NH4Cl
NH3 + HNO3===NH4NO3
2NH3 + H2SO4===(NH4)2SO4
【检验氨气】蘸有浓盐酸的玻璃棒靠近。
在实验室可以用硫酸来吸收氨气尾气,但不能用浓硫酸干燥氨气!
(2)与酸反应:
三、氨气
2.化学性质:
(3)NH3催化氧化
NH3
-3
处于最低价态,因此NH3具有还原性
(氨的催化氧化是工业制硝酸的基础)
4NH3 + 5O2 4NO + 6H2O
催化剂
-3
+2
四、硝酸
颜色:
气味:
状态:
密度:
溶解性:
挥发性:
无色
有刺激性气味
液体
密度比水大,溶于水放热
可与水混溶
易挥发,在空气中形成白雾
1.物理性质:
四、硝酸
2.化学性质:
HNO3=H++NO3-
(1)酸性
①与指示剂反应:
稀硝酸使石蕊溶液由紫色变为红色,
浓硝酸使紫色石蕊溶液先变红(酸性)后褪色(强氧化性)
②与碱反应:
Fe(OH)3+3HNO3=Fe(NO3)3+3H2O
③与碱性氧化物反应:
CuO+HNO3=Cu(NO3)2+H2O
④与弱酸盐反应:
CaCO3+HNO3=Ca(NO3)2+CO2↑+H2O
四、硝酸
2.化学性质:
(2)不稳定性(硝酸越浓越易分解)
4HNO3 ======= 2H2O + 4NO2↑+ O2 ↑
光照或加热
因此,硝酸要保存在棕色瓶里,并置于阴凉的地方
硝酸分解产生的NO2 又溶解在硝酸中,使硝酸呈黄色。
四、硝酸
2.化学性质:
(3)强氧化性
Cu + 4HNO3 (浓) = Cu ( NO3)2 + 2NO2 ↑+ 2H2O
Cu + 4H+ + 2NO3- = Cu2+ + 2NO2 ↑+ 2H2O
3Cu + 8HNO3 (稀) = 3Cu ( NO3)2 + 2NO ↑+ 4H2O
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O
氧化性和酸性
常温下,稀硝酸与铜缓慢反应生成NO
常温下,浓硝酸与铜迅速剧烈反应生成NO2
四、硝酸
2.化学性质:
(3)强氧化性
①能与金属反应
a.除Au、Pt等少数金属外,硝酸几乎可以氧化所有的金属且一般 不放出 。
b.常温下,Fe、Al在浓硝酸中因表面形成致密的氧化膜而 钝化 ,所以可以用铁质或铝质容器盛放浓硝酸。
不放
出H2
钝化
四、硝酸
2.化学性质:
(3)强氧化性
②能与非金属反应
浓HNO3与非金属单质(如C、S、P)等在加热条件下反应,非金属单质被氧化成最高价氧化物或含氧酸。如 C+4HNO3(浓)CO2↑+4NO2↑+2H2O 。
C+4HNO3(浓)CO2↑+
4NO2↑+2H2O
硝酸与金属反应的相关计算
五、铵盐
包含
定义
NH4Cl 、(NH4)2SO4 、 NH4NO3 、NH4HCO3
由铵根离子和酸根离子构成的化合物叫做铵盐。
颜色 溶解性 状态
无色 易溶于水 晶体
一、铵盐物理性质
实质:
铵盐化学性质
与碱反应
不稳定性
所有铵盐遇碱共热都可以生成氨气。
铵盐加热生成氨气。
五、铵盐
五、铵盐
变蓝
白烟
的检验
五、铵盐
实验室制氨气
固固加热型
不能用五氧化二磷、浓硫酸和无水氯化钙干燥。
章末复习
(大气:N2及少量的NH3、NO、NO2)
雷电作用
产生NO
NH3
根瘤菌固氮
人工合成NH3
酸雨HNO3
动物遗体或者排泄物
铵盐或者氨
硝酸盐
NO经氧化等转化
亚硝酸盐
植物吸收产生蛋白质
硝酸盐 分解产生氮气
硝化作用
NO、NO2
NO、NO2
一、氮的固定
概念:将大气中 的氮转化为 的过程
游离态
氮的化合物
氮的固定
分类
自然固氮
高能固氮(雷雨或者火山喷发)
生物固氮(如豆科植物的根瘤菌固氮)
人工固氮
合成氨(工业上合成氨)
仿生固氮(某些金属有机化合物可起到根瘤菌作用)
二、一氧化氮和二氧化氮
NO NO2
氧化物类别
转化 无色无味气体
红棕色有刺激性气味的气体
不溶于水
易溶于水
排水法
向上排空气法
色、味、态
溶解性
收集方法
2NO+O2 2NO2
3NO2+H2O NO+2HNO3
非酸性氧化物(不成盐氧化物)
非酸性氧化物(不成盐氧化物)
二、一氧化氮和二氧化氮
性质 一氧化氮 二氧化氮
化学性质 ①能与氧气反应:2NO+O22NO2 ②弱氧化性:6NO+4NH3 5N2+6H2O ①能与水反应:3NO2+H2O2HNO3+NO
②强氧化性:能使淀粉碘化钾试纸变蓝色
③能与碱反应:2NO2+2OH-N+N+H2O
④能与自身反应:2NO2N2O4
氮的氧化物溶于水的计算规律
(1)相关反应原理
3NO2+H2O2HNO3+NO a
2NO+O22NO2 b
由化学方程式a×2+b得:
4NO2+O2+2H2O4HNO3 c
由化学方程式a×2+b×3得:
4NO+3O2+2H2O4HNO3 d
二、一氧化氮和二氧化氮
三、氨气
溶解性:
颜 色:
气 味:
密 度:
无色
有刺激性气味
比空气的小
1.物理性质:
氨易液化得到液氨,液氨可用作制冷剂。
极易溶于水,溶液呈碱性
气体 HCl NH3 CO2、Cl2、H2S、SO2 NO2+O2
溶液 水或碱 水或酸 碱 水或碱
喷泉实验
三、氨气
2.化学性质:
(1)与水反应:
NH3 + H2O NH3·H2O
+ OH-
NH4
+
【检验氨气】
(一水合氨)
NH3·H2O能使酚酞溶液变红或者使紫色的石蕊溶液变蓝。
氨水中的微粒:
分子:NH3·H2O、NH3、H2O
离子:NH4+、OH-、H+(极少量)
三、氨气
2.化学性质:
NH3 + HCl===NH4Cl
NH3 + HNO3===NH4NO3
2NH3 + H2SO4===(NH4)2SO4
【检验氨气】蘸有浓盐酸的玻璃棒靠近。
在实验室可以用硫酸来吸收氨气尾气,但不能用浓硫酸干燥氨气!
(2)与酸反应:
三、氨气
2.化学性质:
(3)NH3催化氧化
NH3
-3
处于最低价态,因此NH3具有还原性
(氨的催化氧化是工业制硝酸的基础)
4NH3 + 5O2 4NO + 6H2O
催化剂
-3
+2
四、硝酸
颜色:
气味:
状态:
密度:
溶解性:
挥发性:
无色
有刺激性气味
液体
密度比水大,溶于水放热
可与水混溶
易挥发,在空气中形成白雾
1.物理性质:
四、硝酸
2.化学性质:
HNO3=H++NO3-
(1)酸性
①与指示剂反应:
稀硝酸使石蕊溶液由紫色变为红色,
浓硝酸使紫色石蕊溶液先变红(酸性)后褪色(强氧化性)
②与碱反应:
Fe(OH)3+3HNO3=Fe(NO3)3+3H2O
③与碱性氧化物反应:
CuO+HNO3=Cu(NO3)2+H2O
④与弱酸盐反应:
CaCO3+HNO3=Ca(NO3)2+CO2↑+H2O
四、硝酸
2.化学性质:
(2)不稳定性(硝酸越浓越易分解)
4HNO3 ======= 2H2O + 4NO2↑+ O2 ↑
光照或加热
因此,硝酸要保存在棕色瓶里,并置于阴凉的地方
硝酸分解产生的NO2 又溶解在硝酸中,使硝酸呈黄色。
四、硝酸
2.化学性质:
(3)强氧化性
Cu + 4HNO3 (浓) = Cu ( NO3)2 + 2NO2 ↑+ 2H2O
Cu + 4H+ + 2NO3- = Cu2+ + 2NO2 ↑+ 2H2O
3Cu + 8HNO3 (稀) = 3Cu ( NO3)2 + 2NO ↑+ 4H2O
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O
氧化性和酸性
常温下,稀硝酸与铜缓慢反应生成NO
常温下,浓硝酸与铜迅速剧烈反应生成NO2
四、硝酸
2.化学性质:
(3)强氧化性
①能与金属反应
a.除Au、Pt等少数金属外,硝酸几乎可以氧化所有的金属且一般 不放出 。
b.常温下,Fe、Al在浓硝酸中因表面形成致密的氧化膜而 钝化 ,所以可以用铁质或铝质容器盛放浓硝酸。
不放
出H2
钝化
四、硝酸
2.化学性质:
(3)强氧化性
②能与非金属反应
浓HNO3与非金属单质(如C、S、P)等在加热条件下反应,非金属单质被氧化成最高价氧化物或含氧酸。如 C+4HNO3(浓)CO2↑+4NO2↑+2H2O 。
C+4HNO3(浓)CO2↑+
4NO2↑+2H2O
硝酸与金属反应的相关计算
五、铵盐
包含
定义
NH4Cl 、(NH4)2SO4 、 NH4NO3 、NH4HCO3
由铵根离子和酸根离子构成的化合物叫做铵盐。
颜色 溶解性 状态
无色 易溶于水 晶体
一、铵盐物理性质
实质:
铵盐化学性质
与碱反应
不稳定性
所有铵盐遇碱共热都可以生成氨气。
铵盐加热生成氨气。
五、铵盐
五、铵盐
变蓝
白烟
的检验
五、铵盐
实验室制氨气
固固加热型
不能用五氧化二磷、浓硫酸和无水氯化钙干燥。
