4.1 课时1 醇 课件 (共27张PPT)2024-2025学年高二化学苏教版(2019)选择性必修3
文档属性
| 名称 | 4.1 课时1 醇 课件 (共27张PPT)2024-2025学年高二化学苏教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 55.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-01 21:05:26 | ||
图片预览






文档简介
(共27张PPT)
醇
1.以乙醇为例,认识醇类的结构、性质、转化关系及其在生产、生活中的
重要应用。
2.结合典型实例认识官能团与性质的关系,知道氧化、加成、取代、聚合
等有机反应类型。
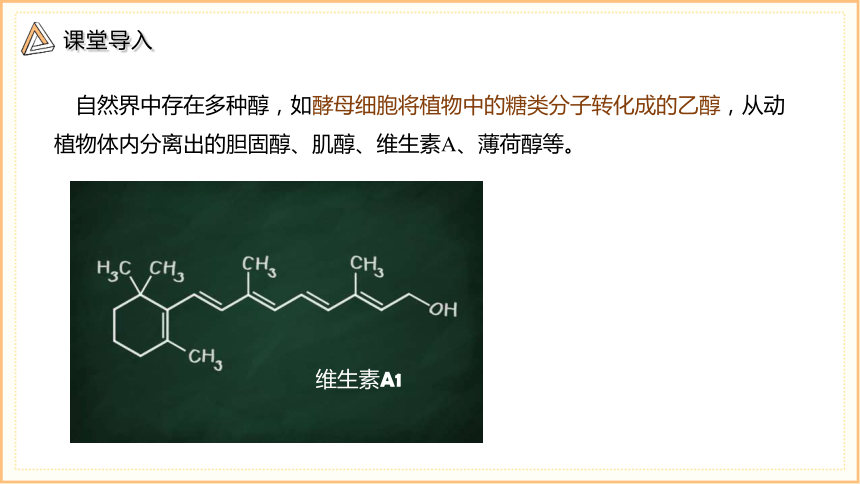
自然界中存在多种醇,如酵母细胞将植物中的糖类分子转化成的乙醇,从动植物体内分离出的胆固醇、肌醇、维生素A、薄荷醇等。
维生素A1
一、醇的结构与性质
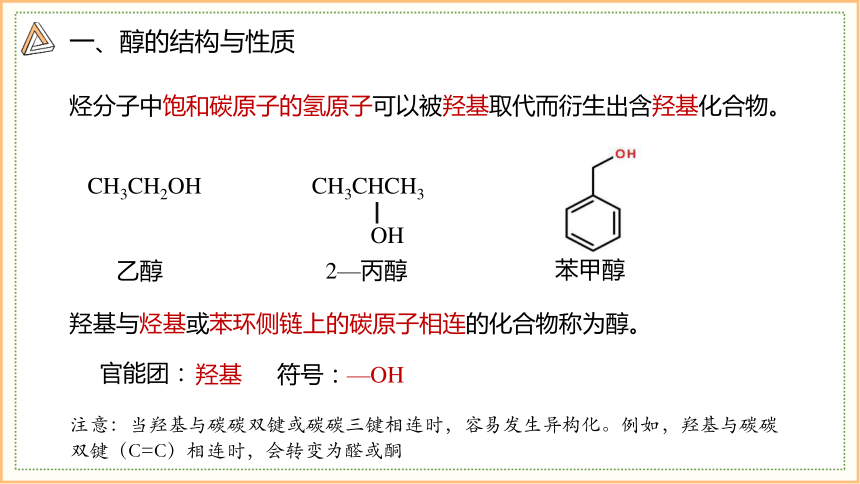
烃分子中饱和碳原子的氢原子可以被羟基取代而衍生出含羟基化合物。
羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇。
CH3CH2OH
CH3CHCH3
OH
乙醇
2—丙醇
苯甲醇
官能团:
羟基 符号:—OH
注意:当羟基与碳碳双键或碳碳三键相连时,容易发生异构化。例如,羟基与碳碳双键(C=C)相连时,会转变为醛或酮
一、醇的结构与性质
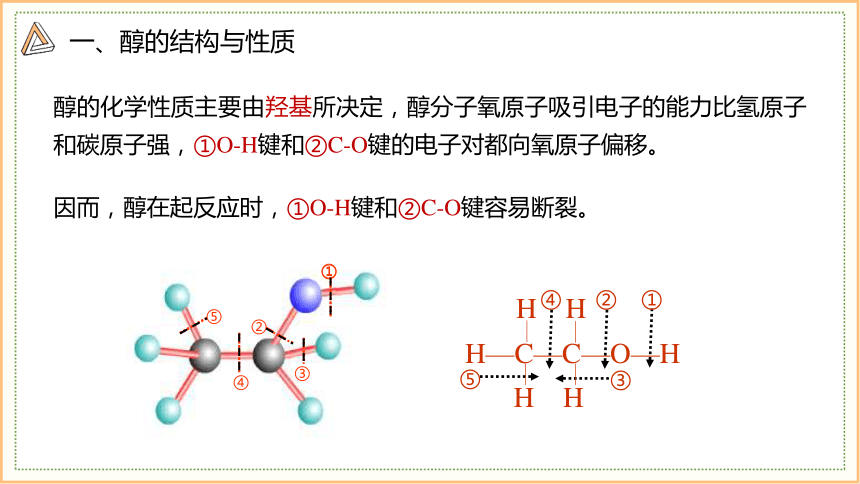
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O-H键和②C-O键的电子对都向氧原子偏移。
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
因而,醇在起反应时,①O-H键和②C-O键容易断裂。
一、醇的结构与性质
1.与金属钠的反应
沉 而
不熔、
动 而
不响。
乙醇分子中羟基上的氢不如水分子中的氢活泼。
结论:
原因:
羟基受乙基的影响而活性减弱
一、醇的结构与性质
1.与金属钠的反应
⑤
①
③
H—C—C—O—H
H H
H H
②
④
每2mol 羟基与足量的Na反应生成1mol H2
乙醇钠
断①号键
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
置换反应
其它活泼金属如钾、钙等也可与乙醇反应产生H2。
醚不能跟钠反应。
一、醇的结构与性质
2.消去反应
实验现象:
稀酸性高锰酸钾溶液褪色
生成了乙烯
一、醇的结构与性质
2.消去反应
在一定条件下,一个有机化合物分子内脱去一个或几个小分子生成不饱和化合物(含双键或三键)的反应。
⑤
①
③
H—C—C—O—H
H H
H H
②
④
1700C
浓H2SO4
H C C H H2O + CH2=CH2
H
H
H
OH
断②⑤号键
结构条件:β-C有H(β-H)
一、醇的结构与性质
注意:实验室制备的乙烯常含有有乙醚、乙醇蒸气、SO2、CO2及H2O
⑤
①
③
H—C—C—O—H
H H
H H
②
④
断①②号键
分子间脱水:
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3
浓H2SO4
140 ℃
+H2O
温度适中使人着迷(醚)
温度过高使人窒息(制烯)
乙醚
【实验思考】
②浓硫酸的作用是什么
①碎瓷片作用是什么
③酒精与浓硫酸混合液如何配置?
防止暴沸
催化剂和脱水剂
为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水酒精,此时酒精与浓硫酸体积比以1:3为宜。
【实验思考】
④温度计的位置?
⑤为何使液体温度迅速升到170℃,不能过高或高低?
温度计感温泡要置于反应物的中央位置,因为需要测量的是反应物的温度。
因为无水酒精和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
【实验思考】
⑥混合液颜色如何变化?为什么?
⑦有何杂质气体?如何除去?
烧瓶中的液体逐渐变黑。因为浓硫酸的脱水性,使乙醇脱水炭化。
由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通入10%NaOH溶液洗气除杂。
一、醇的结构与性质
3.乙醇能够被氧化剂氧化
①燃烧(淡蓝色火焰):
2CO2 +3H2O
C2H5OH +3 O2
点燃
酸性KMnO4
酸性K2Cr2O7
②与强氧化剂反应:
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
一、醇的结构与性质
3.乙醇能够被氧化剂氧化
③催化氧化(去氢):
【思考】所有的醇都可以发生催化氧化吗?
断①③号键
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
一、醇的结构与性质
对醇结构要求:
需有α—H(连羟基的碳上有氢)
α-C上氢原子个数
一、醇的结构与性质
4.取代反应
①酯化反应:
CH3CO—OH+ H—OCH2CH3 CH3COOCH2CH3+H2O
浓硫酸作催化剂和吸水剂
断①号键
⑤
①
③
H—C—C—O—H
H H
H H
②
④
②乙醇的分子间脱水成醚
一、醇的结构与性质
4.取代反应
③与氢溴酸在加热条件下的取代反应(制溴乙烷的方法)
实验现象:Ⅱ中产生油状液体
C2H5—OH + HBr C2H5Br + H2O
△
断②号键
醇不仅可以与氢溴酸反应,还可以与其他氢卤酸反应。
在反应中,醇分子中的羟基被卤素原子取代生成卤代烃。
R C C R
H
H
H
O H
β α
分析结构
性质
断键部位
反应类型
反应产物
反应试剂 条件
取代反应
Na
羧酸
醇钠
酯
氧化反应
O2,Cu
醛、酮
①
②
③
④
①
①③
②
取代反应
氢卤酸
卤代烃
②④
消去反应
浓H2SO4
烯烃
①或②
取代反应
浓H2SO4
醚
'
一、醇的结构与性质
在下列反应中乙醇分子不会发生C—O键断裂的是( )
A.乙醇与浓氢溴酸的取代反应
B.乙醇在浓硫酸存在条件下生成二乙醚
C.乙醇在浓硫酸存在条件下发生消去反应
D.乙醇在铜丝存在条件下被催化氧化
D
二、醇的重要应用
(1)按分子中羟基的数目分:
CH2=CHCH2-OH
一元醇
多元醇
饱和一元醇 (R-OH)
不饱和一元醇:
醇
通式:CnH2n+1OH (n≥1)
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
乙二醇
丙三醇
醇的分类
二、醇的重要应用
是组成最简单的一元醇,也称木醇。
无色、具有挥发性的液体,沸点65℃左右。有毒。
重要的化工原料,也可用作燃料。
CH3OH
甲醇
无色、无臭、具有甜味的黏稠液体。熔点-16℃ ,沸点197℃ 。能与水以任意比例互溶。是汽车防冻液的主要成分、合成涤纶的主要原料。
CH2
CH2
OH
OH
乙二醇
二、醇的重要应用
俗称甘油,无色、无臭、具有甜味的黏稠液体。沸点290℃ 。能与水以任意比例互溶,具有很强的吸水能力。主要用于制造日用化妆品和三硝酸甘油酯。
丙三醇
CH2
CH
CH2
OH
OH
OH
二、醇的重要应用
(2)按烃基是否饱和分:
(3)按烃基的种类分:
饱和醇 不饱和醇
脂肪醇 脂环醇 芳香醇
(4) 按与羟基相接的碳原子的级数分:
CH3CH2OH
CH3CHCH3
OH
C(CH3)3-OH
伯醇 RCH2OH
仲醇 R2CHOH
叔醇 R3COH
1 醇(伯醇) 2 醇(仲醇) 3 醇(叔醇)
三、醇的命名
编号位
选主链
写名称
——选最长碳链,且含羟基(—OH)
——从离羟基(—OH)最近的一端起编
——取代基位置— 取代基名称 — 羟基位置— 母体名称
(羟基位置用阿拉伯数字表示;羟基个数用“二”、“三”等表示)
CH3—CH—CH2—OH
CH3
2-甲基-1-丙醇
1,2,3-丙三醇
CH2—CH—CH2
OH
OH
OH
四、醇的物理性质
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
相对分子质量相近的醇与烷烃的沸点比较
结论:
相对分子质量相近时,醇比烷烃的沸点远高得多
醇分子间存在氢键,增强了分子间的作用力。
下列关于醇类物质的物理性质的说法,不正确的是( )
A.乙醇是常用的有机溶剂,可用于萃取碘水中的碘
B.沸点:乙二醇>乙醇>丙烷
C.交警对驾驶员进行呼气酒精检测,利用了酒精易挥发的性质
D.甲醇、乙醇、丙醇均可与水以任意比例混溶,这是因为这些醇与水形成了氢键
A
醇
1.以乙醇为例,认识醇类的结构、性质、转化关系及其在生产、生活中的
重要应用。
2.结合典型实例认识官能团与性质的关系,知道氧化、加成、取代、聚合
等有机反应类型。
自然界中存在多种醇,如酵母细胞将植物中的糖类分子转化成的乙醇,从动植物体内分离出的胆固醇、肌醇、维生素A、薄荷醇等。
维生素A1
一、醇的结构与性质
烃分子中饱和碳原子的氢原子可以被羟基取代而衍生出含羟基化合物。
羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇。
CH3CH2OH
CH3CHCH3
OH
乙醇
2—丙醇
苯甲醇
官能团:
羟基 符号:—OH
注意:当羟基与碳碳双键或碳碳三键相连时,容易发生异构化。例如,羟基与碳碳双键(C=C)相连时,会转变为醛或酮
一、醇的结构与性质
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O-H键和②C-O键的电子对都向氧原子偏移。
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
因而,醇在起反应时,①O-H键和②C-O键容易断裂。
一、醇的结构与性质
1.与金属钠的反应
沉 而
不熔、
动 而
不响。
乙醇分子中羟基上的氢不如水分子中的氢活泼。
结论:
原因:
羟基受乙基的影响而活性减弱
一、醇的结构与性质
1.与金属钠的反应
⑤
①
③
H—C—C—O—H
H H
H H
②
④
每2mol 羟基与足量的Na反应生成1mol H2
乙醇钠
断①号键
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
置换反应
其它活泼金属如钾、钙等也可与乙醇反应产生H2。
醚不能跟钠反应。
一、醇的结构与性质
2.消去反应
实验现象:
稀酸性高锰酸钾溶液褪色
生成了乙烯
一、醇的结构与性质
2.消去反应
在一定条件下,一个有机化合物分子内脱去一个或几个小分子生成不饱和化合物(含双键或三键)的反应。
⑤
①
③
H—C—C—O—H
H H
H H
②
④
1700C
浓H2SO4
H C C H H2O + CH2=CH2
H
H
H
OH
断②⑤号键
结构条件:β-C有H(β-H)
一、醇的结构与性质
注意:实验室制备的乙烯常含有有乙醚、乙醇蒸气、SO2、CO2及H2O
⑤
①
③
H—C—C—O—H
H H
H H
②
④
断①②号键
分子间脱水:
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3
浓H2SO4
140 ℃
+H2O
温度适中使人着迷(醚)
温度过高使人窒息(制烯)
乙醚
【实验思考】
②浓硫酸的作用是什么
①碎瓷片作用是什么
③酒精与浓硫酸混合液如何配置?
防止暴沸
催化剂和脱水剂
为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水酒精,此时酒精与浓硫酸体积比以1:3为宜。
【实验思考】
④温度计的位置?
⑤为何使液体温度迅速升到170℃,不能过高或高低?
温度计感温泡要置于反应物的中央位置,因为需要测量的是反应物的温度。
因为无水酒精和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
【实验思考】
⑥混合液颜色如何变化?为什么?
⑦有何杂质气体?如何除去?
烧瓶中的液体逐渐变黑。因为浓硫酸的脱水性,使乙醇脱水炭化。
由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通入10%NaOH溶液洗气除杂。
一、醇的结构与性质
3.乙醇能够被氧化剂氧化
①燃烧(淡蓝色火焰):
2CO2 +3H2O
C2H5OH +3 O2
点燃
酸性KMnO4
酸性K2Cr2O7
②与强氧化剂反应:
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
一、醇的结构与性质
3.乙醇能够被氧化剂氧化
③催化氧化(去氢):
【思考】所有的醇都可以发生催化氧化吗?
断①③号键
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
一、醇的结构与性质
对醇结构要求:
需有α—H(连羟基的碳上有氢)
α-C上氢原子个数
一、醇的结构与性质
4.取代反应
①酯化反应:
CH3CO—OH+ H—OCH2CH3 CH3COOCH2CH3+H2O
浓硫酸作催化剂和吸水剂
断①号键
⑤
①
③
H—C—C—O—H
H H
H H
②
④
②乙醇的分子间脱水成醚
一、醇的结构与性质
4.取代反应
③与氢溴酸在加热条件下的取代反应(制溴乙烷的方法)
实验现象:Ⅱ中产生油状液体
C2H5—OH + HBr C2H5Br + H2O
△
断②号键
醇不仅可以与氢溴酸反应,还可以与其他氢卤酸反应。
在反应中,醇分子中的羟基被卤素原子取代生成卤代烃。
R C C R
H
H
H
O H
β α
分析结构
性质
断键部位
反应类型
反应产物
反应试剂 条件
取代反应
Na
羧酸
醇钠
酯
氧化反应
O2,Cu
醛、酮
①
②
③
④
①
①③
②
取代反应
氢卤酸
卤代烃
②④
消去反应
浓H2SO4
烯烃
①或②
取代反应
浓H2SO4
醚
'
一、醇的结构与性质
在下列反应中乙醇分子不会发生C—O键断裂的是( )
A.乙醇与浓氢溴酸的取代反应
B.乙醇在浓硫酸存在条件下生成二乙醚
C.乙醇在浓硫酸存在条件下发生消去反应
D.乙醇在铜丝存在条件下被催化氧化
D
二、醇的重要应用
(1)按分子中羟基的数目分:
CH2=CHCH2-OH
一元醇
多元醇
饱和一元醇 (R-OH)
不饱和一元醇:
醇
通式:CnH2n+1OH (n≥1)
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
乙二醇
丙三醇
醇的分类
二、醇的重要应用
是组成最简单的一元醇,也称木醇。
无色、具有挥发性的液体,沸点65℃左右。有毒。
重要的化工原料,也可用作燃料。
CH3OH
甲醇
无色、无臭、具有甜味的黏稠液体。熔点-16℃ ,沸点197℃ 。能与水以任意比例互溶。是汽车防冻液的主要成分、合成涤纶的主要原料。
CH2
CH2
OH
OH
乙二醇
二、醇的重要应用
俗称甘油,无色、无臭、具有甜味的黏稠液体。沸点290℃ 。能与水以任意比例互溶,具有很强的吸水能力。主要用于制造日用化妆品和三硝酸甘油酯。
丙三醇
CH2
CH
CH2
OH
OH
OH
二、醇的重要应用
(2)按烃基是否饱和分:
(3)按烃基的种类分:
饱和醇 不饱和醇
脂肪醇 脂环醇 芳香醇
(4) 按与羟基相接的碳原子的级数分:
CH3CH2OH
CH3CHCH3
OH
C(CH3)3-OH
伯醇 RCH2OH
仲醇 R2CHOH
叔醇 R3COH
1 醇(伯醇) 2 醇(仲醇) 3 醇(叔醇)
三、醇的命名
编号位
选主链
写名称
——选最长碳链,且含羟基(—OH)
——从离羟基(—OH)最近的一端起编
——取代基位置— 取代基名称 — 羟基位置— 母体名称
(羟基位置用阿拉伯数字表示;羟基个数用“二”、“三”等表示)
CH3—CH—CH2—OH
CH3
2-甲基-1-丙醇
1,2,3-丙三醇
CH2—CH—CH2
OH
OH
OH
四、醇的物理性质
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
相对分子质量相近的醇与烷烃的沸点比较
结论:
相对分子质量相近时,醇比烷烃的沸点远高得多
醇分子间存在氢键,增强了分子间的作用力。
下列关于醇类物质的物理性质的说法,不正确的是( )
A.乙醇是常用的有机溶剂,可用于萃取碘水中的碘
B.沸点:乙二醇>乙醇>丙烷
C.交警对驾驶员进行呼气酒精检测,利用了酒精易挥发的性质
D.甲醇、乙醇、丙醇均可与水以任意比例混溶,这是因为这些醇与水形成了氢键
A
