专题4 生活中常用的有机物——烃的含氧衍生物 课件(共35张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修3
文档属性
| 名称 | 专题4 生活中常用的有机物——烃的含氧衍生物 课件(共35张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-01 22:33:40 | ||
图片预览






文档简介
(共35张PPT)
专题复习
一、醇
羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇。
注意:当羟基与碳碳双键或碳碳三键相连时,容易发生异构化。例如,羟基与碳碳双键(C=C)相连时,会转变为醛或酮
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O-H键和②C-O键的电子对都向氧原子偏移。
因而,醇在起反应时,①O-H键和②C-O键容易断裂。
⑤
①
③
H—C—C—O—H
H H
H H
②
④
一、醇
1.与金属钠的反应
每2mol 羟基与足量的Na反应生成1mol H2
乙醇钠
断①号键
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
置换反应
其它活泼金属如钾、钙等也可与乙醇反应产生H2。
醚不能跟钠反应。
一、醇
2.消去反应
在一定条件下,一个有机化合物分子内脱去一个或几个小分子生成不饱和化合物(含双键或三键)的反应。
1700C
浓H2SO4
H C C H H2O + CH2=CH2
H
H
H
OH
断②⑤号键
结构条件:β-C有H(β-H)
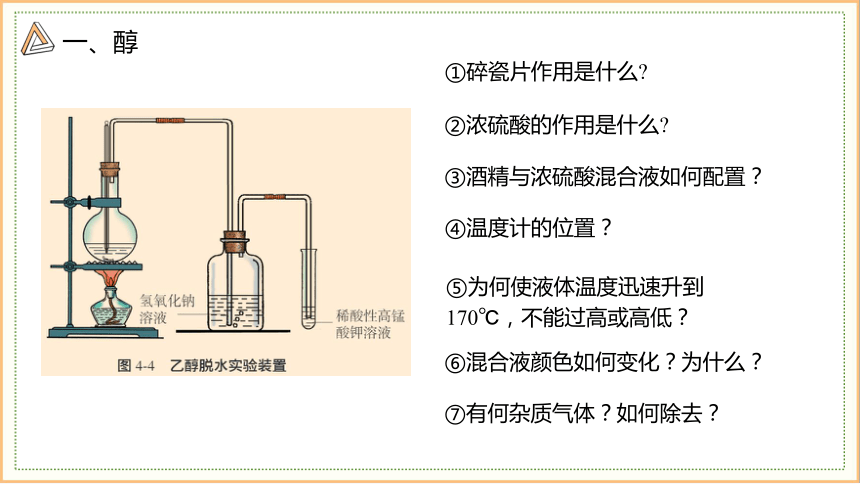
一、醇
②浓硫酸的作用是什么
①碎瓷片作用是什么
③酒精与浓硫酸混合液如何配置?
④温度计的位置?
⑤为何使液体温度迅速升到170℃,不能过高或高低?
⑥混合液颜色如何变化?为什么?
⑦有何杂质气体?如何除去?
一、醇
注意:实验室制备的乙烯常含有有乙醚、乙醇蒸气、SO2、CO2及H2O
断①②号键
分子间脱水:
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3
浓H2SO4
140 ℃
+H2O
温度适中使人着迷(醚)
温度过高使人窒息(制烯)
乙醚
一、醇
3.乙醇能够被氧化剂氧化
①燃烧(淡蓝色火焰):
2CO2 +3H2O
C2H5OH +3 O2
点燃
酸性KMnO4
酸性K2Cr2O7
②与强氧化剂反应:
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
一、醇
③催化氧化(去氢):
对醇结构要求:
需有α—H(连羟基的碳上有氢)
α-C上氢原子个数
4.取代反应
①酯化反应:
CH3CO—OH+ H—OCH2CH3 CH3COOCH2CH3+H2O
浓硫酸作催化剂和吸水剂
断①号键
②乙醇的分子间脱水成醚
一、醇
一、醇
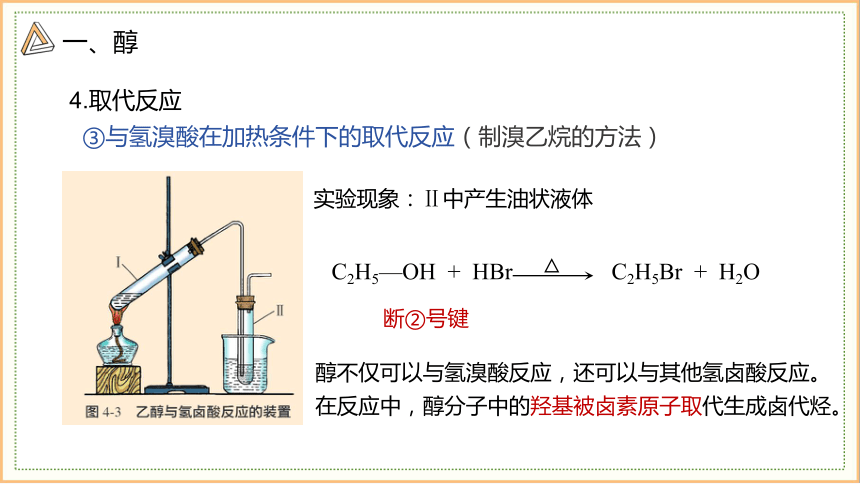
4.取代反应
③与氢溴酸在加热条件下的取代反应(制溴乙烷的方法)
实验现象:Ⅱ中产生油状液体
C2H5—OH + HBr C2H5Br + H2O
△
断②号键
醇不仅可以与氢溴酸反应,还可以与其他氢卤酸反应。
在反应中,醇分子中的羟基被卤素原子取代生成卤代烃。
一、醇
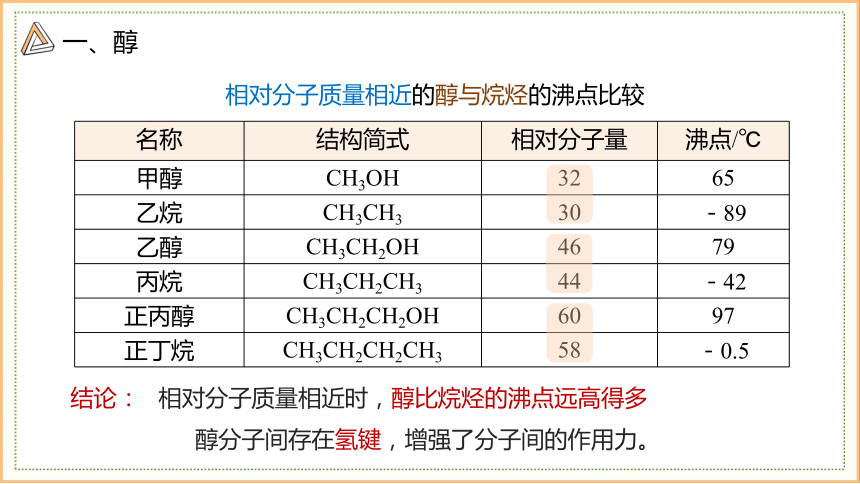
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
相对分子质量相近的醇与烷烃的沸点比较
结论:
相对分子质量相近时,醇比烷烃的沸点远高得多
醇分子间存在氢键,增强了分子间的作用力。
二、酚
分子中羟基与苯环碳原子直接相连的有机化合物
颜色:
纯苯酚无色,在空气中被氧化显红色。
气味:
有特殊气味
状态:
常温下,无色晶体,熔点(40.9℃)
有毒,强腐蚀性,皮肤沾到苯酚,立即用酒精清洗,再用水冲洗。
有机分子内原子或原子团的相互影响
(1)链烃基对其他基团的影响:甲苯的硝化反应产物是三硝基甲苯,而同样条件下的苯的硝化反应只能生成一硝基苯。
(2)苯环对其他基团的影响:
①水、醇、苯酚提供氢离子的能力大小:R—OH < H—OH < C6H5—OH。
②烷烃和苯均不能使酸性高锰酸钾溶液褪色,而苯的同系物可使酸性高锰酸钾溶液褪色。
(3)羟基对其他基团的影响:
①羟基对C—H的影响:使和羟基相连的C—H更不稳定。
②羟基对苯环的影响:使苯环邻、对位上的氢原子更易被取代。
二、酚
1.弱酸性
变澄清
变浑浊
变浑浊
酸性:HCl>C6H5OH
酸性:H2CO3>C6H5OH
注意:苯酚酸性较弱,俗称石炭酸不能使酸碱指示剂变色。
向苯酚钠溶液中通入CO2时,无论CO2过量与否,产物均为NaHCO3
二、酚
2.与溴水的取代反应
注意:
① 溴只能取代苯环上羟基的邻和对位上的氢,与甲苯相似;
② 苯酚与饱和溴水反应不需要催化剂,这说明羟基对苯环产生了影响,使取代更易进行。
③溴水应过量,否则生成的三溴苯酚会溶于苯酚中
④不能用溴水除去苯中混有的苯酚。
2,4,6-三溴苯酚
羟基使苯环邻、对位氢更活泼,更易取代。
应用:反应灵敏,可用于酚的定性检验与定量测定;
二、酚
3.苯酚的显色反应
其他的酚类物质也会发生类似的反应。该显色反应非常灵敏,常用于酚类物质的检验。
溶液显紫色。
二、酚
4.苯酚的氧化反应
①可燃性
②空气中被氧化
③与酸性高锰酸钾
苯酚能使酸性高锰酸钾溶液褪色
C6H6O+7O2 6CO2+3H2O
点燃
三、醛
α
分析结构
δ-
δ+
醛基
碳氧双键
碳氢单键
均为极性共价键
R C C H
H
H
O
醛基碳不饱和,C=O双键易断裂,易加成、加聚,可被H2还原(加成)为醇,具有氧化性。
受C=O影响,C-H键极性较强,易断裂,易被氧化成相应羧酸,具有还原性。
碳氧双键具有较强的极性,使α-H具有一定的活性,能被卤素取代发生α-H的卤化。
三、醛
【实验3-7】在洁净的试管中加入1 mL 2% AgNO3溶液,然后边振荡边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
向A中滴加氨水,现象为先产生白色沉淀后变澄清,水浴加热一段时间后,试管内壁出现一层光亮的银镜。
实验现象:
实验探究 乙醛与银氨溶液的反应(银镜反应)
每mol醛基可生成2mol银:—CHO~2Ag
△
CH3CHO+ 2Ag(NH3)2OH CH3COONH4+H2O+2Ag↓+3NH3
三、醛
在试管里加入2 mL 10% NaOH溶液,加入5滴 5% CuSO4,溶液,得到新制的Cu(OH)2,振荡后加入0.5 mL乙醛溶液,加热。观察实验现象。
实验探究 乙醛与新制氢氧化铜溶液的反应
实验现象:
A中溶液出现蓝色絮状沉淀,
C中有砖红色沉淀产生。
三、醛
A中新制Cu(OH)2悬浊液的配置
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
C中乙醛与新制Cu(OH)2的反应
应用:检验醛基,医疗上检测尿糖;
CH3CHO+2Cu(OH)2+NaOH → CH3COONa+Cu2O↓+3H2O
实验探究 乙醛与新制氢氧化铜溶液的反应
三、醛
特征反应 银镜反应 与新制的Cu(OH)2反应
现象 产生光亮的银镜 产生砖红色沉淀
注意 事项 (1)试管内壁必须洁净。 (2)银氨溶液随用随配,不可久置。 (3)水浴加热,不可用酒精灯直接加热。 (4)醛用量不宜太多,如乙醛一般滴3滴。 (5)银镜可用稀硝酸浸泡洗涤除去 (1)新制的Cu(OH)2要随用
随配,不可久置。
(2)配制新制的Cu(OH)2时,
所用NaOH溶液必须过量
小结:醛类的两个特征反应及—CHO的检验
三、醛
加成反应
氧化反应
催化氧化
被弱氧化剂氧化
燃烧
CO2、H2O
银镜反应
Cu(OH)2
能使高锰酸钾溶液、溴水褪色
醛+H2→醇(还原反应)
醛+HCN→羟基腈
乙醛的化学性质
三、醛
甲醛
特殊点:
甲醛中相当于有2个-CHO可被氧化。
写出甲醛分别与银氨溶液、新制氢氧化铜溶液的反应方程式。
△
HCHO+4[Ag(NH3)2]OH 4Ag↓+(NH4)2CO3+6NH3+2H2O
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+Na2CO3+6H2O
△
甲醛其结构相当于两个醛基,1mol HCHO ~ 4Ag~2molCu2O
缩聚反应:
→甲醛的水溶液(福尔马林)可用于消毒和浸制标本
四、酮
丙酮的化学性质
不能被银氨溶液、新制的Cu(OH)2等弱氧化剂氧化,但在催化剂存在的条件下,能催化加氢生成醇,也能与氰化氢加成。
反应的化学方程式:
+H2
催化剂
△
+HCN
催化剂
△
五、羧酸
1. 酸性
RCOOH
RCOO-+H+
反应 现象与化学方程式
与酸碱指示剂
与碱
与碱性氧化物
与活泼金属
与某些盐溶液
羧酸的酸性比碳酸强
羧酸能使紫色石蕊溶液变红
RCOOH+NaOH→RCOONa+H2O
CuO+2RCOOH→(RCOO)2Cu+H2O
2RCOOH+2Na→2RCOONa+H2↑
2RCOOH+Na2CO3→2RCOONa+CO2↑+H2O
RCOOH+NaHCO3→RCOONa+CO2↑+H2O
1、随着分子中碳原子数的增加,羧酸的酸性逐渐减弱。高级脂肪酸不一定能使酸碱指示剂变色。
2、随着羧基数目的增加,羧酸的酸性逐渐增强。乙二酸>乙酸。
羧酸的酸性规律:
问:下列常见物质酸性强弱比较:苯酚、甲酸、乙酸、乙二酸、碳酸、丙酸。
乙二酸>甲酸>乙酸>丙酸>碳酸>苯酚
五、羧酸
五、羧酸
含羟基的物质 醇 水 酚 低级羧酸
羟基上氢原 子活泼性 在水溶液中 电离程度 极难电离 难电离 微弱电离 部分
电离
酸碱性 中性 中性 很弱的酸性 弱酸性
五、羧酸
含羟基的物质 醇 水 酚 低级羧酸
与Na反应 反应放出H2 反应放出H2 反应放出H2 反应放出H2
与NaOH反应 不反应 不反应 反应 反应
与NaHCO3反应 不反应 水解 不反应 反应放出CO2
与Na2CO3反应 不反应 水解 反应生成NaHCO3 反应放出CO2
五、羧酸
2. 酯化反应
饱和碳酸钠溶液的液面上有无色透明的油状液体生成,且能闻到香味。
乙酸乙酯
同位素示踪法
酸脱羟基醇脱氢
酯化反应实验注意事项
导管在饱和Na2CO3液面上:防倒吸
长导管作用:
导气兼冷凝
加物顺序:
乙醇→浓硫酸→乙酸
饱和Na2CO3作用:
①溶解乙醇;
②中和乙酸;
③降低乙酸乙酯的溶解度,利于酯的析出
浓硫酸作用:
催化剂、吸水剂
沸点:
乙酸乙酯(77.1)
乙醇(78.3 ℃ )
乙酸(118℃)
小心加热:
减少乙酸、乙醇的挥发。
加热:
加快反应速率,蒸出乙酸乙酯,提高乙酸转化率。
分离碳酸钠和乙酸乙酯:
分液
五、羧酸
3. 缩聚反应
有机化合物分子间脱去小分子获得高分子化合物的反应。
加聚反应 缩聚反应
单体特征
单体种类
聚合方式
聚合物特征
产物
含不饱和键或环
一般含有两个官能团
含碳碳双键或碳碳三键
酚、醛、醇、羧酸、氨基酸等
通过不饱和键或开环加成
通过官能团缩合脱去小分子而连接
聚合物链节和单体具有相同的化学组成
聚合物链节和单体具有不同的化学组成
聚合物
聚合物和小分子
加聚反应和缩聚反应的比较
4. 还原反应
RCOOH RCH2OH
LiAlH4
与醛和酮相比,羧基中的羧基较难与H2加成而被还原,只有强还原剂LiAlH4等才能将羧酸还原。
五、羧酸
六、酯
酸性水解
碱性水解
C
O
R’
R
O
RCOOR’+NaOH RCOONa+R’OH
RCOOR’+H2O RCOOH+R’OH
浓硫酸
注意:酯在无机酸、碱催化下,均能发生水解反应,其中在酸性条件下水解是可逆的,在碱性条件下水解是不可逆的。
专题复习
一、醇
羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇。
注意:当羟基与碳碳双键或碳碳三键相连时,容易发生异构化。例如,羟基与碳碳双键(C=C)相连时,会转变为醛或酮
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O-H键和②C-O键的电子对都向氧原子偏移。
因而,醇在起反应时,①O-H键和②C-O键容易断裂。
⑤
①
③
H—C—C—O—H
H H
H H
②
④
一、醇
1.与金属钠的反应
每2mol 羟基与足量的Na反应生成1mol H2
乙醇钠
断①号键
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
置换反应
其它活泼金属如钾、钙等也可与乙醇反应产生H2。
醚不能跟钠反应。
一、醇
2.消去反应
在一定条件下,一个有机化合物分子内脱去一个或几个小分子生成不饱和化合物(含双键或三键)的反应。
1700C
浓H2SO4
H C C H H2O + CH2=CH2
H
H
H
OH
断②⑤号键
结构条件:β-C有H(β-H)
一、醇
②浓硫酸的作用是什么
①碎瓷片作用是什么
③酒精与浓硫酸混合液如何配置?
④温度计的位置?
⑤为何使液体温度迅速升到170℃,不能过高或高低?
⑥混合液颜色如何变化?为什么?
⑦有何杂质气体?如何除去?
一、醇
注意:实验室制备的乙烯常含有有乙醚、乙醇蒸气、SO2、CO2及H2O
断①②号键
分子间脱水:
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3
浓H2SO4
140 ℃
+H2O
温度适中使人着迷(醚)
温度过高使人窒息(制烯)
乙醚
一、醇
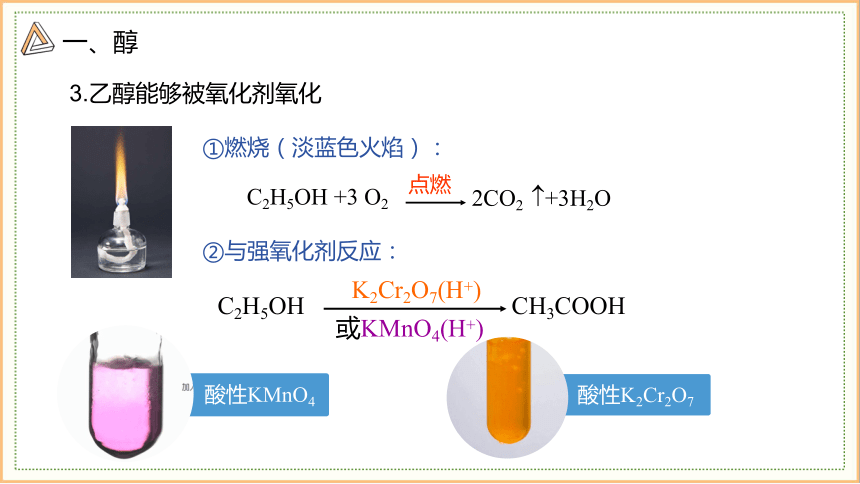
3.乙醇能够被氧化剂氧化
①燃烧(淡蓝色火焰):
2CO2 +3H2O
C2H5OH +3 O2
点燃
酸性KMnO4
酸性K2Cr2O7
②与强氧化剂反应:
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
一、醇
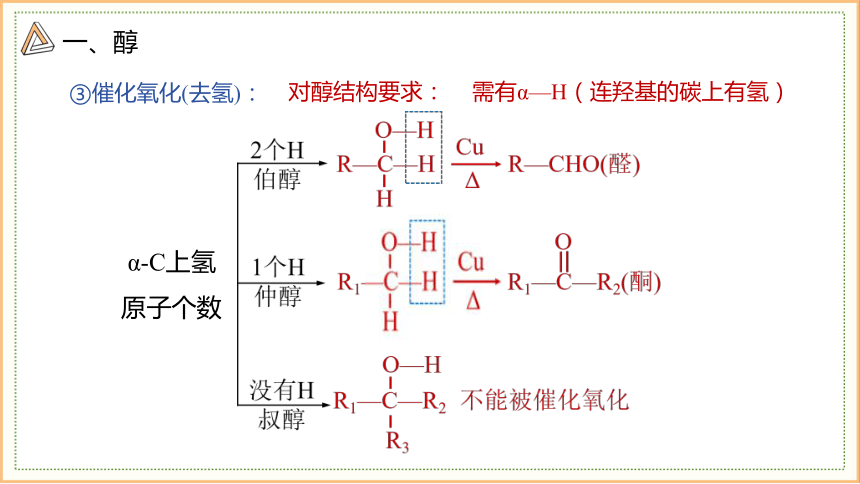
③催化氧化(去氢):
对醇结构要求:
需有α—H(连羟基的碳上有氢)
α-C上氢原子个数
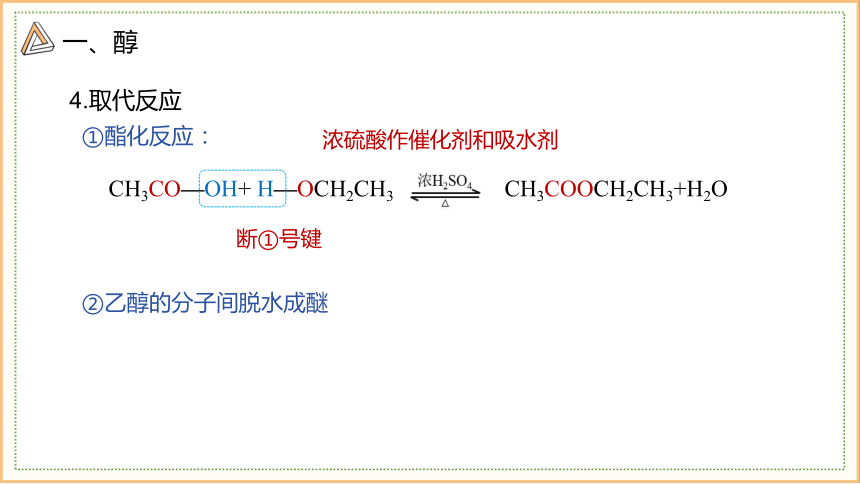
4.取代反应
①酯化反应:
CH3CO—OH+ H—OCH2CH3 CH3COOCH2CH3+H2O
浓硫酸作催化剂和吸水剂
断①号键
②乙醇的分子间脱水成醚
一、醇
一、醇
4.取代反应
③与氢溴酸在加热条件下的取代反应(制溴乙烷的方法)
实验现象:Ⅱ中产生油状液体
C2H5—OH + HBr C2H5Br + H2O
△
断②号键
醇不仅可以与氢溴酸反应,还可以与其他氢卤酸反应。
在反应中,醇分子中的羟基被卤素原子取代生成卤代烃。
一、醇
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
相对分子质量相近的醇与烷烃的沸点比较
结论:
相对分子质量相近时,醇比烷烃的沸点远高得多
醇分子间存在氢键,增强了分子间的作用力。
二、酚
分子中羟基与苯环碳原子直接相连的有机化合物
颜色:
纯苯酚无色,在空气中被氧化显红色。
气味:
有特殊气味
状态:
常温下,无色晶体,熔点(40.9℃)
有毒,强腐蚀性,皮肤沾到苯酚,立即用酒精清洗,再用水冲洗。
有机分子内原子或原子团的相互影响
(1)链烃基对其他基团的影响:甲苯的硝化反应产物是三硝基甲苯,而同样条件下的苯的硝化反应只能生成一硝基苯。
(2)苯环对其他基团的影响:
①水、醇、苯酚提供氢离子的能力大小:R—OH < H—OH < C6H5—OH。
②烷烃和苯均不能使酸性高锰酸钾溶液褪色,而苯的同系物可使酸性高锰酸钾溶液褪色。
(3)羟基对其他基团的影响:
①羟基对C—H的影响:使和羟基相连的C—H更不稳定。
②羟基对苯环的影响:使苯环邻、对位上的氢原子更易被取代。
二、酚
1.弱酸性
变澄清
变浑浊
变浑浊
酸性:HCl>C6H5OH
酸性:H2CO3>C6H5OH
注意:苯酚酸性较弱,俗称石炭酸不能使酸碱指示剂变色。
向苯酚钠溶液中通入CO2时,无论CO2过量与否,产物均为NaHCO3
二、酚
2.与溴水的取代反应
注意:
① 溴只能取代苯环上羟基的邻和对位上的氢,与甲苯相似;
② 苯酚与饱和溴水反应不需要催化剂,这说明羟基对苯环产生了影响,使取代更易进行。
③溴水应过量,否则生成的三溴苯酚会溶于苯酚中
④不能用溴水除去苯中混有的苯酚。
2,4,6-三溴苯酚
羟基使苯环邻、对位氢更活泼,更易取代。
应用:反应灵敏,可用于酚的定性检验与定量测定;
二、酚
3.苯酚的显色反应
其他的酚类物质也会发生类似的反应。该显色反应非常灵敏,常用于酚类物质的检验。
溶液显紫色。
二、酚
4.苯酚的氧化反应
①可燃性
②空气中被氧化
③与酸性高锰酸钾
苯酚能使酸性高锰酸钾溶液褪色
C6H6O+7O2 6CO2+3H2O
点燃
三、醛
α
分析结构
δ-
δ+
醛基
碳氧双键
碳氢单键
均为极性共价键
R C C H
H
H
O
醛基碳不饱和,C=O双键易断裂,易加成、加聚,可被H2还原(加成)为醇,具有氧化性。
受C=O影响,C-H键极性较强,易断裂,易被氧化成相应羧酸,具有还原性。
碳氧双键具有较强的极性,使α-H具有一定的活性,能被卤素取代发生α-H的卤化。
三、醛
【实验3-7】在洁净的试管中加入1 mL 2% AgNO3溶液,然后边振荡边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
向A中滴加氨水,现象为先产生白色沉淀后变澄清,水浴加热一段时间后,试管内壁出现一层光亮的银镜。
实验现象:
实验探究 乙醛与银氨溶液的反应(银镜反应)
每mol醛基可生成2mol银:—CHO~2Ag
△
CH3CHO+ 2Ag(NH3)2OH CH3COONH4+H2O+2Ag↓+3NH3
三、醛
在试管里加入2 mL 10% NaOH溶液,加入5滴 5% CuSO4,溶液,得到新制的Cu(OH)2,振荡后加入0.5 mL乙醛溶液,加热。观察实验现象。
实验探究 乙醛与新制氢氧化铜溶液的反应
实验现象:
A中溶液出现蓝色絮状沉淀,
C中有砖红色沉淀产生。
三、醛
A中新制Cu(OH)2悬浊液的配置
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
C中乙醛与新制Cu(OH)2的反应
应用:检验醛基,医疗上检测尿糖;
CH3CHO+2Cu(OH)2+NaOH → CH3COONa+Cu2O↓+3H2O
实验探究 乙醛与新制氢氧化铜溶液的反应
三、醛
特征反应 银镜反应 与新制的Cu(OH)2反应
现象 产生光亮的银镜 产生砖红色沉淀
注意 事项 (1)试管内壁必须洁净。 (2)银氨溶液随用随配,不可久置。 (3)水浴加热,不可用酒精灯直接加热。 (4)醛用量不宜太多,如乙醛一般滴3滴。 (5)银镜可用稀硝酸浸泡洗涤除去 (1)新制的Cu(OH)2要随用
随配,不可久置。
(2)配制新制的Cu(OH)2时,
所用NaOH溶液必须过量
小结:醛类的两个特征反应及—CHO的检验
三、醛
加成反应
氧化反应
催化氧化
被弱氧化剂氧化
燃烧
CO2、H2O
银镜反应
Cu(OH)2
能使高锰酸钾溶液、溴水褪色
醛+H2→醇(还原反应)
醛+HCN→羟基腈
乙醛的化学性质
三、醛
甲醛
特殊点:
甲醛中相当于有2个-CHO可被氧化。
写出甲醛分别与银氨溶液、新制氢氧化铜溶液的反应方程式。
△
HCHO+4[Ag(NH3)2]OH 4Ag↓+(NH4)2CO3+6NH3+2H2O
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+Na2CO3+6H2O
△
甲醛其结构相当于两个醛基,1mol HCHO ~ 4Ag~2molCu2O
缩聚反应:
→甲醛的水溶液(福尔马林)可用于消毒和浸制标本
四、酮
丙酮的化学性质
不能被银氨溶液、新制的Cu(OH)2等弱氧化剂氧化,但在催化剂存在的条件下,能催化加氢生成醇,也能与氰化氢加成。
反应的化学方程式:
+H2
催化剂
△
+HCN
催化剂
△
五、羧酸
1. 酸性
RCOOH
RCOO-+H+
反应 现象与化学方程式
与酸碱指示剂
与碱
与碱性氧化物
与活泼金属
与某些盐溶液
羧酸的酸性比碳酸强
羧酸能使紫色石蕊溶液变红
RCOOH+NaOH→RCOONa+H2O
CuO+2RCOOH→(RCOO)2Cu+H2O
2RCOOH+2Na→2RCOONa+H2↑
2RCOOH+Na2CO3→2RCOONa+CO2↑+H2O
RCOOH+NaHCO3→RCOONa+CO2↑+H2O
1、随着分子中碳原子数的增加,羧酸的酸性逐渐减弱。高级脂肪酸不一定能使酸碱指示剂变色。
2、随着羧基数目的增加,羧酸的酸性逐渐增强。乙二酸>乙酸。
羧酸的酸性规律:
问:下列常见物质酸性强弱比较:苯酚、甲酸、乙酸、乙二酸、碳酸、丙酸。
乙二酸>甲酸>乙酸>丙酸>碳酸>苯酚
五、羧酸
五、羧酸
含羟基的物质 醇 水 酚 低级羧酸
羟基上氢原 子活泼性 在水溶液中 电离程度 极难电离 难电离 微弱电离 部分
电离
酸碱性 中性 中性 很弱的酸性 弱酸性
五、羧酸
含羟基的物质 醇 水 酚 低级羧酸
与Na反应 反应放出H2 反应放出H2 反应放出H2 反应放出H2
与NaOH反应 不反应 不反应 反应 反应
与NaHCO3反应 不反应 水解 不反应 反应放出CO2
与Na2CO3反应 不反应 水解 反应生成NaHCO3 反应放出CO2
五、羧酸
2. 酯化反应
饱和碳酸钠溶液的液面上有无色透明的油状液体生成,且能闻到香味。
乙酸乙酯
同位素示踪法
酸脱羟基醇脱氢
酯化反应实验注意事项
导管在饱和Na2CO3液面上:防倒吸
长导管作用:
导气兼冷凝
加物顺序:
乙醇→浓硫酸→乙酸
饱和Na2CO3作用:
①溶解乙醇;
②中和乙酸;
③降低乙酸乙酯的溶解度,利于酯的析出
浓硫酸作用:
催化剂、吸水剂
沸点:
乙酸乙酯(77.1)
乙醇(78.3 ℃ )
乙酸(118℃)
小心加热:
减少乙酸、乙醇的挥发。
加热:
加快反应速率,蒸出乙酸乙酯,提高乙酸转化率。
分离碳酸钠和乙酸乙酯:
分液
五、羧酸
3. 缩聚反应
有机化合物分子间脱去小分子获得高分子化合物的反应。
加聚反应 缩聚反应
单体特征
单体种类
聚合方式
聚合物特征
产物
含不饱和键或环
一般含有两个官能团
含碳碳双键或碳碳三键
酚、醛、醇、羧酸、氨基酸等
通过不饱和键或开环加成
通过官能团缩合脱去小分子而连接
聚合物链节和单体具有相同的化学组成
聚合物链节和单体具有不同的化学组成
聚合物
聚合物和小分子
加聚反应和缩聚反应的比较
4. 还原反应
RCOOH RCH2OH
LiAlH4
与醛和酮相比,羧基中的羧基较难与H2加成而被还原,只有强还原剂LiAlH4等才能将羧酸还原。
五、羧酸
六、酯
酸性水解
碱性水解
C
O
R’
R
O
RCOOR’+NaOH RCOONa+R’OH
RCOOR’+H2O RCOOH+R’OH
浓硫酸
注意:酯在无机酸、碱催化下,均能发生水解反应,其中在酸性条件下水解是可逆的,在碱性条件下水解是不可逆的。
