专题5 药物合成的重要原料——卤代烃、胺、酰胺 课件(共15张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修3
文档属性
| 名称 | 专题5 药物合成的重要原料——卤代烃、胺、酰胺 课件(共15张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 793.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-01 22:58:15 | ||
图片预览



文档简介
(共15张PPT)
专题复习
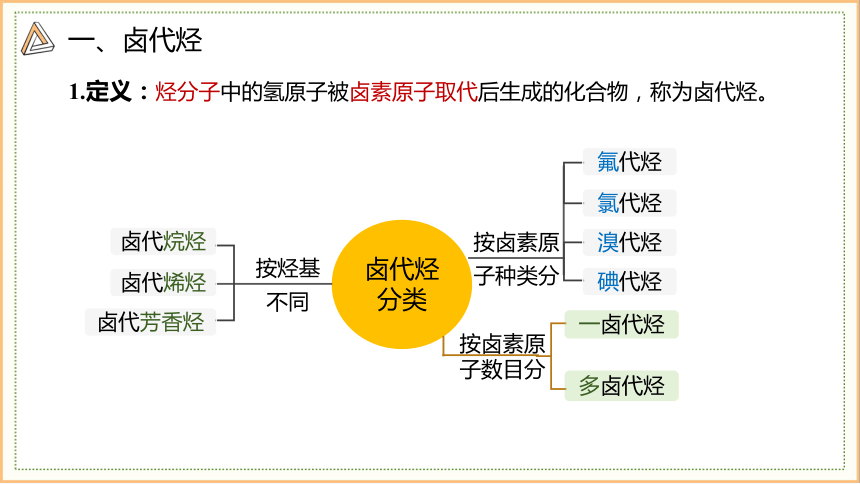
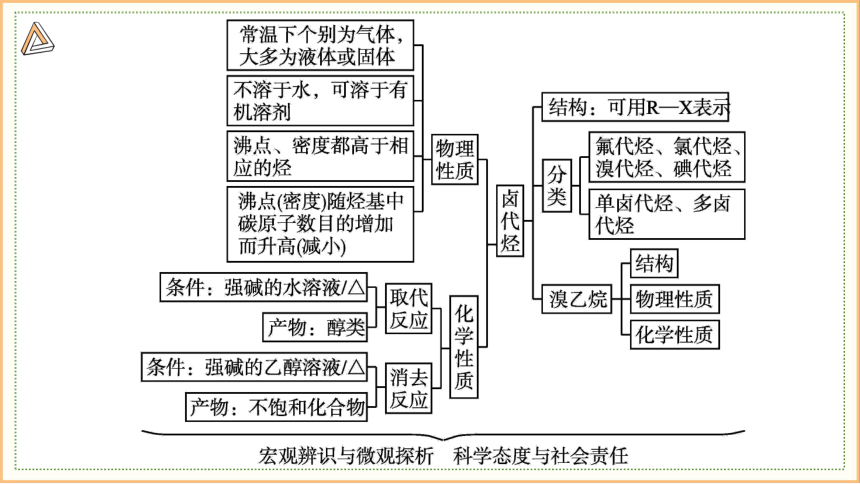
一、卤代烃
1.定义:烃分子中的氢原子被卤素原子取代后生成的化合物,称为卤代烃。
卤代烃
分类
按卤素原
子数目分
一卤代烃
多卤代烃
按卤素原
子种类分
氟代烃
氯代烃
溴代烃
碘代烃
按烃基
不同
卤代烷烃
卤代烯烃
卤代芳香烃
2.物理性质:
状态:常温下除一氯甲烷、氯乙烯、氯乙烷是气体外,大多数为液体或固体。
熔沸点:大于同碳个数的烃,随碳原子数增多,沸点依次升高
(碳原子数相同时,支链越多沸点越低;卤原子越多沸点越高)。
密度:除脂肪烃的一氟代物和一氯代物外,其余卤代烃密度都比水大。
一般随着烃基中碳原子数目的增加而减小。
溶解性:不溶于水,可溶于有机溶剂,某些卤代烃本身就是有机溶剂
一、卤代烃
一、卤代烃
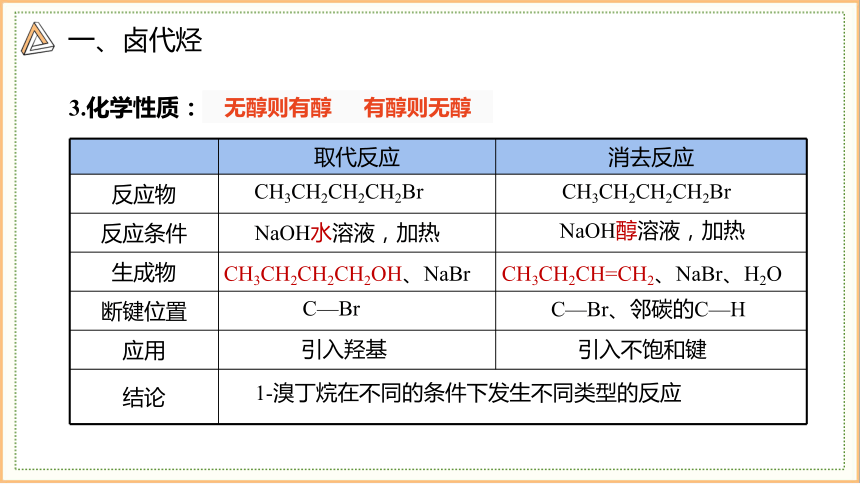
3.化学性质:
无醇则有醇 有醇则无醇
取代反应 消去反应
反应物
反应条件
生成物
断键位置
应用
结论
CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
NaOH水溶液,加热
NaOH醇溶液,加热
CH3CH2CH2CH2OH、NaBr
CH3CH2CH=CH2、NaBr、H2O
1-溴丁烷在不同的条件下发生不同类型的反应
C—Br
C—Br、邻碳的C—H
引入羟基
引入不饱和键
二、胺
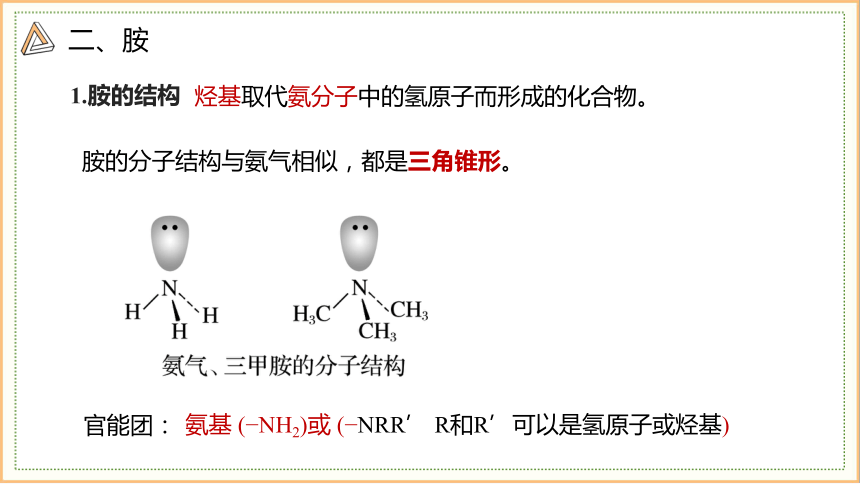
1.胺的结构
官能团:
氨基 ( NH2)或 ( NRR’ R和R’可以是氢原子或烃基)
烃基取代氨分子中的氢原子而形成的化合物。
胺的分子结构与氨气相似,都是三角锥形。
二、胺
2.胺的物理性质
胺的沸点比相对分子质量相近的烃高,但比醇和羧酸的沸点低。
低级脂肪胺,如甲胺、二甲胺和三甲胺等,在常温下是气体,丙胺以上是液体,十二胺以上为固体。
芳香胺是无色高沸点的液体或低熔点的固体,并有毒性。
状态
水溶性
胺都能与水分子形成氢键,低级的伯、仲、叔胺都有较好的水溶性。
随着碳原子数增加,胺的水溶性逐渐下降。6个碳以上的胺就难溶于水
3.化学性质:胺类化合物与NH3类似,具有碱性,能与盐酸、醋酸反应生成有机铵盐。
如苯胺能与盐酸反应,生成可溶于水的苯胺盐酸盐。
+HCl―→
苯胺 苯胺盐酸盐
4.用途:重要的化工原料,如甲胺和苯胺都是合成医药、农药和染料等的重要原料。
二、胺
三、酰胺
1.酰胺的概念:
结构通式与官能团:
羧酸分子中羟基被氨基所替代得到的化合物。
R—C—NH2
=
O
酰胺基
酰基
2.物理性质
通常甲酰胺为液体,其它酰胺多为无色晶体,因为酰胺分子之间能形成氢键,其熔、沸点一般较高。
—NH2和—CONH2都是亲水基团,都与水分子间能形成氢键,故低级胺、酰胺都能溶于水。
低级酰胺易溶于水,随碳原子数增加,酰胺的溶解度逐渐减小。
三、酰胺
三、酰胺
3.酰胺的化学性质
酰胺在酸或碱存在并加热的条件下可以发生水解反应。
如RCONH2与盐酸和氢氧化钠的反应:
①与HCl溶液反应:
②与NaOH溶液反应:
水解时加入碱,生成的酸就会变成盐,同时有氨气逸出。
△
RCONH2+H2O+HCl RCOOH+NH4Cl
RCONH2+NaOH RCOONa+NH3↑
△
四、有机合成设计
烃的衍生物之间的转化关系
四、有机合成设计
引入的官能团 应用的反应
—OH ①碳碳双键与H2O加成: +H2O
②卤代烃的水解:R—X+H2O
③醛、酮的还原:R—CHO+H2、RCOR′+H2
④酯的水解:R—COOR′+H2O
—X ①烷烃(烷基)光照下的卤代
②烯(炔)烃与X2或HX的加成
③醇与HX的取代:R—OH+HX
四、有机合成设计
引入的官能团 应用的反应
①醇的消去、卤代烃的消去
②炔烃与H2的不完全加成
—CHO ①伯醇的催化氧化:—CH2OH+O2
②烯烃氧化 ③糖类水解(得到葡萄糖)
—COOH ①醛基的氧化:R—CHO+O2
②苯的同系物被强氧化剂氧化
③羧酸盐酸化 ④酯的水解:R—COOR′+H2O
—COO— 酯化反应
四、有机合成设计
设计有机合成路线的常规方法
正合成分析法 设计有机合成路线时,从确定的某种原料分子开始,逐步经过碳链的连接和官能团的引入来完成,基本思维模式:原料―→合成①―→合成②……―→目标产物
逆合成分析法 此法采用逆向思维方法,从目标化合物的组成、结构和性质入手,找出合成所需的直接或间接的中间产物,逐步推向已知原料,其思维程序:产品―→中间产物―→原料
综合推理法 设计有机合成路线时,用正合成分析法不能得到目标产物,而用逆合成分析法也得不到起始原料,往往结合这两种思维方式采用两边向中间“挤压”的方式,可使问题顺利解决
专题复习
一、卤代烃
1.定义:烃分子中的氢原子被卤素原子取代后生成的化合物,称为卤代烃。
卤代烃
分类
按卤素原
子数目分
一卤代烃
多卤代烃
按卤素原
子种类分
氟代烃
氯代烃
溴代烃
碘代烃
按烃基
不同
卤代烷烃
卤代烯烃
卤代芳香烃
2.物理性质:
状态:常温下除一氯甲烷、氯乙烯、氯乙烷是气体外,大多数为液体或固体。
熔沸点:大于同碳个数的烃,随碳原子数增多,沸点依次升高
(碳原子数相同时,支链越多沸点越低;卤原子越多沸点越高)。
密度:除脂肪烃的一氟代物和一氯代物外,其余卤代烃密度都比水大。
一般随着烃基中碳原子数目的增加而减小。
溶解性:不溶于水,可溶于有机溶剂,某些卤代烃本身就是有机溶剂
一、卤代烃
一、卤代烃
3.化学性质:
无醇则有醇 有醇则无醇
取代反应 消去反应
反应物
反应条件
生成物
断键位置
应用
结论
CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
NaOH水溶液,加热
NaOH醇溶液,加热
CH3CH2CH2CH2OH、NaBr
CH3CH2CH=CH2、NaBr、H2O
1-溴丁烷在不同的条件下发生不同类型的反应
C—Br
C—Br、邻碳的C—H
引入羟基
引入不饱和键
二、胺
1.胺的结构
官能团:
氨基 ( NH2)或 ( NRR’ R和R’可以是氢原子或烃基)
烃基取代氨分子中的氢原子而形成的化合物。
胺的分子结构与氨气相似,都是三角锥形。
二、胺
2.胺的物理性质
胺的沸点比相对分子质量相近的烃高,但比醇和羧酸的沸点低。
低级脂肪胺,如甲胺、二甲胺和三甲胺等,在常温下是气体,丙胺以上是液体,十二胺以上为固体。
芳香胺是无色高沸点的液体或低熔点的固体,并有毒性。
状态
水溶性
胺都能与水分子形成氢键,低级的伯、仲、叔胺都有较好的水溶性。
随着碳原子数增加,胺的水溶性逐渐下降。6个碳以上的胺就难溶于水
3.化学性质:胺类化合物与NH3类似,具有碱性,能与盐酸、醋酸反应生成有机铵盐。
如苯胺能与盐酸反应,生成可溶于水的苯胺盐酸盐。
+HCl―→
苯胺 苯胺盐酸盐
4.用途:重要的化工原料,如甲胺和苯胺都是合成医药、农药和染料等的重要原料。
二、胺
三、酰胺
1.酰胺的概念:
结构通式与官能团:
羧酸分子中羟基被氨基所替代得到的化合物。
R—C—NH2
=
O
酰胺基
酰基
2.物理性质
通常甲酰胺为液体,其它酰胺多为无色晶体,因为酰胺分子之间能形成氢键,其熔、沸点一般较高。
—NH2和—CONH2都是亲水基团,都与水分子间能形成氢键,故低级胺、酰胺都能溶于水。
低级酰胺易溶于水,随碳原子数增加,酰胺的溶解度逐渐减小。
三、酰胺
三、酰胺
3.酰胺的化学性质
酰胺在酸或碱存在并加热的条件下可以发生水解反应。
如RCONH2与盐酸和氢氧化钠的反应:
①与HCl溶液反应:
②与NaOH溶液反应:
水解时加入碱,生成的酸就会变成盐,同时有氨气逸出。
△
RCONH2+H2O+HCl RCOOH+NH4Cl
RCONH2+NaOH RCOONa+NH3↑
△
四、有机合成设计
烃的衍生物之间的转化关系
四、有机合成设计
引入的官能团 应用的反应
—OH ①碳碳双键与H2O加成: +H2O
②卤代烃的水解:R—X+H2O
③醛、酮的还原:R—CHO+H2、RCOR′+H2
④酯的水解:R—COOR′+H2O
—X ①烷烃(烷基)光照下的卤代
②烯(炔)烃与X2或HX的加成
③醇与HX的取代:R—OH+HX
四、有机合成设计
引入的官能团 应用的反应
①醇的消去、卤代烃的消去
②炔烃与H2的不完全加成
—CHO ①伯醇的催化氧化:—CH2OH+O2
②烯烃氧化 ③糖类水解(得到葡萄糖)
—COOH ①醛基的氧化:R—CHO+O2
②苯的同系物被强氧化剂氧化
③羧酸盐酸化 ④酯的水解:R—COOR′+H2O
—COO— 酯化反应
四、有机合成设计
设计有机合成路线的常规方法
正合成分析法 设计有机合成路线时,从确定的某种原料分子开始,逐步经过碳链的连接和官能团的引入来完成,基本思维模式:原料―→合成①―→合成②……―→目标产物
逆合成分析法 此法采用逆向思维方法,从目标化合物的组成、结构和性质入手,找出合成所需的直接或间接的中间产物,逐步推向已知原料,其思维程序:产品―→中间产物―→原料
综合推理法 设计有机合成路线时,用正合成分析法不能得到目标产物,而用逆合成分析法也得不到起始原料,往往结合这两种思维方式采用两边向中间“挤压”的方式,可使问题顺利解决
