5.1 卤代烃 课件(共30张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修3
文档属性
| 名称 | 5.1 卤代烃 课件(共30张PPT) 2024-2025学年高二化学苏教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 51.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-02 00:02:23 | ||
图片预览










文档简介
(共30张PPT)
卤代烃
1.通过实验探究简单卤代烃的主要化学性质,并能从结构角度进行解释;
2.能举例说明卤代烃在有机合成中的重要作用;
3.能从绿色化学的视角认识卤代烃在生产、生活中的合理应用,以及对人类社会可持续发展的影响。
运动场上的“化学大夫”
液态的氯乙烷汽化时大量吸热,具有冷冻麻醉作用(沸点12.27℃),可在身体局部产生快速镇痛效果。因此常用氯乙烷与其他药物制成“复方氯乙烷喷雾剂”,用于运动中的急性损伤,如肌肉拉伤,关节扭伤等的阵痛。
一、卤代烃
1.定义:烃分子中的氢原子被卤素原子取代后生成的化合物,称为卤代烃。
卤代烃
分类
按卤素原
子数目分
一卤代烃
多卤代烃
按卤素原
子种类分
氟代烃
氯代烃
溴代烃
碘代烃
按烃基
不同
卤代烷烃
卤代烯烃
卤代芳香烃
一、卤代烃
2.物理性质:
状态:常温下除一氯甲烷、氯乙烯、氯乙烷是气体外,大多数为液体或固体。
熔沸点:大于同碳个数的烃,随碳原子数增多,沸点依次升高
(碳原子数相同时,支链越多沸点越低;卤原子越多沸点越高)。
密度:除脂肪烃的一氟代物和一氯代物外,其余卤代烃密度都比水大。
一般随着烃基中碳原子数目的增加而减小。
溶解性:不溶于水,可溶于有机溶剂,某些卤代烃本身就是有机溶剂
卤代烃的危害
卤代烃的用途
氟利昂,有CCl3F、CCl2F2等,对臭氧层的破坏作用。
一、卤代烃
下列关于卤代烃的说法错误的是( )
A.常温下,卤代烃中除个别是气体外,大多是液体或固体
B.某些卤代烃可用作有机溶剂
C.一氯代烃的密度一般随着烃基中碳原子数的增加而增大
D.一氯代烃的沸点一般随着烃基中碳原子数的增加而升高
C
结 构 决 定 性 质
化学键 C-H C-C C-Br
键长/pm 110 154 194
键能/(kJ/mol) 414.2 347.3 284.5
在卤代烃分子中,由于卤素原子的电负性比碳原子的大,使C-X的电子向卤素原子偏移,进而使碳原子带部分正电荷(δ+),卤素原子带部分负电荷(δ-),这样就形成一个极性较强的共价键:Cδ+—Xδ-。因此,卤代烃在化学反应中,C—X较易断裂,使卤素原子被其他原子或原子团所取代,生成负离子而离去。
溴丙烷的结构特点
CH3—CH2—CH2—Br
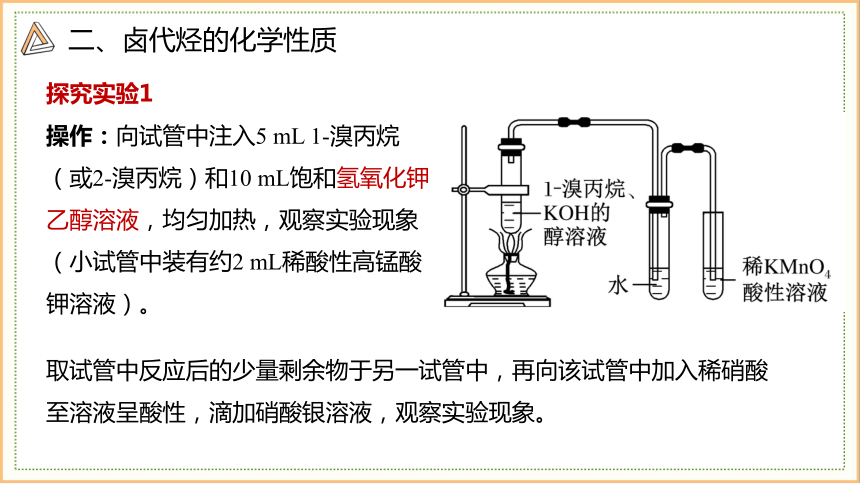
操作:向试管中注入5 mL 1-溴丙烷(或2-溴丙烷)和10 mL饱和氢氧化钾乙醇溶液,均匀加热,观察实验现象(小试管中装有约2 mL稀酸性高锰酸钾溶液)。
探究实验1
取试管中反应后的少量剩余物于另一试管中,再向该试管中加入稀硝酸至溶液呈酸性,滴加硝酸银溶液,观察实验现象。
二、卤代烃的化学性质
二、卤代烃的化学性质
实验现象
反应产生的气体经水洗后,使酸性KMnO4溶液褪色。
实验结论
生成的气体分子中含有碳碳不饱和键
探究实验1
二、卤代烃的化学性质
CH3CH2=CH2 ↑+KBr+H2O
△
乙醇
CH3-CH2-CH2
Br
H
+KOH
①反应条件:KOH的醇溶液、加热
②实质:相邻的两个C上脱去HX形成不饱和键!
反应原理
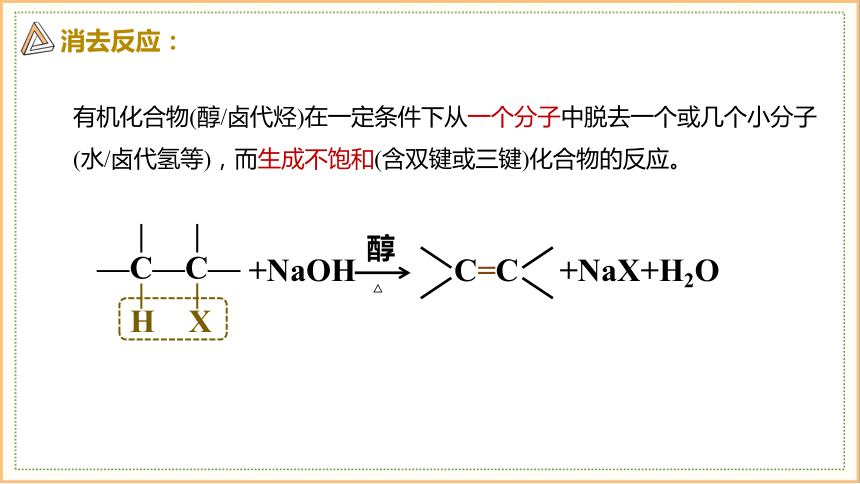
消去反应:
有机化合物(醇/卤代烃)在一定条件下从一个分子中脱去一个或几个小分子(水/卤代氢等),而生成不饱和(含双键或三键)化合物的反应。
+NaOH
—C—C—
H
X
△
醇
C=C
+NaX+H2O
下列卤代烃能否发生消去反应?
①CH3I
CH2Br
③
Br
CH3CH CHCH3
Br
⑤
Br
⑥
CH3 C CH2Br
CH3
CH3
②
CH3CHBr2
④
总结:发生消去反应的规律:
a 、必须有相邻的碳,否则不能发生消去反应,如①CH3I。
b、邻位碳原子上必须有氢原子,否则不能发生消去反应,如②③。
c、直接连接在苯环上的卤原子不能消去,如⑥。
邻C有H
消去反应:
消去反应:
卤代烃有两个邻位碳原子,且碳原子上均有氢原子时,消去反应怎样发生?
可能生成不同的产物。
例如 发生消去反应的产物为:
CH3-CH=CH-CH3
CH3-CH2-CH=CH2
★札依采夫规则
卤代烃发生消去反应时,消除的氢原子主要来自含氢原子较少的相邻碳原子上。
“氢少消氢”
为主
二、卤代烃的化学性质
二元卤代烃发生消去反应后可能在有机物中引入碳碳三键。
二元卤代烃发生消去反应后也可能在有机物中引入两个碳碳双键。
(1)
(2)
二、卤代烃的化学性质
探究实验2
向试管中注入5 mL 1-溴丙烷(或2-溴丙烷)和10 mL 20%的氢氧化钾水溶液,加热,观察实验现象。
取试管中反应后的少量剩余物于另一试管中,再向该试管中加入稀硝酸至溶液呈酸性,滴加硝酸银溶液,观察实验现象。
现象:
①中溶液分层②中有机层厚度减小,直至消失④中有浅黄色沉淀生成
结论:
2 溴丙烷与KOH溶液共热产生了Br-
二、卤代烃的化学性质
探究实验2
二、卤代烃的化学性质
KBr+AgNO3===AgBr↓+KNO3
淡黄色沉淀
H2O
?
CH3CH2CH2—Br + H—OH——
HBr+ CH3CH2CH2-OH
取代反应(水解反应)
KOH +HBr===KBr+H2O
反应规律:羟基(-OH)代替了溴乙烷分子上的溴原子,生成了
乙醇和溴化氢(与氢氧化钠溶液反应生成了溴化钠)。
二、卤代烃的化学性质
如何检验卤代烃中所含有的卤素原子?
R-X
NaOH水溶液
△
稀HNO3
AgNO3溶液
淡黄色沉淀(AgBr)
取上层清液
黄色沉淀(AgI)
白色沉淀(AgCl)
答题模板:待溶液分层后,用滴管吸取少量上层清液,移入另一盛稀硝酸的试管中,然后滴入2~3滴硝酸银溶液,如有淡黄色沉淀出现,则证明含有溴离子。
无醇则有醇 有醇则无醇
取代反应 消去反应
反应物
反应条件
生成物
断键位置
应用
结论
CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
NaOH水溶液,加热
NaOH醇溶液,加热
CH3CH2CH2CH2OH、NaBr
CH3CH2CH=CH2、NaBr、H2O
1-溴丁烷在不同的条件下发生不同类型的反应
C—Br
C—Br、邻碳的C—H
引入羟基
引入不饱和键
卤代烃是有机化合物转化及有机合成的重要桥梁
卤代烃通过取代反应和消去反应可以完成
官能团的引入,改变官能团的位置及数目。
二、卤代烃的化学性质
格氏试剂在有机合成中的应用
二、卤代烃的化学性质
在有机合成中引入卤素原子的方法
主要:不饱和烃与卤素单质、卤化氢等的加成反应
如CH3—CH===CH2+Br2―→CH3CHBrCH2Br。
在有机合成中引入卤素原子或引入卤素原子作中间产物,用加成反应而不用取代反应,是因为光照下取代反应产物无法控制,得到的产品纯度低。
二、卤代烃的化学性质
应用举例
(1)在烃分子中引入羟基,如由乙烯制乙二醇:
(2)在特定碳原子上引入卤原子,如由1-溴丙烷制取1,2-二溴丙烷:
二、卤代烃的化学性质
(3)改变某些官能团的位置
例如由1-丁烯制取2-丁烯:
二、卤代烃的化学性质
(4)增长碳链或构成碳环
例如卤代烃能与多种金属作用,生成金属有机化合物,其中格氏试剂是金属有机化合物中最重要的一类化合物,是有机合成中非常重要的试剂之一,它是卤代烃在乙醚的存在下与金属镁作用,生成的有机镁化合物,再与活泼的卤代烃反应,生成更长碳链的烃。
1.以氯乙烷为原料制取乙二酸(HOOC—COOH)的过程中,要依次经过下列步骤中的( )
①与NaOH的水溶液共热;②与NaOH的醇溶液共热;③与浓硫酸共热到170 ℃;④在催化剂存在的情况下与氯气反应;⑤在Cu或Ag存在的情况下与氧气共热;⑥与新制的Cu(OH)2共热;⑦用稀H2SO4酸化
A.①③④②⑥⑦ B.①③④②⑤
C.②④①⑤⑥⑦ D.②④①⑥⑤
C
2.由2-氯丙烷制取少量1-丙醇( )时,需要经过下列哪几步反应( )
A.加成反应→消去反应→取代反应
B.消去反应→加成反应→消去反应
C.消去反应→加成反应→取代反应
D.取代反应→消去反应→加成反应
C
3.某卤代烷烃C5H11Cl发生消去反应时,可以得到两种烯烃,则符合该条件的卤代烷烃的结构可能有( )
A.2种 B.3种
C.4种 D.5种
B
卤代烃
1.通过实验探究简单卤代烃的主要化学性质,并能从结构角度进行解释;
2.能举例说明卤代烃在有机合成中的重要作用;
3.能从绿色化学的视角认识卤代烃在生产、生活中的合理应用,以及对人类社会可持续发展的影响。
运动场上的“化学大夫”
液态的氯乙烷汽化时大量吸热,具有冷冻麻醉作用(沸点12.27℃),可在身体局部产生快速镇痛效果。因此常用氯乙烷与其他药物制成“复方氯乙烷喷雾剂”,用于运动中的急性损伤,如肌肉拉伤,关节扭伤等的阵痛。
一、卤代烃
1.定义:烃分子中的氢原子被卤素原子取代后生成的化合物,称为卤代烃。
卤代烃
分类
按卤素原
子数目分
一卤代烃
多卤代烃
按卤素原
子种类分
氟代烃
氯代烃
溴代烃
碘代烃
按烃基
不同
卤代烷烃
卤代烯烃
卤代芳香烃
一、卤代烃
2.物理性质:
状态:常温下除一氯甲烷、氯乙烯、氯乙烷是气体外,大多数为液体或固体。
熔沸点:大于同碳个数的烃,随碳原子数增多,沸点依次升高
(碳原子数相同时,支链越多沸点越低;卤原子越多沸点越高)。
密度:除脂肪烃的一氟代物和一氯代物外,其余卤代烃密度都比水大。
一般随着烃基中碳原子数目的增加而减小。
溶解性:不溶于水,可溶于有机溶剂,某些卤代烃本身就是有机溶剂
卤代烃的危害
卤代烃的用途
氟利昂,有CCl3F、CCl2F2等,对臭氧层的破坏作用。
一、卤代烃
下列关于卤代烃的说法错误的是( )
A.常温下,卤代烃中除个别是气体外,大多是液体或固体
B.某些卤代烃可用作有机溶剂
C.一氯代烃的密度一般随着烃基中碳原子数的增加而增大
D.一氯代烃的沸点一般随着烃基中碳原子数的增加而升高
C
结 构 决 定 性 质
化学键 C-H C-C C-Br
键长/pm 110 154 194
键能/(kJ/mol) 414.2 347.3 284.5
在卤代烃分子中,由于卤素原子的电负性比碳原子的大,使C-X的电子向卤素原子偏移,进而使碳原子带部分正电荷(δ+),卤素原子带部分负电荷(δ-),这样就形成一个极性较强的共价键:Cδ+—Xδ-。因此,卤代烃在化学反应中,C—X较易断裂,使卤素原子被其他原子或原子团所取代,生成负离子而离去。
溴丙烷的结构特点
CH3—CH2—CH2—Br
操作:向试管中注入5 mL 1-溴丙烷(或2-溴丙烷)和10 mL饱和氢氧化钾乙醇溶液,均匀加热,观察实验现象(小试管中装有约2 mL稀酸性高锰酸钾溶液)。
探究实验1
取试管中反应后的少量剩余物于另一试管中,再向该试管中加入稀硝酸至溶液呈酸性,滴加硝酸银溶液,观察实验现象。
二、卤代烃的化学性质
二、卤代烃的化学性质
实验现象
反应产生的气体经水洗后,使酸性KMnO4溶液褪色。
实验结论
生成的气体分子中含有碳碳不饱和键
探究实验1
二、卤代烃的化学性质
CH3CH2=CH2 ↑+KBr+H2O
△
乙醇
CH3-CH2-CH2
Br
H
+KOH
①反应条件:KOH的醇溶液、加热
②实质:相邻的两个C上脱去HX形成不饱和键!
反应原理
消去反应:
有机化合物(醇/卤代烃)在一定条件下从一个分子中脱去一个或几个小分子(水/卤代氢等),而生成不饱和(含双键或三键)化合物的反应。
+NaOH
—C—C—
H
X
△
醇
C=C
+NaX+H2O
下列卤代烃能否发生消去反应?
①CH3I
CH2Br
③
Br
CH3CH CHCH3
Br
⑤
Br
⑥
CH3 C CH2Br
CH3
CH3
②
CH3CHBr2
④
总结:发生消去反应的规律:
a 、必须有相邻的碳,否则不能发生消去反应,如①CH3I。
b、邻位碳原子上必须有氢原子,否则不能发生消去反应,如②③。
c、直接连接在苯环上的卤原子不能消去,如⑥。
邻C有H
消去反应:
消去反应:
卤代烃有两个邻位碳原子,且碳原子上均有氢原子时,消去反应怎样发生?
可能生成不同的产物。
例如 发生消去反应的产物为:
CH3-CH=CH-CH3
CH3-CH2-CH=CH2
★札依采夫规则
卤代烃发生消去反应时,消除的氢原子主要来自含氢原子较少的相邻碳原子上。
“氢少消氢”
为主
二、卤代烃的化学性质
二元卤代烃发生消去反应后可能在有机物中引入碳碳三键。
二元卤代烃发生消去反应后也可能在有机物中引入两个碳碳双键。
(1)
(2)
二、卤代烃的化学性质
探究实验2
向试管中注入5 mL 1-溴丙烷(或2-溴丙烷)和10 mL 20%的氢氧化钾水溶液,加热,观察实验现象。
取试管中反应后的少量剩余物于另一试管中,再向该试管中加入稀硝酸至溶液呈酸性,滴加硝酸银溶液,观察实验现象。
现象:
①中溶液分层②中有机层厚度减小,直至消失④中有浅黄色沉淀生成
结论:
2 溴丙烷与KOH溶液共热产生了Br-
二、卤代烃的化学性质
探究实验2
二、卤代烃的化学性质
KBr+AgNO3===AgBr↓+KNO3
淡黄色沉淀
H2O
?
CH3CH2CH2—Br + H—OH——
HBr+ CH3CH2CH2-OH
取代反应(水解反应)
KOH +HBr===KBr+H2O
反应规律:羟基(-OH)代替了溴乙烷分子上的溴原子,生成了
乙醇和溴化氢(与氢氧化钠溶液反应生成了溴化钠)。
二、卤代烃的化学性质
如何检验卤代烃中所含有的卤素原子?
R-X
NaOH水溶液
△
稀HNO3
AgNO3溶液
淡黄色沉淀(AgBr)
取上层清液
黄色沉淀(AgI)
白色沉淀(AgCl)
答题模板:待溶液分层后,用滴管吸取少量上层清液,移入另一盛稀硝酸的试管中,然后滴入2~3滴硝酸银溶液,如有淡黄色沉淀出现,则证明含有溴离子。
无醇则有醇 有醇则无醇
取代反应 消去反应
反应物
反应条件
生成物
断键位置
应用
结论
CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
NaOH水溶液,加热
NaOH醇溶液,加热
CH3CH2CH2CH2OH、NaBr
CH3CH2CH=CH2、NaBr、H2O
1-溴丁烷在不同的条件下发生不同类型的反应
C—Br
C—Br、邻碳的C—H
引入羟基
引入不饱和键
卤代烃是有机化合物转化及有机合成的重要桥梁
卤代烃通过取代反应和消去反应可以完成
官能团的引入,改变官能团的位置及数目。
二、卤代烃的化学性质
格氏试剂在有机合成中的应用
二、卤代烃的化学性质
在有机合成中引入卤素原子的方法
主要:不饱和烃与卤素单质、卤化氢等的加成反应
如CH3—CH===CH2+Br2―→CH3CHBrCH2Br。
在有机合成中引入卤素原子或引入卤素原子作中间产物,用加成反应而不用取代反应,是因为光照下取代反应产物无法控制,得到的产品纯度低。
二、卤代烃的化学性质
应用举例
(1)在烃分子中引入羟基,如由乙烯制乙二醇:
(2)在特定碳原子上引入卤原子,如由1-溴丙烷制取1,2-二溴丙烷:
二、卤代烃的化学性质
(3)改变某些官能团的位置
例如由1-丁烯制取2-丁烯:
二、卤代烃的化学性质
(4)增长碳链或构成碳环
例如卤代烃能与多种金属作用,生成金属有机化合物,其中格氏试剂是金属有机化合物中最重要的一类化合物,是有机合成中非常重要的试剂之一,它是卤代烃在乙醚的存在下与金属镁作用,生成的有机镁化合物,再与活泼的卤代烃反应,生成更长碳链的烃。
1.以氯乙烷为原料制取乙二酸(HOOC—COOH)的过程中,要依次经过下列步骤中的( )
①与NaOH的水溶液共热;②与NaOH的醇溶液共热;③与浓硫酸共热到170 ℃;④在催化剂存在的情况下与氯气反应;⑤在Cu或Ag存在的情况下与氧气共热;⑥与新制的Cu(OH)2共热;⑦用稀H2SO4酸化
A.①③④②⑥⑦ B.①③④②⑤
C.②④①⑤⑥⑦ D.②④①⑥⑤
C
2.由2-氯丙烷制取少量1-丙醇( )时,需要经过下列哪几步反应( )
A.加成反应→消去反应→取代反应
B.消去反应→加成反应→消去反应
C.消去反应→加成反应→取代反应
D.取代反应→消去反应→加成反应
C
3.某卤代烷烃C5H11Cl发生消去反应时,可以得到两种烯烃,则符合该条件的卤代烷烃的结构可能有( )
A.2种 B.3种
C.4种 D.5种
B
