2.1 课时1 有机反应的主要类型 课件 (共28张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 2.1 课时1 有机反应的主要类型 课件 (共28张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 105.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-02 08:08:07 | ||
图片预览





文档简介
(共28张PPT)
有机化学反应的主要类型
第2章 官能团与有机化学反应 烃的衍生物
1、认识加成反应,取代反应,消去反应,氧化反应,还原反应的特点和规律。
2、了解有机反应的类型和有机物组成结构特点的关系。
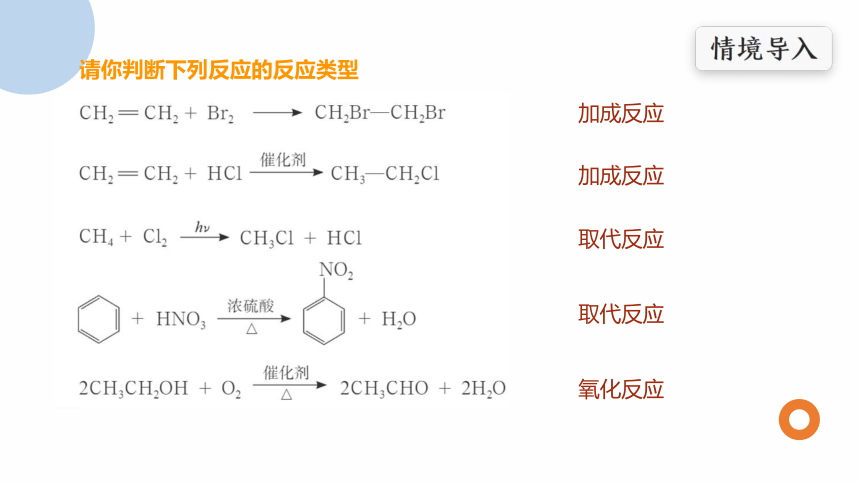
请你判断下列反应的反应类型
加成反应
加成反应
取代反应
取代反应
氧化反应
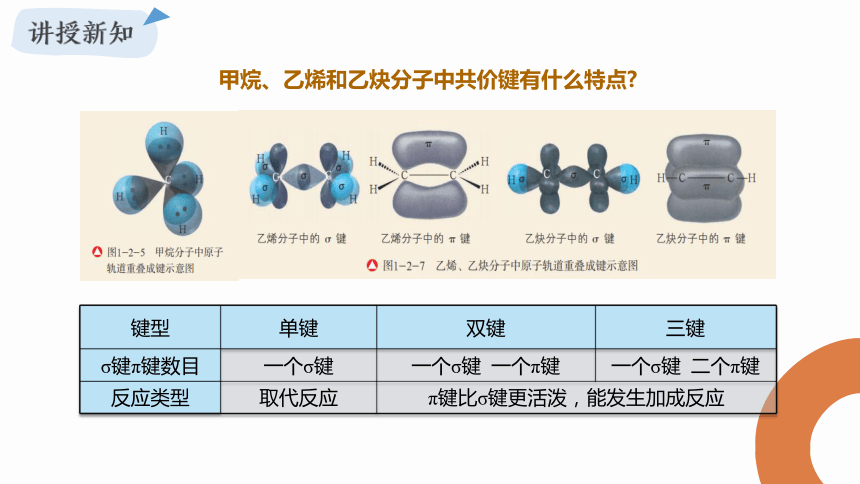
甲烷、乙烯和乙炔分子中共价键有什么特点
键型 单键 双键 三键
σ键π键数目 一个σ键 一个σ键 一个π键 一个σ键 二个π键
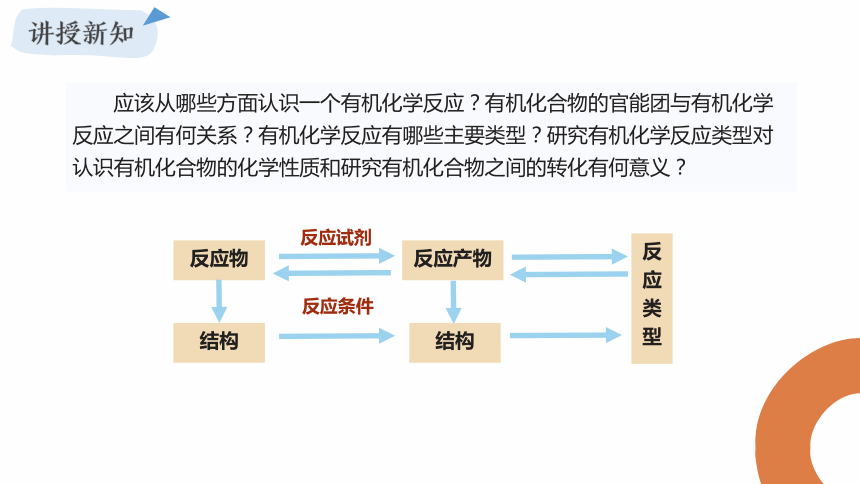
反应类型 取代反应 π键比σ键更活泼,能发生加成反应 应该从哪些方面认识一个有机化学反应?有机化合物的官能团与有机化学反应之间有何关系?有机化学反应有哪些主要类型?研究有机化学反应类型对认识有机化合物的化学性质和研究有机化合物之间的转化有何意义?
反应物
反应产物
反应类型
反应试剂
反应条件
结构
结构
一、加成反应
1.定义:有机化合物分子中的不饱和键两端的原子与其他原子或原子团相互结合,生成新的有机化合物(饱和或比较饱和)的反应。
2.能发生加成反应的分子的结构特征:分子中都含有不饱和键。
如:碳碳双键、碳碳三键、碳氧双键、苯环 等
3.能发生加成反应的试剂:氢气(H-H)、卤素单质(X-X)、氢卤酸(H-X)、水(H-OH )、氢氰酸(H-CN)等。
4.加成反应规律:不饱和键打开,结合原子或原子团形成新的化学键,有进无出,生成物只有一种,原子利用率100%
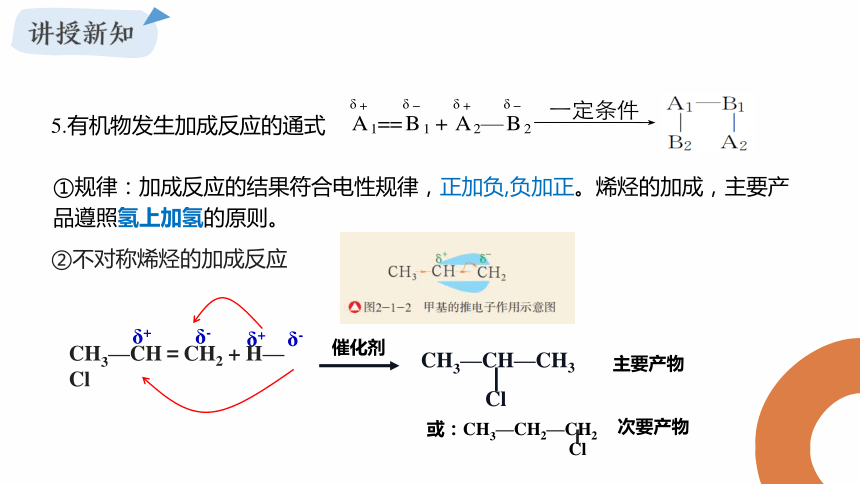
5.有机物发生加成反应的通式
①规律:加成反应的结果符合电性规律,正加负,负加正。烯烃的加成,主要产品遵照氢上加氢的原则。
②不对称烯烃的加成反应
δ-
δ+ δ-
δ+
催化剂
CH3—CH=CH2 + H—Cl
CH3—CH—CH3
Cl
主要产物
或:CH3—CH2—CH2
Cl
次要产物
6.与不饱和键发生加成反应的试剂对应关系
加成反应的结构 常见加成试剂
H2
H2、X2、H-X 、H-OH
H2、H-CN、氨(H—NH2)
H2、X2、H-X 、H-OH、H-CN、氨(H—NH2)
—C≡C—
—C≡N
二、取代反应
请判断下列反应是否属于取代反应,试从断键、成键的角度概括取代反应的规律。
共价键的极性与有机反应
基团之间的相互影响使官能团中化学键的极性发生变化
δ+
δ-
二、取代反应
1.定义:有机化合物分子中的某个(或某些)原子或原子团被其他原子或原子团代替的反应。
2.能发生取代反应的分子的结构特征:
①从化学键类型上分析,发生取代反应时断裂的是极性单键。有机化合物分子中有极性单键,就能发生取代反应。
δ+ δ-
δ+ δ-
②符合的电性规律:负取代负、正取代正
乙醇分子中带部分正电荷的乙基碳原子与溴化氢分子中带部分负电荷的溴原子结合生成 溴乙烷分子,而乙醇分子中带部分负电荷的羟基氧原子与溴化氢分子中带部分正电荷的氢原 子结合生成水分子。
电负性 H C O
2.1 2.5 3.5
成键原子电负性差 C—H O—H C—O
0.4 1.4 1.0
δ+
δ-
由于羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,也可断裂
③典型的取代反应
烷烃、芳香烃发生取代反应时主要是这些烃分子中的氢原子被其他原子或原子团取代。例如,甲苯分子中与苯环相连的氢原子可以被硝基(-NO2)取代。
二、取代反应
3.α-H的取代反应
①在含有官能团的有机化合物分子中,与官能团直接相连的碳原子称为α-C,其上的氢原子称为α-H;受官能团影响α-C上的碳氢键最容易断裂,发生取代反应。
②烯烃、炔烃、醛、酮、羧酸等分子中的烷基部分也可能 发生取代反应,其中与官能团直接相连的碳原子(α-C)上 的碳氢键最容易断裂而发生取代反应。
CH3-CH=CH2
CH3C≡CCH2CH3
CH3CH2OH
CH3CHO
α
α
α
α
α
4.成键结构(或官能团)与试剂
有机物或官能团 试剂 取代位置
饱和烃 X2 C—H上
苯环
—X(卤代烃)
—OH
—COOH
—COO—(酯)
烯、炔(α—H )
H2O、NH3、NaCN等
HX、RCOOH 等
—OH 等
H2O 等
X2 等
X2、HNO3、H2SO4等
C—H上
X原子上
-OH
羟基H上或-OH
C—O
α—H
5.取代反应的应用
取代反应在有机合成中具有重要的作用。例如,人们可以通过卤代烷的取代反应,将 有机化合物分子中的卤素原子转化为氨基等官能团,从而制得用途广泛的胺等有机化合物。
①官能团转化
CH3CH2Cl+NH3→
CH3CH2—NH2+HCl
CH3CH2Br+NaCN→
CH3CH2CN+NaBr
②增长碳链
利用乙醇的消去反应制备乙烯
在实验室中,乙烯是将乙醇和浓硫酸的混合物迅速加热至 170 ℃左右而制得的。
在圆底烧瓶中注入约 20 mL 乙醇与浓硫酸(体积比约 为 1∶3)的混合液,放入几块碎瓷片(避免混合液在受热 时暴沸)。加热混合液,使混合液温度迅速上升到 170 ℃, 这时就有乙烯生成。将温度维持在 170 ℃左右,用排水集 气法收集生成的乙烯。实验装置如图 2-1-3 所示。
请思考:实验中所发生的反应有何特点?
三、消去反应
1.乙醇制备乙烯
①产生气体:能使溴的CCl4溶液、酸性KMnO4溶液褪色
⑴实验现象
⑵实验原理
浓硫酸
170 ℃
CH2
H
CH2
OH
H2O
CH2
CH2↑
(分子内脱水)
注意事项
①乙醇与浓硫酸的体积比约为1∶3,浓硫酸的作用:
催化剂、脱水剂
②乙醇与浓硫酸的混合方法:
先在容器中加入乙醇,再沿器壁慢慢加入浓硫酸,边加边搅拌
③温度计的水银球位置:
插入反应混合溶液的液面下
④碎瓷片作用:
防止暴沸
⑤应使温度迅速升高到170 ℃:
防止在140 ℃时发生副反应,生成乙醚
CH3CH2O-H+HO-CH2CH3 CH3CH2OCH2CH3+H2O
140℃
浓H2SO4
乙醚
⑥在加热过程中,浓硫酸的颜色由无色逐渐变成棕色,甚至变成黑褐色。
C + 2H2SO4(浓) CO2↑ + 2SO2↑ + 2H2O
△
C2H5OH
C
浓硫酸
脱水性
由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。
三、消去反应
定义:有机化合物脱去小分子物质(如H2O、HBr等)生成的分子中有不饱和键的化合物的反应,叫做消去反应。
能够发生消去反应的有机物:分子中有羟基(醇)或卤素原子(卤代烃)的有机物等。
由醇脱去水制备烯烃时,常选用浓硫酸等试剂;
由卤代烷脱去氢卤酸制备烯烃时,常选 用 NaOH 的乙醇溶液等试剂。
【思考】所有的醇都可以发生分子内脱水发生消去反应吗?
浓硫酸
加热
C
H
C
OH
H2O
C
C
醇分子中,连有—OH的碳原子的相邻碳原子上必须连有氢原子时,才能发生消去反应而形成不饱和键
可以发生消去反应的物质:
在含有官能团的有机化合物分子中,与官能团直接相连的碳原子称为α-C,其上的氢原子称为α-H;与α-C相连的碳原子称为β-C,其上的氢原子称为β-H。β-C上有氢原子的醇或卤代烃可以发生消去反应
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。试回答下面问题。
(1)下图中①、②、③、④装置可盛放的试剂是:①___;②____;③____;④____(将下列有关试剂的序号填入空格内)。
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是_____________。
(3)使用装置②的目的是____________________________。
(4)使用装置③的目的是________________。
(5)确认含有乙烯的现象是__________________________________
A
B
A
D
①中品红褪色
除去SO2,以防止干拢乙烯的检验
检验SO2是否除尽
③品红不褪色 ④中的酸性高锰酸钾溶液褪色
请回忆乙醇催化氧化反应!
四、氧化还原反应
1.氧化反应:有机化合物分子中增加氧原子的,或减少氢原子的反应
C
H
H
C
2H
O
H
H
H
O2
Cu/Ag
C
H
H
C
2H
O
H
2H2O
氧化反应中反应中常见的氧化剂:氧气、酸性KMnO4溶液、臭氧、银氨溶液和新制氢氧化铜悬浊液等。
有机化学反应中常见的氧化反应
①醇的氧化生成醛、酮
②醛的氧化生成羧酸
③有机物的燃烧。
④苯的同系物使酸性KMnO4溶液褪色
⑤烯烃、炔烃、酚、醛等有机物使酸性KMnO4溶液褪色。
四、氧化还原反应
2.还原反应:将有机化合物分子中增加氢原子数目或减少氧原子数目的,反应称为还原反应。
⑴还原反应中反应中常见的还原剂:氢气、氢化铝锂(LiAlH4)和硼氢化钠(NaBH4)等。
⑵有机化学反应中常见的还原反应
烯、炔、苯及其同系物、醛、酮、酚、不饱和油脂等的催化加氢。
1.下列有机化合物的反应中,属于还原反应的是 (填序号,下同) ,属于氧化反应的是 。
①由乙醇制取乙醛 ②由乙醛制取乙醇
③由乙醛制乙酸 ④乙醇与酸性高锰酸钾溶液反应
⑤乙烯与氢气的加成 ⑥乙炔使酸性高锰酸钾溶液褪色
⑦苯与氢气反应生成环己烷 ⑧甲烷的燃烧反应
②⑤⑦
①③④⑥⑧
2.有关实验室制乙烯的说法不正确的是( )
A.温度计的水银球要伸入反应物的液面以下
B.反应过程中溶液的颜色逐渐变黑
C.生成的乙烯气体中混有少量有刺激性气味的气体
D.加热时不要太急,使温度缓慢上升至170 ℃
D
有机化学反应的主要类型
第2章 官能团与有机化学反应 烃的衍生物
1、认识加成反应,取代反应,消去反应,氧化反应,还原反应的特点和规律。
2、了解有机反应的类型和有机物组成结构特点的关系。
请你判断下列反应的反应类型
加成反应
加成反应
取代反应
取代反应
氧化反应
甲烷、乙烯和乙炔分子中共价键有什么特点
键型 单键 双键 三键
σ键π键数目 一个σ键 一个σ键 一个π键 一个σ键 二个π键
反应类型 取代反应 π键比σ键更活泼,能发生加成反应 应该从哪些方面认识一个有机化学反应?有机化合物的官能团与有机化学反应之间有何关系?有机化学反应有哪些主要类型?研究有机化学反应类型对认识有机化合物的化学性质和研究有机化合物之间的转化有何意义?
反应物
反应产物
反应类型
反应试剂
反应条件
结构
结构
一、加成反应
1.定义:有机化合物分子中的不饱和键两端的原子与其他原子或原子团相互结合,生成新的有机化合物(饱和或比较饱和)的反应。
2.能发生加成反应的分子的结构特征:分子中都含有不饱和键。
如:碳碳双键、碳碳三键、碳氧双键、苯环 等
3.能发生加成反应的试剂:氢气(H-H)、卤素单质(X-X)、氢卤酸(H-X)、水(H-OH )、氢氰酸(H-CN)等。
4.加成反应规律:不饱和键打开,结合原子或原子团形成新的化学键,有进无出,生成物只有一种,原子利用率100%
5.有机物发生加成反应的通式
①规律:加成反应的结果符合电性规律,正加负,负加正。烯烃的加成,主要产品遵照氢上加氢的原则。
②不对称烯烃的加成反应
δ-
δ+ δ-
δ+
催化剂
CH3—CH=CH2 + H—Cl
CH3—CH—CH3
Cl
主要产物
或:CH3—CH2—CH2
Cl
次要产物
6.与不饱和键发生加成反应的试剂对应关系
加成反应的结构 常见加成试剂
H2
H2、X2、H-X 、H-OH
H2、H-CN、氨(H—NH2)
H2、X2、H-X 、H-OH、H-CN、氨(H—NH2)
—C≡C—
—C≡N
二、取代反应
请判断下列反应是否属于取代反应,试从断键、成键的角度概括取代反应的规律。
共价键的极性与有机反应
基团之间的相互影响使官能团中化学键的极性发生变化
δ+
δ-
二、取代反应
1.定义:有机化合物分子中的某个(或某些)原子或原子团被其他原子或原子团代替的反应。
2.能发生取代反应的分子的结构特征:
①从化学键类型上分析,发生取代反应时断裂的是极性单键。有机化合物分子中有极性单键,就能发生取代反应。
δ+ δ-
δ+ δ-
②符合的电性规律:负取代负、正取代正
乙醇分子中带部分正电荷的乙基碳原子与溴化氢分子中带部分负电荷的溴原子结合生成 溴乙烷分子,而乙醇分子中带部分负电荷的羟基氧原子与溴化氢分子中带部分正电荷的氢原 子结合生成水分子。
电负性 H C O
2.1 2.5 3.5
成键原子电负性差 C—H O—H C—O
0.4 1.4 1.0
δ+
δ-
由于羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,也可断裂
③典型的取代反应
烷烃、芳香烃发生取代反应时主要是这些烃分子中的氢原子被其他原子或原子团取代。例如,甲苯分子中与苯环相连的氢原子可以被硝基(-NO2)取代。
二、取代反应
3.α-H的取代反应
①在含有官能团的有机化合物分子中,与官能团直接相连的碳原子称为α-C,其上的氢原子称为α-H;受官能团影响α-C上的碳氢键最容易断裂,发生取代反应。
②烯烃、炔烃、醛、酮、羧酸等分子中的烷基部分也可能 发生取代反应,其中与官能团直接相连的碳原子(α-C)上 的碳氢键最容易断裂而发生取代反应。
CH3-CH=CH2
CH3C≡CCH2CH3
CH3CH2OH
CH3CHO
α
α
α
α
α
4.成键结构(或官能团)与试剂
有机物或官能团 试剂 取代位置
饱和烃 X2 C—H上
苯环
—X(卤代烃)
—OH
—COOH
—COO—(酯)
烯、炔(α—H )
H2O、NH3、NaCN等
HX、RCOOH 等
—OH 等
H2O 等
X2 等
X2、HNO3、H2SO4等
C—H上
X原子上
-OH
羟基H上或-OH
C—O
α—H
5.取代反应的应用
取代反应在有机合成中具有重要的作用。例如,人们可以通过卤代烷的取代反应,将 有机化合物分子中的卤素原子转化为氨基等官能团,从而制得用途广泛的胺等有机化合物。
①官能团转化
CH3CH2Cl+NH3→
CH3CH2—NH2+HCl
CH3CH2Br+NaCN→
CH3CH2CN+NaBr
②增长碳链
利用乙醇的消去反应制备乙烯
在实验室中,乙烯是将乙醇和浓硫酸的混合物迅速加热至 170 ℃左右而制得的。
在圆底烧瓶中注入约 20 mL 乙醇与浓硫酸(体积比约 为 1∶3)的混合液,放入几块碎瓷片(避免混合液在受热 时暴沸)。加热混合液,使混合液温度迅速上升到 170 ℃, 这时就有乙烯生成。将温度维持在 170 ℃左右,用排水集 气法收集生成的乙烯。实验装置如图 2-1-3 所示。
请思考:实验中所发生的反应有何特点?
三、消去反应
1.乙醇制备乙烯
①产生气体:能使溴的CCl4溶液、酸性KMnO4溶液褪色
⑴实验现象
⑵实验原理
浓硫酸
170 ℃
CH2
H
CH2
OH
H2O
CH2
CH2↑
(分子内脱水)
注意事项
①乙醇与浓硫酸的体积比约为1∶3,浓硫酸的作用:
催化剂、脱水剂
②乙醇与浓硫酸的混合方法:
先在容器中加入乙醇,再沿器壁慢慢加入浓硫酸,边加边搅拌
③温度计的水银球位置:
插入反应混合溶液的液面下
④碎瓷片作用:
防止暴沸
⑤应使温度迅速升高到170 ℃:
防止在140 ℃时发生副反应,生成乙醚
CH3CH2O-H+HO-CH2CH3 CH3CH2OCH2CH3+H2O
140℃
浓H2SO4
乙醚
⑥在加热过程中,浓硫酸的颜色由无色逐渐变成棕色,甚至变成黑褐色。
C + 2H2SO4(浓) CO2↑ + 2SO2↑ + 2H2O
△
C2H5OH
C
浓硫酸
脱水性
由于无水酒精和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。
三、消去反应
定义:有机化合物脱去小分子物质(如H2O、HBr等)生成的分子中有不饱和键的化合物的反应,叫做消去反应。
能够发生消去反应的有机物:分子中有羟基(醇)或卤素原子(卤代烃)的有机物等。
由醇脱去水制备烯烃时,常选用浓硫酸等试剂;
由卤代烷脱去氢卤酸制备烯烃时,常选 用 NaOH 的乙醇溶液等试剂。
【思考】所有的醇都可以发生分子内脱水发生消去反应吗?
浓硫酸
加热
C
H
C
OH
H2O
C
C
醇分子中,连有—OH的碳原子的相邻碳原子上必须连有氢原子时,才能发生消去反应而形成不饱和键
可以发生消去反应的物质:
在含有官能团的有机化合物分子中,与官能团直接相连的碳原子称为α-C,其上的氢原子称为α-H;与α-C相连的碳原子称为β-C,其上的氢原子称为β-H。β-C上有氢原子的醇或卤代烃可以发生消去反应
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。试回答下面问题。
(1)下图中①、②、③、④装置可盛放的试剂是:①___;②____;③____;④____(将下列有关试剂的序号填入空格内)。
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是_____________。
(3)使用装置②的目的是____________________________。
(4)使用装置③的目的是________________。
(5)确认含有乙烯的现象是__________________________________
A
B
A
D
①中品红褪色
除去SO2,以防止干拢乙烯的检验
检验SO2是否除尽
③品红不褪色 ④中的酸性高锰酸钾溶液褪色
请回忆乙醇催化氧化反应!
四、氧化还原反应
1.氧化反应:有机化合物分子中增加氧原子的,或减少氢原子的反应
C
H
H
C
2H
O
H
H
H
O2
Cu/Ag
C
H
H
C
2H
O
H
2H2O
氧化反应中反应中常见的氧化剂:氧气、酸性KMnO4溶液、臭氧、银氨溶液和新制氢氧化铜悬浊液等。
有机化学反应中常见的氧化反应
①醇的氧化生成醛、酮
②醛的氧化生成羧酸
③有机物的燃烧。
④苯的同系物使酸性KMnO4溶液褪色
⑤烯烃、炔烃、酚、醛等有机物使酸性KMnO4溶液褪色。
四、氧化还原反应
2.还原反应:将有机化合物分子中增加氢原子数目或减少氧原子数目的,反应称为还原反应。
⑴还原反应中反应中常见的还原剂:氢气、氢化铝锂(LiAlH4)和硼氢化钠(NaBH4)等。
⑵有机化学反应中常见的还原反应
烯、炔、苯及其同系物、醛、酮、酚、不饱和油脂等的催化加氢。
1.下列有机化合物的反应中,属于还原反应的是 (填序号,下同) ,属于氧化反应的是 。
①由乙醇制取乙醛 ②由乙醛制取乙醇
③由乙醛制乙酸 ④乙醇与酸性高锰酸钾溶液反应
⑤乙烯与氢气的加成 ⑥乙炔使酸性高锰酸钾溶液褪色
⑦苯与氢气反应生成环己烷 ⑧甲烷的燃烧反应
②⑤⑦
①③④⑥⑧
2.有关实验室制乙烯的说法不正确的是( )
A.温度计的水银球要伸入反应物的液面以下
B.反应过程中溶液的颜色逐渐变黑
C.生成的乙烯气体中混有少量有刺激性气味的气体
D.加热时不要太急,使温度缓慢上升至170 ℃
D
