湖南省永州市祁阳市浯溪第三中学2024-2025学年下学期第一次月考九年级化学试卷(含答案)
文档属性
| 名称 | 湖南省永州市祁阳市浯溪第三中学2024-2025学年下学期第一次月考九年级化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 567.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-03 08:04:24 | ||
图片预览

文档简介
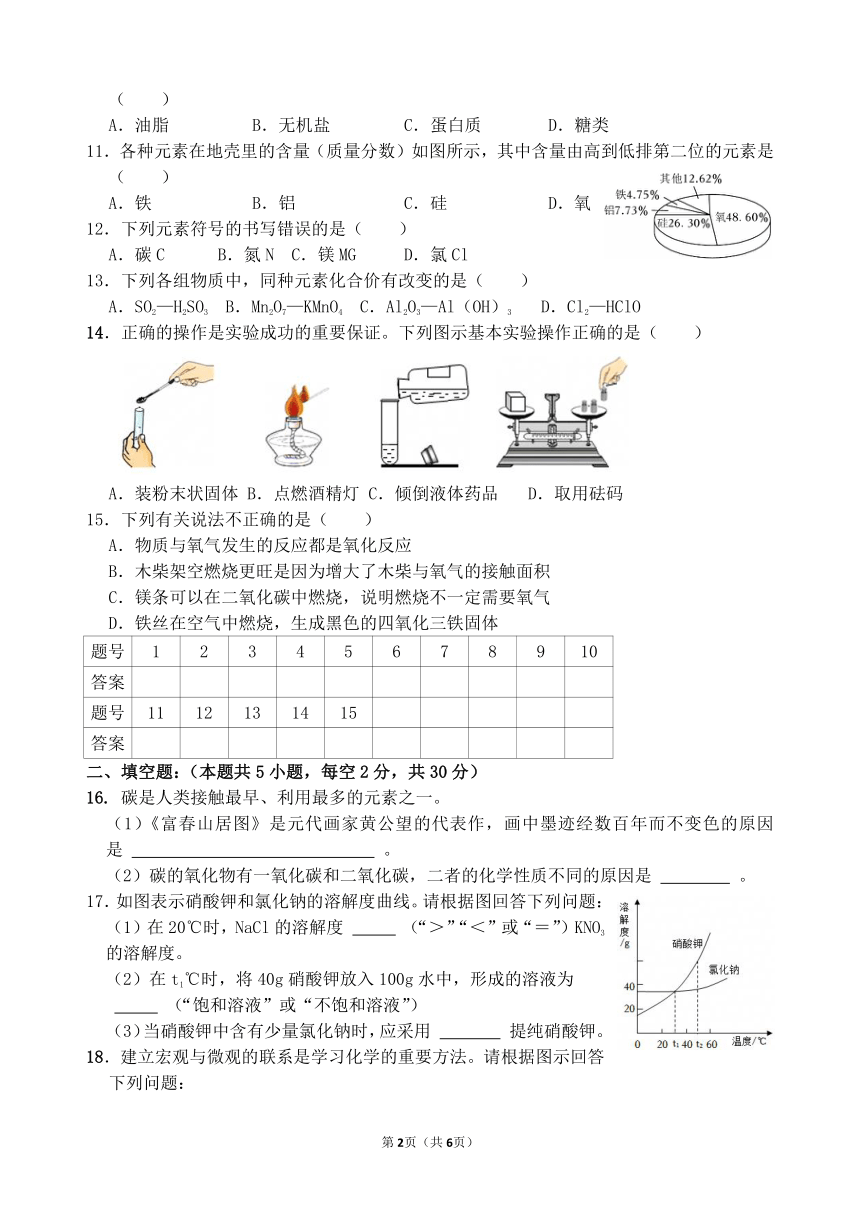
2024-2025学年下学期祁阳市浯溪三中九年级第一次月考化学试卷
考试时间:60分钟 总分:100分
一、选择题:(本题共15小题,每题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
1.下列变化属于化学变化的是( )
A.浓盐酸的试剂瓶口呈现白雾 B.氧气具有支持燃烧的性质
C.氢氧化钠固体吸水后潮解 D.纸张遇到浓硫酸后变成黑色
2.下列物质中含有氧气的是( )
A.蒸馏水 B.氯酸钾 C.空气 D.二氧化碳
3.下列发生装置中,可用于实验室加热高锰酸钾制取氧气的是( )
A. B. C. D.
4.习总书记在十九大报告中指出“必须树立和践行绿水青山就是金山银山的理念”。下列说法符合这一理念的是( )
A.将废弃塑料进行深土填埋 B.生活污水直接排放
C.大面积植树造林 D.工厂废气直接排放
5.下列做法有利于保护水资源的是( )
A.直接排放生活污水 B.大量使用化肥和农药
C.大量开采使用地下水 D.将工业废水处理达标后排放
6.碘是紫黑色晶体,可以溶解在汽油中,形成紫红色溶液。下列表示碘的汽油溶液中碘分子(以“〇”表示)的分布是(汽油分子没有画出)( )
A.B.C. D.
7.材料是人类生产和生活的重要物质基础。下列材料中属于新型金属材料的是( )
A.塑料 B.玻璃 C.纳米铬 D.陶瓷
8.下列物质性质和用途对应关系不正确的是( )
A.活性炭有吸附性,可用作除味剂 B.熟石灰有碱性,可用于治疗胃酸过多
C.油脂能溶于汽油,可用于除油污 D.生石灰有吸水性,可用作食品干燥剂
9.小兴同学暑假在家自制了一杯夏日饮品,为了确认其是否为酸性,下列试剂中能帮他完成任务的是( )
①红色石蕊试纸 ②蓝色石蕊试纸 ③酚酞试液 ④紫色石蕊试液
A.②③ B.①③ C.①②④ D.②④
10.湖南水稻播种面积、总产量均居全国首位。稻谷中富含淀粉,淀粉能提供的营养素是( )
A.油脂 B.无机盐 C.蛋白质 D.糖类
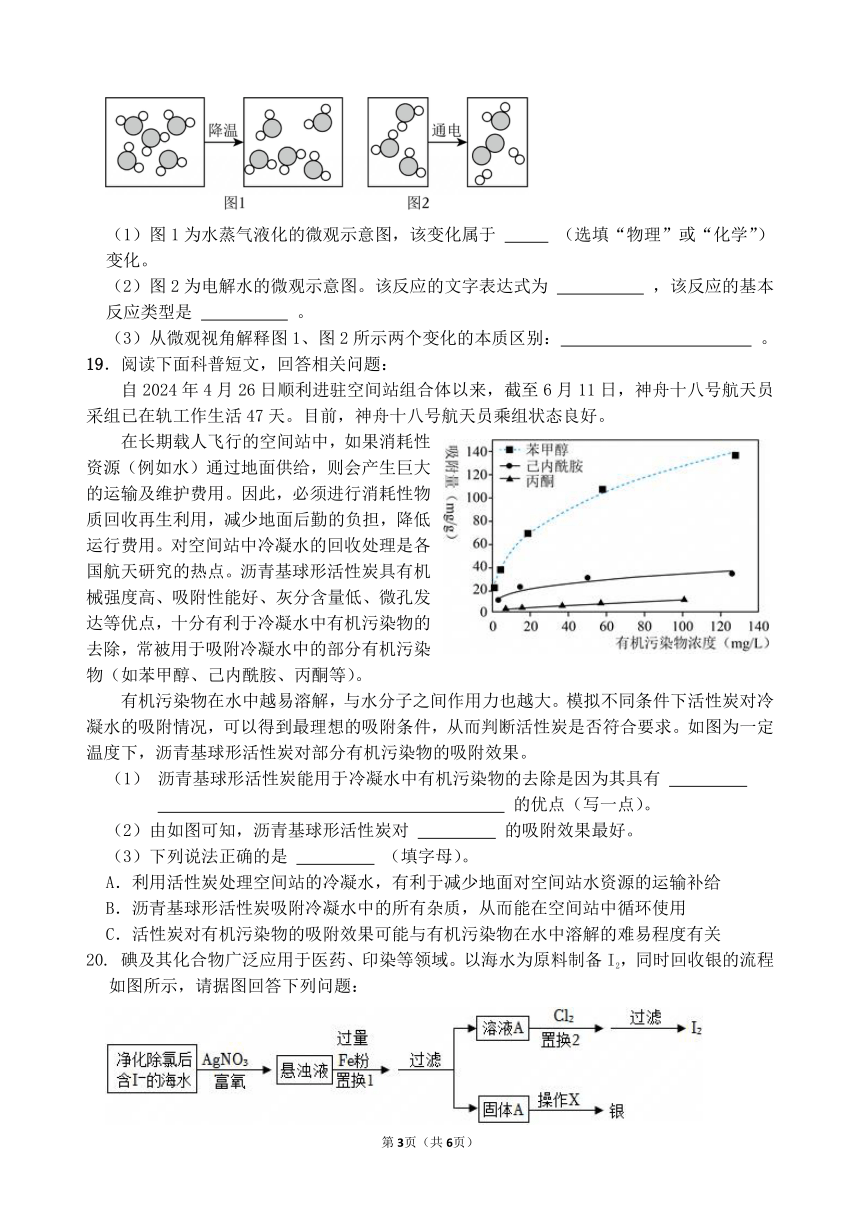
11.各种元素在地壳里的含量(质量分数)如图所示,其中含量由高到低排第二位的元素是( )
A.铁 B.铝 C.硅 D.氧
12.下列元素符号的书写错误的是( )
A.碳C B.氮N C.镁MG D.氯Cl
13.下列各组物质中,同种元素化合价有改变的是( )
A.SO2—H2SO3 B.Mn2O7—KMnO4 C.Al2O3—Al(OH)3 D.Cl2—HClO
14.正确的操作是实验成功的重要保证。下列图示基本实验操作正确的是( )
A.装粉末状固体 B.点燃酒精灯 C.倾倒液体药品 D.取用砝码
15.下列有关说法不正确的是( )
A.物质与氧气发生的反应都是氧化反应
B.木柴架空燃烧更旺是因为增大了木柴与氧气的接触面积
C.镁条可以在二氧化碳中燃烧,说明燃烧不一定需要氧气
D.铁丝在空气中燃烧,生成黑色的四氧化三铁固体
题号 1 2 3 4 5 6 7 8 9 10
答案
题号 11 12 13 14 15
答案
二、填空题:(本题共5小题,每空2分,共30分)
16. 碳是人类接触最早、利用最多的元素之一。
(1)《富春山居图》是元代画家黄公望的代表作,画中墨迹经数百年而不变色的原因是 。
(2)碳的氧化物有一氧化碳和二氧化碳,二者的化学性质不同的原因是 。
17.如图表示硝酸钾和氯化钠的溶解度曲线。请根据图回答下列问题:
(1)在20℃时,NaCl的溶解度 (“>”“<”或“=”)KNO3的溶解度。
(2)在t1℃时,将40g硝酸钾放入100g水中,形成的溶液为
(“饱和溶液”或“不饱和溶液”)
(3)当硝酸钾中含有少量氯化钠时,应采用 提纯硝酸钾。
18.建立宏观与微观的联系是学习化学的重要方法。请根据图示回答下列问题:
(1)图1为水蒸气液化的微观示意图,该变化属于 (选填“物理”或“化学”)变化。
(2)图2为电解水的微观示意图。该反应的文字表达式为 ,该反应的基本反应类型是 。
(3)从微观视角解释图1、图2所示两个变化的本质区别: 。
19.阅读下面科普短文,回答相关问题:
自2024年4月26日顺利进驻空间站组合体以来,截至6月11日,神舟十八号航天员采组已在轨工作生活47天。目前,神舟十八号航天员乘组状态良好。
在长期载人飞行的空间站中,如果消耗性资源(例如水)通过地面供给,则会产生巨大的运输及维护费用。因此,必须进行消耗性物质回收再生利用,减少地面后勤的负担,降低运行费用。对空间站中冷凝水的回收处理是各国航天研究的热点。沥青基球形活性炭具有机械强度高、吸附性能好、灰分含量低、微孔发达等优点,十分有利于冷凝水中有机污染物的去除,常被用于吸附冷凝水中的部分有机污染物(如苯甲醇、己内酰胺、丙酮等)。
有机污染物在水中越易溶解,与水分子之间作用力也越大。模拟不同条件下活性炭对冷凝水的吸附情况,可以得到最理想的吸附条件,从而判断活性炭是否符合要求。如图为一定温度下,沥青基球形活性炭对部分有机污染物的吸附效果。
沥青基球形活性炭能用于冷凝水中有机污染物的去除是因为其具有
的优点(写一点)。
(2)由如图可知,沥青基球形活性炭对 的吸附效果最好。
(3)下列说法正确的是 (填字母)。
A.利用活性炭处理空间站的冷凝水,有利于减少地面对空间站水资源的运输补给
B.沥青基球形活性炭吸附冷凝水中的所有杂质,从而能在空间站中循环使用
C.活性炭对有机污染物的吸附效果可能与有机污染物在水中溶解的难易程度有关
20. 碘及其化合物广泛应用于医药、印染等领域。以海水为原料制备I2,同时回收银的流程如图所示,请据图回答下列问题:
【资料】①生成碘的2FeI2+3Cl2=2FeCl3+2I2↑。
②氯化银是不溶于水的白色固体;碘化银是不溶于水的黄色固体。
(1)人体缺碘易导致 ,从海水中获取淡水的操作是 (选填“沉淀”、“吸附”或“蒸馏”)。
(2)“富集”中观察到的明显现象是有黄色沉淀生成,加入硝酸银的目的是得到 。
三、实验与探究题:本题共2小题,每空2分,共20分。
21.久置的铜制品表面能生成绿色的铜锈[主要成分为Cu2(OH)2CO3],某化学兴趣小组对铜生锈的条件进行了以下探究。
[猜想]根据铜锈的组成元素推测,铜生锈可能是铜与空气中的 、 等物质反应的结果。
[实验]他们设计了如图所示的四个实验。
[分析]若干天后,发现只有D瓶中的铜丝出现绿色的铜锈,其他瓶均无铜锈出现。
(1)实验B、C瓶中所使用的蒸馏水是经煮沸后迅速冷却的蒸馏水,其目的是 。
(2)为验证“H2O”对铜生锈的影响,是实验 (填字母)。
为验证“CO2”对铜生锈的影响,是实验 (填字母)。
(3)B瓶与D瓶中的现象对比,可以得出的结论是 。
[结论]由上述四个实验可分析得出,铜生锈是铜与空气中的 共同作用的结果。
[拓展]从上面探究可以认为,要防止铜器生锈可采取的措施是 。
22.2024年5月1日,我国利用船舶加装的碳捕捉系统回收首罐液态二氧化碳的卸船,标志着远洋航行船舶从燃油消耗到二氧化碳回收利用形成闭环。同学们对“二氧化碳回收利用形成闭环”非常感兴趣,开展有关二氧化碳的项目式学习。
任务一:调查空气中二氧化碳含量增加的原因
同学们调查到空气中二氧化碳含量增加的原因有很多,你认为有
(写一种即可)。
任务二:讨论空气中二氧化碳含量减少的方法
同学们讨论了空气中二氧化碳含量减少的方法,知道低碳生活方式可以减少二氧化碳排放,你的一种低碳生活方式是 。
任务三:探究实验室中不同试剂吸收二氧化碳的效果
实验室提供4种试剂:水、饱和石灰水、质量分数为0.165%的NaOH溶液质量分数为40%的NaOH溶液。
【提出问题】上述4种试剂吸收二氧化碳的效果如何?
【查阅资料】①室温下,饱和石灰水中氢氧化钙的质量分数约为0.165%;
②利用压强传感器及信息处理终端可将实验数据进行记录、呈现和分析。
【进行实验】步骤1:各装置气密性良好(夹持装置已省略),同学们用4只250mL烧瓶集满纯净的二氧化碳气体。
步骤2:同学们用4只注射器分别取60mL上述提供的4种试剂,将烧瓶分别连接压强传感器和注射器(如图1所示)。
步骤3:待烧瓶内气压平稳后,迅速将4支注射器内试剂分别全部注入相对应的烧瓶中,关闭止水夹,观察压强变化。一段时间后,振荡烧瓶,继续观察压强变化。小组合作完成实验,并展示烧瓶内压强随时间变化的曲线图(如图2所示)。
【分析讨论】
根据40%NaOH溶液对应的曲线,分析t1~t3时间段曲线变化的原因是
。
【得出结论】
结合图2数据,从压强和吸收效果两个角度对比分析,得到的结论是
。
任务四:形成二氧化碳闭环的意识
在老师指导下,知道上述实验中40%NaOH溶液吸收二氧化碳后,氢氧化钠有剩余。为了达到零碳排放和对环境无污染,形成二氧化碳闭环的意识。
【拓展思维】
我国已经实现了利用二氧化碳合成淀粉、甲醇和负碳纤维等,“二氧化碳回收利用形成闭环”是未来碳科学和技术发展的探索方向。
四、计算题:本题共1小题,共5分。
23.在设计和制作简易供氧器的跨学科实践活动中,综合考虑使用环境和药品等因素,选择用过氧化氢溶液和二氧化锰混合制氧气。请计算:
(1)过氧化氢中氢、氧元素的质量比为 。
(2)用质量分数为10%的过氧化氢溶液制取9.6g氧气,所消耗过氧化氢溶液的质量。
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D C A C D A C B D D
题号 11 12 13 14 15
答案 C C D B D
16.(1)碳单质在常温下的化学性质不活泼;(2)分子构成不同。
17.(1)>;(2)饱和溶液;(3)降温结晶。
18.(1)物理;(2)水氢气+氧气;分解反应;(3)图1中分子种类没有改变,分子间的间隙发生改变,而图2中分子种类发生了改变,变成新的分子。
19.(1)机械强度高或吸附性能好或灰分含量低或微孔发达;(2)苯甲醇;(3)AC。
20.(1)甲状腺肿大;蒸馏。(2)碘化银。
21. [猜想]水;二氧化碳。[分析](1)排出溶于水的氧气。(2)AD;BD。(3)铜生锈需要二氧化碳。[结论]水、氧气、二氧化碳。[拓展]铜器置于干燥处。
22.任务一:化石燃料的燃烧(合理即可);任务二:乘坐公共交通工具出行(合理即可)任务三:【分析讨论】二氧化碳与氢氧化钠反应生成碳酸钠,二氧化碳气体体积减少,使烧瓶内压强减少,振荡,40%的氢氧化钠溶液与二氧化碳充分接触,反应速率更快(合理即可);【得出结论】相同条件下,40%的氢氧化钠溶液压强变化最大,吸收二氧化碳效果最好。
23.解:(1)1:16。
(2)设参加反应的过氧化氢溶液的质量为x。
2H2O22H2O+O2↑
68 32
x 9.6g
x=20.4g 所消耗过氧化氢溶液的质量为20.4g÷10%=204g。
答:所消耗过氧化氢溶液的质量为204g。
第6页(共6页)
考试时间:60分钟 总分:100分
一、选择题:(本题共15小题,每题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
1.下列变化属于化学变化的是( )
A.浓盐酸的试剂瓶口呈现白雾 B.氧气具有支持燃烧的性质
C.氢氧化钠固体吸水后潮解 D.纸张遇到浓硫酸后变成黑色
2.下列物质中含有氧气的是( )
A.蒸馏水 B.氯酸钾 C.空气 D.二氧化碳
3.下列发生装置中,可用于实验室加热高锰酸钾制取氧气的是( )
A. B. C. D.
4.习总书记在十九大报告中指出“必须树立和践行绿水青山就是金山银山的理念”。下列说法符合这一理念的是( )
A.将废弃塑料进行深土填埋 B.生活污水直接排放
C.大面积植树造林 D.工厂废气直接排放
5.下列做法有利于保护水资源的是( )
A.直接排放生活污水 B.大量使用化肥和农药
C.大量开采使用地下水 D.将工业废水处理达标后排放
6.碘是紫黑色晶体,可以溶解在汽油中,形成紫红色溶液。下列表示碘的汽油溶液中碘分子(以“〇”表示)的分布是(汽油分子没有画出)( )
A.B.C. D.
7.材料是人类生产和生活的重要物质基础。下列材料中属于新型金属材料的是( )
A.塑料 B.玻璃 C.纳米铬 D.陶瓷
8.下列物质性质和用途对应关系不正确的是( )
A.活性炭有吸附性,可用作除味剂 B.熟石灰有碱性,可用于治疗胃酸过多
C.油脂能溶于汽油,可用于除油污 D.生石灰有吸水性,可用作食品干燥剂
9.小兴同学暑假在家自制了一杯夏日饮品,为了确认其是否为酸性,下列试剂中能帮他完成任务的是( )
①红色石蕊试纸 ②蓝色石蕊试纸 ③酚酞试液 ④紫色石蕊试液
A.②③ B.①③ C.①②④ D.②④
10.湖南水稻播种面积、总产量均居全国首位。稻谷中富含淀粉,淀粉能提供的营养素是( )
A.油脂 B.无机盐 C.蛋白质 D.糖类
11.各种元素在地壳里的含量(质量分数)如图所示,其中含量由高到低排第二位的元素是( )
A.铁 B.铝 C.硅 D.氧
12.下列元素符号的书写错误的是( )
A.碳C B.氮N C.镁MG D.氯Cl
13.下列各组物质中,同种元素化合价有改变的是( )
A.SO2—H2SO3 B.Mn2O7—KMnO4 C.Al2O3—Al(OH)3 D.Cl2—HClO
14.正确的操作是实验成功的重要保证。下列图示基本实验操作正确的是( )
A.装粉末状固体 B.点燃酒精灯 C.倾倒液体药品 D.取用砝码
15.下列有关说法不正确的是( )
A.物质与氧气发生的反应都是氧化反应
B.木柴架空燃烧更旺是因为增大了木柴与氧气的接触面积
C.镁条可以在二氧化碳中燃烧,说明燃烧不一定需要氧气
D.铁丝在空气中燃烧,生成黑色的四氧化三铁固体
题号 1 2 3 4 5 6 7 8 9 10
答案
题号 11 12 13 14 15
答案
二、填空题:(本题共5小题,每空2分,共30分)
16. 碳是人类接触最早、利用最多的元素之一。
(1)《富春山居图》是元代画家黄公望的代表作,画中墨迹经数百年而不变色的原因是 。
(2)碳的氧化物有一氧化碳和二氧化碳,二者的化学性质不同的原因是 。
17.如图表示硝酸钾和氯化钠的溶解度曲线。请根据图回答下列问题:
(1)在20℃时,NaCl的溶解度 (“>”“<”或“=”)KNO3的溶解度。
(2)在t1℃时,将40g硝酸钾放入100g水中,形成的溶液为
(“饱和溶液”或“不饱和溶液”)
(3)当硝酸钾中含有少量氯化钠时,应采用 提纯硝酸钾。
18.建立宏观与微观的联系是学习化学的重要方法。请根据图示回答下列问题:
(1)图1为水蒸气液化的微观示意图,该变化属于 (选填“物理”或“化学”)变化。
(2)图2为电解水的微观示意图。该反应的文字表达式为 ,该反应的基本反应类型是 。
(3)从微观视角解释图1、图2所示两个变化的本质区别: 。
19.阅读下面科普短文,回答相关问题:
自2024年4月26日顺利进驻空间站组合体以来,截至6月11日,神舟十八号航天员采组已在轨工作生活47天。目前,神舟十八号航天员乘组状态良好。
在长期载人飞行的空间站中,如果消耗性资源(例如水)通过地面供给,则会产生巨大的运输及维护费用。因此,必须进行消耗性物质回收再生利用,减少地面后勤的负担,降低运行费用。对空间站中冷凝水的回收处理是各国航天研究的热点。沥青基球形活性炭具有机械强度高、吸附性能好、灰分含量低、微孔发达等优点,十分有利于冷凝水中有机污染物的去除,常被用于吸附冷凝水中的部分有机污染物(如苯甲醇、己内酰胺、丙酮等)。
有机污染物在水中越易溶解,与水分子之间作用力也越大。模拟不同条件下活性炭对冷凝水的吸附情况,可以得到最理想的吸附条件,从而判断活性炭是否符合要求。如图为一定温度下,沥青基球形活性炭对部分有机污染物的吸附效果。
沥青基球形活性炭能用于冷凝水中有机污染物的去除是因为其具有
的优点(写一点)。
(2)由如图可知,沥青基球形活性炭对 的吸附效果最好。
(3)下列说法正确的是 (填字母)。
A.利用活性炭处理空间站的冷凝水,有利于减少地面对空间站水资源的运输补给
B.沥青基球形活性炭吸附冷凝水中的所有杂质,从而能在空间站中循环使用
C.活性炭对有机污染物的吸附效果可能与有机污染物在水中溶解的难易程度有关
20. 碘及其化合物广泛应用于医药、印染等领域。以海水为原料制备I2,同时回收银的流程如图所示,请据图回答下列问题:
【资料】①生成碘的2FeI2+3Cl2=2FeCl3+2I2↑。
②氯化银是不溶于水的白色固体;碘化银是不溶于水的黄色固体。
(1)人体缺碘易导致 ,从海水中获取淡水的操作是 (选填“沉淀”、“吸附”或“蒸馏”)。
(2)“富集”中观察到的明显现象是有黄色沉淀生成,加入硝酸银的目的是得到 。
三、实验与探究题:本题共2小题,每空2分,共20分。
21.久置的铜制品表面能生成绿色的铜锈[主要成分为Cu2(OH)2CO3],某化学兴趣小组对铜生锈的条件进行了以下探究。
[猜想]根据铜锈的组成元素推测,铜生锈可能是铜与空气中的 、 等物质反应的结果。
[实验]他们设计了如图所示的四个实验。
[分析]若干天后,发现只有D瓶中的铜丝出现绿色的铜锈,其他瓶均无铜锈出现。
(1)实验B、C瓶中所使用的蒸馏水是经煮沸后迅速冷却的蒸馏水,其目的是 。
(2)为验证“H2O”对铜生锈的影响,是实验 (填字母)。
为验证“CO2”对铜生锈的影响,是实验 (填字母)。
(3)B瓶与D瓶中的现象对比,可以得出的结论是 。
[结论]由上述四个实验可分析得出,铜生锈是铜与空气中的 共同作用的结果。
[拓展]从上面探究可以认为,要防止铜器生锈可采取的措施是 。
22.2024年5月1日,我国利用船舶加装的碳捕捉系统回收首罐液态二氧化碳的卸船,标志着远洋航行船舶从燃油消耗到二氧化碳回收利用形成闭环。同学们对“二氧化碳回收利用形成闭环”非常感兴趣,开展有关二氧化碳的项目式学习。
任务一:调查空气中二氧化碳含量增加的原因
同学们调查到空气中二氧化碳含量增加的原因有很多,你认为有
(写一种即可)。
任务二:讨论空气中二氧化碳含量减少的方法
同学们讨论了空气中二氧化碳含量减少的方法,知道低碳生活方式可以减少二氧化碳排放,你的一种低碳生活方式是 。
任务三:探究实验室中不同试剂吸收二氧化碳的效果
实验室提供4种试剂:水、饱和石灰水、质量分数为0.165%的NaOH溶液质量分数为40%的NaOH溶液。
【提出问题】上述4种试剂吸收二氧化碳的效果如何?
【查阅资料】①室温下,饱和石灰水中氢氧化钙的质量分数约为0.165%;
②利用压强传感器及信息处理终端可将实验数据进行记录、呈现和分析。
【进行实验】步骤1:各装置气密性良好(夹持装置已省略),同学们用4只250mL烧瓶集满纯净的二氧化碳气体。
步骤2:同学们用4只注射器分别取60mL上述提供的4种试剂,将烧瓶分别连接压强传感器和注射器(如图1所示)。
步骤3:待烧瓶内气压平稳后,迅速将4支注射器内试剂分别全部注入相对应的烧瓶中,关闭止水夹,观察压强变化。一段时间后,振荡烧瓶,继续观察压强变化。小组合作完成实验,并展示烧瓶内压强随时间变化的曲线图(如图2所示)。
【分析讨论】
根据40%NaOH溶液对应的曲线,分析t1~t3时间段曲线变化的原因是
。
【得出结论】
结合图2数据,从压强和吸收效果两个角度对比分析,得到的结论是
。
任务四:形成二氧化碳闭环的意识
在老师指导下,知道上述实验中40%NaOH溶液吸收二氧化碳后,氢氧化钠有剩余。为了达到零碳排放和对环境无污染,形成二氧化碳闭环的意识。
【拓展思维】
我国已经实现了利用二氧化碳合成淀粉、甲醇和负碳纤维等,“二氧化碳回收利用形成闭环”是未来碳科学和技术发展的探索方向。
四、计算题:本题共1小题,共5分。
23.在设计和制作简易供氧器的跨学科实践活动中,综合考虑使用环境和药品等因素,选择用过氧化氢溶液和二氧化锰混合制氧气。请计算:
(1)过氧化氢中氢、氧元素的质量比为 。
(2)用质量分数为10%的过氧化氢溶液制取9.6g氧气,所消耗过氧化氢溶液的质量。
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D C A C D A C B D D
题号 11 12 13 14 15
答案 C C D B D
16.(1)碳单质在常温下的化学性质不活泼;(2)分子构成不同。
17.(1)>;(2)饱和溶液;(3)降温结晶。
18.(1)物理;(2)水氢气+氧气;分解反应;(3)图1中分子种类没有改变,分子间的间隙发生改变,而图2中分子种类发生了改变,变成新的分子。
19.(1)机械强度高或吸附性能好或灰分含量低或微孔发达;(2)苯甲醇;(3)AC。
20.(1)甲状腺肿大;蒸馏。(2)碘化银。
21. [猜想]水;二氧化碳。[分析](1)排出溶于水的氧气。(2)AD;BD。(3)铜生锈需要二氧化碳。[结论]水、氧气、二氧化碳。[拓展]铜器置于干燥处。
22.任务一:化石燃料的燃烧(合理即可);任务二:乘坐公共交通工具出行(合理即可)任务三:【分析讨论】二氧化碳与氢氧化钠反应生成碳酸钠,二氧化碳气体体积减少,使烧瓶内压强减少,振荡,40%的氢氧化钠溶液与二氧化碳充分接触,反应速率更快(合理即可);【得出结论】相同条件下,40%的氢氧化钠溶液压强变化最大,吸收二氧化碳效果最好。
23.解:(1)1:16。
(2)设参加反应的过氧化氢溶液的质量为x。
2H2O22H2O+O2↑
68 32
x 9.6g
x=20.4g 所消耗过氧化氢溶液的质量为20.4g÷10%=204g。
答:所消耗过氧化氢溶液的质量为204g。
第6页(共6页)
同课章节目录
