2025届高二下学期化学期中综合模拟试题(人教版2019 )(二)
文档属性
| 名称 | 2025届高二下学期化学期中综合模拟试题(人教版2019 )(二) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-03 17:07:11 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025届高二下学期化学期中综合模拟试题(人教版2019 )(二)
一、单选题
1.化学与生活密切相关。下列说法正确的是
A.“嫦娥五号”使用的太阳能电池板可将化学能转变成电能
B.机械表中由钼钴镍铬等元素组成的发条,其材质属于合金
C.基于界面效应的新型开关中的碲元素和钛元素都是过渡元素
D.烟花绽放时的五彩缤纷是利用了金属原子的吸收光谱
2.化学用语的选择和书写是化学学习的基础,下列化学用语正确的是
A.基态C原子核外价电子的轨道表达式:
B.NH3分子的VSEPR模型:
C.HClO的电子式:
D.和互为同素异形体
3.下列说法正确的是
A.比稳定是因为水分子间存在氢键
B.为型分子,有微弱的极性,在水中的溶解度小于
C.的分子结构是,在中只有键没有键
D.乙酸()的酸性大于甲酸(HCOOH),是因为烷基的推电子效应使乙酸中的羟基极性减小
4.下列说法正确的是
A.的名称是2-甲基-3-羟基戊酸
B.CH3COOH与CH3CCH218OH发生酯化反应可生成酯CH3COOCH2CH3
C.乙酸、苯酚均能与NaOH溶液反应,二者分子中官能团相同
D.可用新制的Cu(OH)2来区分甲醇、甲酸、乙醛、乙酸
5.下列化学过程中,不存在C-H键断裂的是
A.甲苯在催化下与液溴反应 B.溴乙烷与NaOH的乙醇溶液共热
C.乙烯使溴的溶液褪色 D.170℃下加热乙醇和浓硫酸混合物
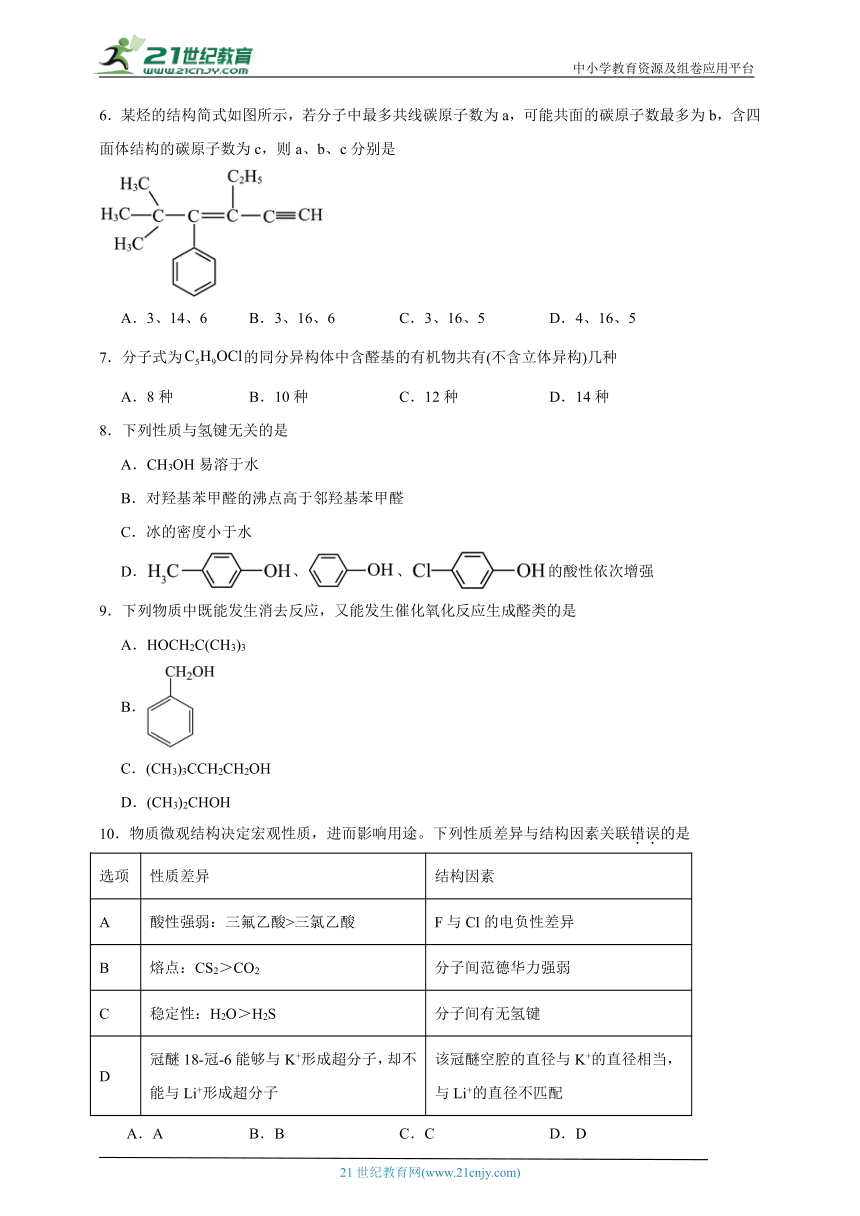
6.某烃的结构简式如图所示,若分子中最多共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是
A.3、14、6 B.3、16、6 C.3、16、5 D.4、16、5
7.分子式为的同分异构体中含醛基的有机物共有(不含立体异构)几种
A.8种 B.10种 C.12种 D.14种
8.下列性质与氢键无关的是
A.CH3OH易溶于水
B.对羟基苯甲醛的沸点高于邻羟基苯甲醛
C.冰的密度小于水
D.、、的酸性依次增强
9.下列物质中既能发生消去反应,又能发生催化氧化反应生成醛类的是
A.HOCH2C(CH3)3
B.
C.(CH3)3CCH2CH2OH
D.(CH3)2CHOH
10.物质微观结构决定宏观性质,进而影响用途。下列性质差异与结构因素关联错误的是
选项 性质差异 结构因素
A 酸性强弱:三氟乙酸>三氯乙酸 F与Cl的电负性差异
B 熔点:CS2>CO2 分子间范德华力强弱
C 稳定性:H2O>H2S 分子间有无氢键
D 冠醚18-冠-6能够与K+形成超分子,却不能与Li+形成超分子 该冠醚空腔的直径与K+的直径相当,与Li+的直径不匹配
A.A B.B C.C D.D
11.下列物质熔点大小的比较正确的是
A. B.金刚石
C. D.
12.1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下),它在光照的条件下与氯气反应能生成三种不同的一氯取代物,该烃的结构简式是
A. B.CH3CH2CH2CH2CH3
C. D.CH3CH2CH2CH2CH2CH2CH3
13.配合物广泛应用于日常生活、工业生产及生命科学中,近些年来的发展尤其迅速。许多过渡金属离子能形成种类繁多的配合物。下列说法正确的是
A.中的提供接受孤电子对的空轨道,则配体是分子和Cl原子
B.配合物中含有配位键
C.、、都是配合物
D.配合物的中心离子为,该配合物与足量溶液反应,生成沉淀
14.根据下面合成路线判断烃A为
A(烃类)BC
A.1﹣丁烯 B.乙烯
C.乙炔 D.1,3﹣丁二烯
15.Cu的化合物种类繁多,在人类的生产生活中有着广泛的应用,实验测得一种Cu与Br形成的化合物沸点为1345℃,晶胞结构如图所示(黑球代表铜,晶胞的密度为ρ g·cm-3,设为阿伏加德罗常数的值),下列说法正确的是
A.晶体的化学式为CuBr2
B.晶体中与Br最近且距离相等的Br有6个
C.Cu与Br之间的最短距离为
D.该化合物为共价晶体
二、填空题
16.物质的组成与结构决定了物质的性质与变化。回答下列问题:
(1)基态氮原子核外未成对电子数为 。
(2)在元素周期表中,N、O、F位于同周期且相邻,第一电离能最大的元素和最小的元素组成一种只含极性键的化合物M,M分子的空间构型是 ,中心原子的杂化类型是 。
(3)能与多种金属离子形成配合物。例如,工业冶炼金的原理:,中含 mol键。
(4)钛酸钙晶胞结构如图所示。钛酸钙的化学式为 ;1个钛离子与 个氧离子等距离且最近,连接这些氧离子构成正八面体,钛离子位于该正八面体的体心。
(5)在元素周期中,钡位于第六周期Ⅱ A族。钛酸钡、钛酸钙的熔点分别为1610℃、1975℃,解释其熔点差异的原因: 。
17.有机物种类繁多、结构复杂。以下是10种常见的有机物,请根据要求回答下列问题。
① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
(1)以上属于芳香烃的是 (填序号)。
(2)某烃与氢气加成后得到①,该烃的结构简式可能有 种。
(3)②分子中最多有 个碳原子在同一直线上。
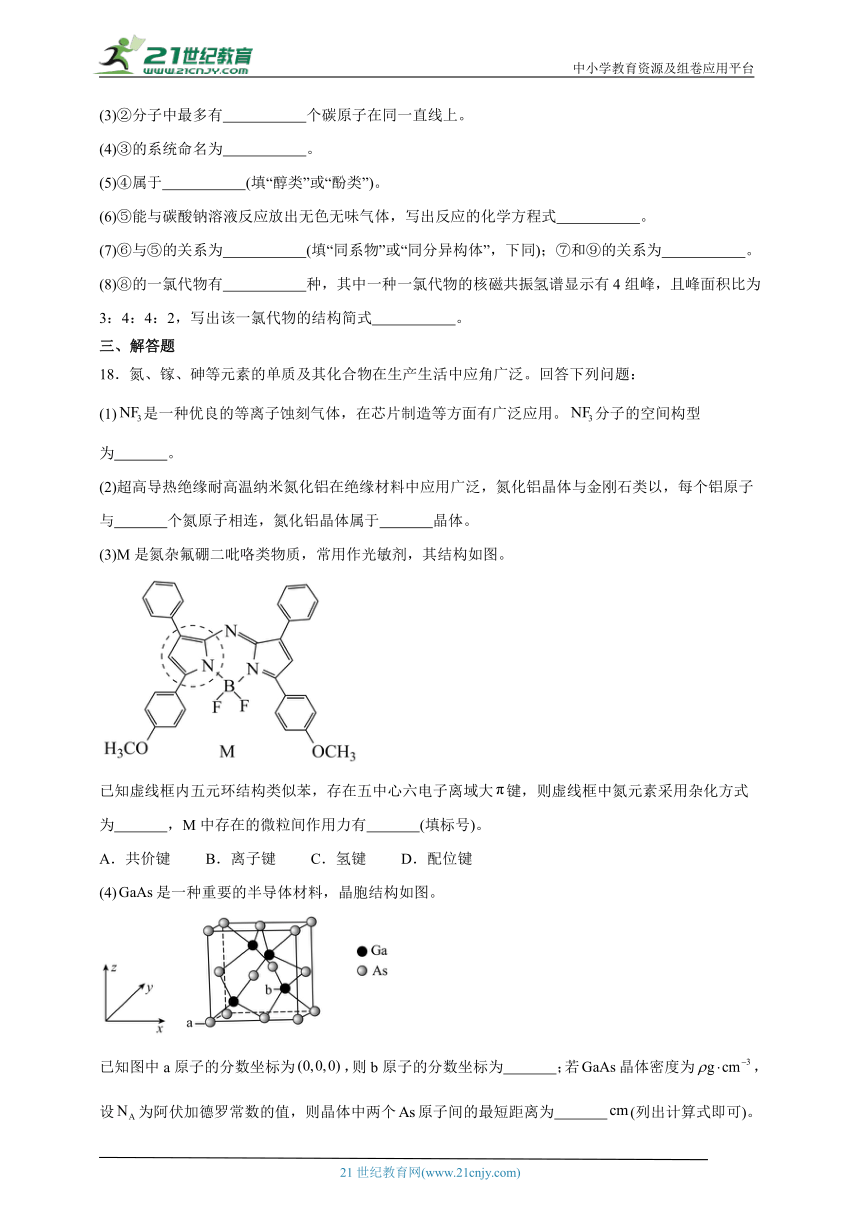
(4)③的系统命名为 。
(5)④属于 (填“醇类”或“酚类”)。
(6)⑤能与碳酸钠溶液反应放出无色无味气体,写出反应的化学方程式 。
(7)⑥与⑤的关系为 (填“同系物”或“同分异构体”,下同);⑦和⑨的关系为 。
(8)⑧的一氯代物有 种,其中一种一氯代物的核磁共振氢谱显示有4组峰,且峰面积比为3:4:4:2,写出该一氯代物的结构简式 。
三、解答题
18.氮、镓、砷等元素的单质及其化合物在生产生活中应角广泛。回答下列问题:
(1)是一种优良的等离子蚀刻气体,在芯片制造等方面有广泛应用。分子的空间构型为 。
(2)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类以,每个铝原子与 个氮原子相连,氮化铝晶体属于 晶体。
(3)M是氮杂氟硼二吡咯类物质,常用作光敏剂,其结构如图。
已知虚线框内五元环结构类似苯,存在五中心六电子离域大键,则虚线框中氮元素采用杂化方式为 ,M中存在的微粒间作用力有 (填标号)。
A.共价键 B.离子键 C.氢键 D.配位键
(4)是一种重要的半导体材料,晶胞结构如图。
已知图中a原子的分数坐标为,则b原子的分数坐标为 ;若晶体密度为,设为阿伏加德罗常数的值,则晶体中两个原子间的最短距离为 (列出计算式即可)。
19.化合物M是一种重要的有机合成中间体,其合成路线如图所示:
已知:①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
②。
回答下列问题:
(1)A→B的反应条件为 ,B的名称为 (系统命名法),B→C的反应类型为 。
(2)Y中含有的官能团名称为 ,Z的结构简式为 。
(3)C→D的化学方程式为 。
(4)W是X的同系物,相对分子质量比X大14,则W的同分异构体有 种。
(5)根据上述信息,写出以为主要原料制备的合成路线 。
参考答案
1.B
A.太阳能电池阵可将太阳能转变成电能,A错误;
B.该发条由钼钴镍铬等元素组成,其材质属于合金,B正确;
C.碲元素在ⅥA族,不是过渡元素,C错误;
D.烟花绽放时的五彩缤纷是利用了金属原子的发射光谱,D错误;
故答案选B。
2.C
A.已知C是6号元素,根据洪特规则可知,基态C原子核外价电子的轨道表达式:,A错误;
B .NH3分子中中心原子N周围的价层电子对数为:3+=4,根据价层电子对互斥理论可知,其VSEPR模型为:,B错误;
C.已知HClO是共价化合物,H、Cl周围能够形成1对共用电子对,O周围能够形成2对共用电子对,故HClO的电子式为:,C正确;
D.和是质子数相同而中子数不同的原子,故互为同位素,D错误;
故答案为:C。
3.C
A.的稳定性高于是由于O-H键键能更高,而非氢键,氢键影响物理性质(如熔沸点),与热稳定性无关,A错误;
B.为V形极性分子,为非极性分子。极性分子通常更易溶于极性溶剂(如水),因此溶解度应大于,B错误;
C.的结构为H-O-O-H,O-O单键和O-H键均为σ键,无π键,描述正确,C正确;
D.甲酸(HCOOH)酸性强于乙酸(),烷基(如-CH3)的推电子效应会减弱羧酸中O-H的极性,抑制H+解离,降低酸性,结论与原因均错误,D错误;
故选C。
4.D
A.,含羧基的主链上有5个C,支链有一个甲基,一个羟基,正确命名应是4-甲基-3-羟基戊酸,A错误;
B.酯化反应的脱水过程是“酸脱羟基醇脱氢”,故CH3COOH与CH3CH218OH发生酯化反应生成的酯是CH3CO18OCH2CH3,B错误;
C.乙酸的官能团是羧基,苯酚的官能团是酚羟基,二者分子中的官能团不同,C错误;
D.用新制的Cu(OH)2鉴别这4种物质的方法:向这四种溶液中分别滴入适量新制的Cu(OH)2悬浊液,室温下能使新制的Cu(OH)2悬浊液溶解的是甲酸、乙酸,不能使其溶解的是甲醇、乙醛,再将两组溶液分别加热,能产生红色沉淀的是甲酸(溶解)、乙醛(不溶解),不能产生红色沉淀的是甲醇(不溶解)、乙酸(溶解),D正确;
故选D;
5.C
A.甲苯与液溴(FeBr 催化):发生苯环上取代反应,甲基邻/对位的C-H键断裂,生成HBr,存在C-H键断裂,A不符合题意;
B.溴乙烷与NaOH乙醇溶液共热:发生消去反应,脱去β-H和Br形成乙烯,β-C的C-H键断裂,存在C-H键断裂,B不符合题意;
C.乙烯与Br /CCl 反应:发生加成反应,双键打开直接与Br 结合生成1,2-二溴乙烷,反应中仅涉及双键断裂,无C-H键断裂,C符合题意;
D.乙醇与浓硫酸(170℃):发生分子内脱水生成乙烯,需脱去β-H(C-H键断裂),存在C-H键断裂,D不符合题意;
故选C。
6.A
已知乙炔基中碳原子为sp杂化,为直线形结构,则与乙炔基相连的C原子共线,则共有3个;苯环上的碳原子和碳碳双键两端的碳原子均为sp2杂化,碳原子形成的三条键为平面三角形,则可能共面的碳原子最多为14;饱和的碳原子为sp3杂化,此有机物中乙基、甲基及甲基所在的C原子中共计6个碳原子为四面体结构,故本题选A。
7.C
分子式为的同分异构体中含醛基,故可看成-CHO取代C4H9Cl上的一个氢原子,分子式为 C4H9Cl的同分异构体主链有4个碳原子的: CH3CH2CH2CH2Cl,-CHO取代有4种;CH3CH2CHClCH3,-CHO取代有4种;主链有3个碳原子的:CH3CH(CH3)CH2Cl,-CHO取代有3种;CH3CCl(CH3 )2,-CHO取代有1种,则共有12种,故选C。
8.D
A.CH3OH与水分子能形成分子间氢键,所以CH3OH易溶于水,故不选A;
B.对羟基苯甲醛易形成分子间氢键,邻羟基苯甲醛易形成分子内氢键,所以对羟基苯甲醛的沸点高于邻羟基苯甲醛,故不选B;
C.冰的密度小于水是因为冰中水分子间形成氢键增多,故不选C;
D.甲基为推电子基,对甲基苯酚中羟基的极性减弱,氯原子为吸电子基,对氯苯酚中羟基的极性增强,所以、、的酸性依次增强,故选D;
选D。
9.C
能够发生消去反应,需要—OH所连碳原子的相邻碳上有H,能够发生氧化且生成醛,则要求—OH所连接的碳原子上至少有两个H,据此分析;
A.HOCH2C(CH3)3不能发生消去反应,A错误;
B.不能发生消去反应,B错误;
C.(CH3)3CCH2CH2OH既能发生消去反应,又能发生催化氧化反应生成醛,符合题意,C正确;
D.(CH3)2CHOH不能发生催化氧化反应生成醛,D错误;
故选C。
10.C
A.由于F的电负性比Cl大,吸引电子的能力更强,三氟乙酸羧基中的O-H键的极性更大,更易电离出H+,酸性更强,故A正确;
B.CS2相对分子质量比CO2大,CS2的范德华力更大,熔点更高,故B正确;
C.稳定性:H2O>H2S,是因为键能H-O>H-S,与氢键无关,故C错误;
D.18-冠-6(冠醚)空腔的直径与K+直径相当,与Li+的直径不匹配,因此能够与K+形成超分子,却不能与Li+形成超分子,故D正确;
故选C。
11.A
A.离子晶体的晶格能大小取决于离子半径和电荷,离子半径越小,电荷越多,晶格能越大,离子晶体的熔点越高,半径:Cl-B.共价晶体的熔点与键能有关,键能越大,熔点越高,金刚石、SiC、Si均为共价晶体,键长:C-C<C-Si<Si-Si,键能:C-C>C-Si>Si-Si,则熔点为金刚石>SiC>Si,B错误;
C.分子结构相似,且都为分子晶体,分子的相对分子质量越大,分子之间作用力越大,熔点越高,则有CH4<SiH4<GeH4,C错误;
D.碱金属从上到下,原子半径逐渐增大,金属键键能逐渐减小,金属晶体的熔点逐渐降低,则有熔点:K<Na<Li,D错误;
故选A。
12.B
由烷烃的通式为CnH2n+2可得:CnH2n+2—O2,1mol烷烃在氧气中充分燃烧消耗标准状况下179.2 L氧气,则由关系式可得:=,解得n=5,CH3CH2CH2CH2CH3、在光照的条件下与氯气反应生成一氯代物的数目分别为3、4,则烷烃的结构简式为CH3CH2CH2CH2CH3,故选B。
13.B
A.Co3+的价电子排布式为3d6,含有空轨道,NH3分子和Cl离子含有孤电子对,根据配位键形成条件可知,[Co(NH3)5Cl]Cl2中中心离子为Co3+,配体是NH3分子和Cl离子,A错误;
B.配合物Fe(CO)5中,中心原子是Fe,CO是配体,1个分子中含有5个配位键;每个CO中含有一个配位键,则1mol Fe(CO)5配合物中含有10mol配位键,B正确;
C.K4[Fe(CN)6]、[Ag(NH3)2]OH都是配合物,但NH4Cl不是配合物、无中心原子,C错误;
D.配合物[TiCl(H2O)5]Cl2 H2O的中心离子为Ti3+,溶于水能电离出2个Cl-,则1mol该配合物与足量AgNO3溶液反应生成2mol AgCl沉淀,D错误;
故选B。
14.B
由反应条件、目标物的结构简式可知,烃A与溴发生加成反应生成B,B发生卤代烃的水解反应生成C,2分子C之间脱去2分子水生成目标物,推知A为CH2=CH2、B为BrCH2CH2Br、 C为HOCH2CH2OH,则烯烃A的名称为乙烯。
故选B。
15.C
A.根据均摊法可知,晶胞中白球和黑球的数目均为4,故化学式为CuBr,故A项错误;
B.由图可知,溴位于晶胞顶角,其周围最近且距离相等的溴位于面心,有12个,故B项错误;
C.晶胞的质量为g,设晶胞参数为a cm,则晶体的密度为,,Cu原子与Br原子之间的最短距离为体对角线的,即Cu原子与Br原子之间的最短距离为,故C项正确;
D.溴化亚铜为离子晶体,故D项错误;
故本题选C。
16.(1)3
(2) V形 sp3
(3)8
(4) 6
(5)钛酸钡、钛酸钙都是离子晶体,半径小于,钛酸钙的晶格能大于钛酸钡
(1)氮元素的原子序数为7,价电子排布式为2s22p3,p轨道上有3个未成对电子;
(2)同周期元素,从左到右第一电离能呈增大趋势,氮原子的2p轨道为稳定的半充满结构,元素的第一电离能大于相邻元素,则第一电离能由大到小的顺序:F>N>O,氟元素和氧元素形成的化合物OF2分子中氧原子的价层电子对数:,含2对孤电子对,分子的空间构型为V形,原子的杂化方式为sp3杂化;
(3)配离子中配位键属于键,氰酸根离子的结构中有碳氮三键,碳氮三键中含有1个键和2个π键,所以配离子中含有8 mol键;
(4)根据均摊法计算:Ti位于8顶点,共有,Ca位于晶胞内部,共有1个,O位于棱上,共有,化学式:;由晶胞结构可知,1个位于顶点的钛离子与6个位于棱上的氧离子等距离且最近,连接这些氧离子构成正八面体,钛离子位于该正八面体的体心;
(5)钛酸钡、钛酸钙都是离子晶体,钙离子的离子半径小于钡离子,钛酸钙的晶格能大于钛酸钡,熔点高于钛酸钡。
17.(1)⑦⑨
(2)2
(3)3
(4)2-甲基-2-戊烯
(5)醇类
(6)2+Na2CO32+H2O+CO2↑
(7) 同分异构体 同系物
(8) 5
(1)芳香烃是含有苯环的烃,属于芳香烃的是⑦⑨;
(2)
某烃与氢气1:1加成后得到①,则该烃中应该含有1个碳碳双键,该烃的结构简式,有2种;
(3)碳碳叁键直接相连的原子共线,②分子中最多有3个碳原子在同一直线上;
(4)有机物系统命名法步骤:①最长-选最长碳链为主链;②最多-遇等长碳链时,支链最多为主链;③最近-离支链最近一端编号;④最小-支链编号之和最小(两端等距又同基,支链编号之和最小);⑤含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,并表示出官能团的位置,官能团的位次最小。③的系统命名为2-甲基-2-戊烯;
(5)④中羟基在支链上,属于醇类;
(6)
⑤中含羧基,能与碳酸钠溶液反应放出无色无味气体二氧化碳,同时生成羧酸钠和水,反应的化学方程式:2+Na2CO32+H2O+CO2↑;
(7)⑥与⑤的分子式相同,结构不同,两者互为:同分异构体;⑦和⑨结构相似,两者相差2个CH2,则两者互为同系物;
(8)
如图分子含有5种氢,其一氯代物有5种,其中一种一氯代物的核磁共振氢谱显示有4组峰,且峰面积比为3:4:4:2,则其结构对称,该一氯代物的结构简式。
18.(1)三角锥形
(2) 4 共价
(3) sp2 AD
(4)
(1)NF3价层电子对=,孤电子对1对,可知中心原子N采取sp3杂化,所以NF3的分子的空间构型为三角锥形;
(2)氮化铝晶体与金刚石类似,均是正四面体结构,每个铝原子与4个氮原子相连;AlN晶体与金刚石类似,属于共价晶体;
(3)环上N原子价层电子对数为3,采取sp2杂化,该环N原子价层孤对电子填充在2sp轨道;原子之间存在共价键,环上N原子与B原子之间形成配位键,不含氢键与离子键,故答案为AD;
(4)图1中A原子的坐标为,则B原子在x轴的,y轴的,z轴的,故分数坐标为;图中晶体密度为,由图可知一个晶胞中含有Ga的个数为:个,含有As原子个数为:4个,根据,则晶胞边长为:a=,由图可知晶胞中距离最近的两个As原子间距离为面对角线的一半,即。
19.(1) 氢氧化钠、乙醇、加热 甲基丙烯 加成反应
(2) 氯原子、(酚)羟基
(3)
(4)9
(5)
由M()逆推可知,E是(CH3)2CHCOOH,Z为,X的分子式为C7H8O,可知X的结构简式为,在光照条件下与氯气按物质的量之比1:2反应,甲基中的2个H被Cl取代,因此Y的结构简式为 ,Y→Z是水解反应;E是(CH3)2CHCOOH逆推,A的分子式为C4H9Cl,A→B是消去反应,所以B是(CH3)2C=CH2,B→C是加成反应,C是(CH3)2CHCH2OH,C→D是氧化反应,D是( CH3)2CHCHO,D→E是氧化反应,Z→E是酯化反应;据此分析;
(1)A→B是卤代烃的消去反应,反应条件为氢氧化钠、乙醇、加热;B是(CH3)2C=CH2名称为甲基丙烯; B是(CH3)2C=CH2,C是(CH3)2CHCH2OH,B→C的反应类型为加成反应;
(2)
Y的结构简式为,含有的官能团名称为氯原子、(酚)羟基;Z的结构简式为;
(3)C是(CH3)2CHCH2OH,D是( CH3)2CHCHO,C→D的化学方程式为;
(4)
X的结构简式为,W是X的同系物,相对分子质量比X大14,则W的分子中含有酚羟基,取代基①乙基和羟基,邻间对三种;②羟基和两个甲基,6种,共9种;
(5)
由逆推法可知得到需要催化氧化,需要加成得到,消去可得到,合成路线为:;
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025届高二下学期化学期中综合模拟试题(人教版2019 )(二)
一、单选题
1.化学与生活密切相关。下列说法正确的是
A.“嫦娥五号”使用的太阳能电池板可将化学能转变成电能
B.机械表中由钼钴镍铬等元素组成的发条,其材质属于合金
C.基于界面效应的新型开关中的碲元素和钛元素都是过渡元素
D.烟花绽放时的五彩缤纷是利用了金属原子的吸收光谱
2.化学用语的选择和书写是化学学习的基础,下列化学用语正确的是
A.基态C原子核外价电子的轨道表达式:
B.NH3分子的VSEPR模型:
C.HClO的电子式:
D.和互为同素异形体
3.下列说法正确的是
A.比稳定是因为水分子间存在氢键
B.为型分子,有微弱的极性,在水中的溶解度小于
C.的分子结构是,在中只有键没有键
D.乙酸()的酸性大于甲酸(HCOOH),是因为烷基的推电子效应使乙酸中的羟基极性减小
4.下列说法正确的是
A.的名称是2-甲基-3-羟基戊酸
B.CH3COOH与CH3CCH218OH发生酯化反应可生成酯CH3COOCH2CH3
C.乙酸、苯酚均能与NaOH溶液反应,二者分子中官能团相同
D.可用新制的Cu(OH)2来区分甲醇、甲酸、乙醛、乙酸
5.下列化学过程中,不存在C-H键断裂的是
A.甲苯在催化下与液溴反应 B.溴乙烷与NaOH的乙醇溶液共热
C.乙烯使溴的溶液褪色 D.170℃下加热乙醇和浓硫酸混合物
6.某烃的结构简式如图所示,若分子中最多共线碳原子数为a,可能共面的碳原子数最多为b,含四面体结构的碳原子数为c,则a、b、c分别是
A.3、14、6 B.3、16、6 C.3、16、5 D.4、16、5
7.分子式为的同分异构体中含醛基的有机物共有(不含立体异构)几种
A.8种 B.10种 C.12种 D.14种
8.下列性质与氢键无关的是
A.CH3OH易溶于水
B.对羟基苯甲醛的沸点高于邻羟基苯甲醛
C.冰的密度小于水
D.、、的酸性依次增强
9.下列物质中既能发生消去反应,又能发生催化氧化反应生成醛类的是
A.HOCH2C(CH3)3
B.
C.(CH3)3CCH2CH2OH
D.(CH3)2CHOH
10.物质微观结构决定宏观性质,进而影响用途。下列性质差异与结构因素关联错误的是
选项 性质差异 结构因素
A 酸性强弱:三氟乙酸>三氯乙酸 F与Cl的电负性差异
B 熔点:CS2>CO2 分子间范德华力强弱
C 稳定性:H2O>H2S 分子间有无氢键
D 冠醚18-冠-6能够与K+形成超分子,却不能与Li+形成超分子 该冠醚空腔的直径与K+的直径相当,与Li+的直径不匹配
A.A B.B C.C D.D
11.下列物质熔点大小的比较正确的是
A. B.金刚石
C. D.
12.1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下),它在光照的条件下与氯气反应能生成三种不同的一氯取代物,该烃的结构简式是
A. B.CH3CH2CH2CH2CH3
C. D.CH3CH2CH2CH2CH2CH2CH3
13.配合物广泛应用于日常生活、工业生产及生命科学中,近些年来的发展尤其迅速。许多过渡金属离子能形成种类繁多的配合物。下列说法正确的是
A.中的提供接受孤电子对的空轨道,则配体是分子和Cl原子
B.配合物中含有配位键
C.、、都是配合物
D.配合物的中心离子为,该配合物与足量溶液反应,生成沉淀
14.根据下面合成路线判断烃A为
A(烃类)BC
A.1﹣丁烯 B.乙烯
C.乙炔 D.1,3﹣丁二烯
15.Cu的化合物种类繁多,在人类的生产生活中有着广泛的应用,实验测得一种Cu与Br形成的化合物沸点为1345℃,晶胞结构如图所示(黑球代表铜,晶胞的密度为ρ g·cm-3,设为阿伏加德罗常数的值),下列说法正确的是
A.晶体的化学式为CuBr2
B.晶体中与Br最近且距离相等的Br有6个
C.Cu与Br之间的最短距离为
D.该化合物为共价晶体
二、填空题
16.物质的组成与结构决定了物质的性质与变化。回答下列问题:
(1)基态氮原子核外未成对电子数为 。
(2)在元素周期表中,N、O、F位于同周期且相邻,第一电离能最大的元素和最小的元素组成一种只含极性键的化合物M,M分子的空间构型是 ,中心原子的杂化类型是 。
(3)能与多种金属离子形成配合物。例如,工业冶炼金的原理:,中含 mol键。
(4)钛酸钙晶胞结构如图所示。钛酸钙的化学式为 ;1个钛离子与 个氧离子等距离且最近,连接这些氧离子构成正八面体,钛离子位于该正八面体的体心。
(5)在元素周期中,钡位于第六周期Ⅱ A族。钛酸钡、钛酸钙的熔点分别为1610℃、1975℃,解释其熔点差异的原因: 。
17.有机物种类繁多、结构复杂。以下是10种常见的有机物,请根据要求回答下列问题。
① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
(1)以上属于芳香烃的是 (填序号)。
(2)某烃与氢气加成后得到①,该烃的结构简式可能有 种。
(3)②分子中最多有 个碳原子在同一直线上。
(4)③的系统命名为 。
(5)④属于 (填“醇类”或“酚类”)。
(6)⑤能与碳酸钠溶液反应放出无色无味气体,写出反应的化学方程式 。
(7)⑥与⑤的关系为 (填“同系物”或“同分异构体”,下同);⑦和⑨的关系为 。
(8)⑧的一氯代物有 种,其中一种一氯代物的核磁共振氢谱显示有4组峰,且峰面积比为3:4:4:2,写出该一氯代物的结构简式 。
三、解答题
18.氮、镓、砷等元素的单质及其化合物在生产生活中应角广泛。回答下列问题:
(1)是一种优良的等离子蚀刻气体,在芯片制造等方面有广泛应用。分子的空间构型为 。
(2)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类以,每个铝原子与 个氮原子相连,氮化铝晶体属于 晶体。
(3)M是氮杂氟硼二吡咯类物质,常用作光敏剂,其结构如图。
已知虚线框内五元环结构类似苯,存在五中心六电子离域大键,则虚线框中氮元素采用杂化方式为 ,M中存在的微粒间作用力有 (填标号)。
A.共价键 B.离子键 C.氢键 D.配位键
(4)是一种重要的半导体材料,晶胞结构如图。
已知图中a原子的分数坐标为,则b原子的分数坐标为 ;若晶体密度为,设为阿伏加德罗常数的值,则晶体中两个原子间的最短距离为 (列出计算式即可)。
19.化合物M是一种重要的有机合成中间体,其合成路线如图所示:
已知:①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
②。
回答下列问题:
(1)A→B的反应条件为 ,B的名称为 (系统命名法),B→C的反应类型为 。
(2)Y中含有的官能团名称为 ,Z的结构简式为 。
(3)C→D的化学方程式为 。
(4)W是X的同系物,相对分子质量比X大14,则W的同分异构体有 种。
(5)根据上述信息,写出以为主要原料制备的合成路线 。
参考答案
1.B
A.太阳能电池阵可将太阳能转变成电能,A错误;
B.该发条由钼钴镍铬等元素组成,其材质属于合金,B正确;
C.碲元素在ⅥA族,不是过渡元素,C错误;
D.烟花绽放时的五彩缤纷是利用了金属原子的发射光谱,D错误;
故答案选B。
2.C
A.已知C是6号元素,根据洪特规则可知,基态C原子核外价电子的轨道表达式:,A错误;
B .NH3分子中中心原子N周围的价层电子对数为:3+=4,根据价层电子对互斥理论可知,其VSEPR模型为:,B错误;
C.已知HClO是共价化合物,H、Cl周围能够形成1对共用电子对,O周围能够形成2对共用电子对,故HClO的电子式为:,C正确;
D.和是质子数相同而中子数不同的原子,故互为同位素,D错误;
故答案为:C。
3.C
A.的稳定性高于是由于O-H键键能更高,而非氢键,氢键影响物理性质(如熔沸点),与热稳定性无关,A错误;
B.为V形极性分子,为非极性分子。极性分子通常更易溶于极性溶剂(如水),因此溶解度应大于,B错误;
C.的结构为H-O-O-H,O-O单键和O-H键均为σ键,无π键,描述正确,C正确;
D.甲酸(HCOOH)酸性强于乙酸(),烷基(如-CH3)的推电子效应会减弱羧酸中O-H的极性,抑制H+解离,降低酸性,结论与原因均错误,D错误;
故选C。
4.D
A.,含羧基的主链上有5个C,支链有一个甲基,一个羟基,正确命名应是4-甲基-3-羟基戊酸,A错误;
B.酯化反应的脱水过程是“酸脱羟基醇脱氢”,故CH3COOH与CH3CH218OH发生酯化反应生成的酯是CH3CO18OCH2CH3,B错误;
C.乙酸的官能团是羧基,苯酚的官能团是酚羟基,二者分子中的官能团不同,C错误;
D.用新制的Cu(OH)2鉴别这4种物质的方法:向这四种溶液中分别滴入适量新制的Cu(OH)2悬浊液,室温下能使新制的Cu(OH)2悬浊液溶解的是甲酸、乙酸,不能使其溶解的是甲醇、乙醛,再将两组溶液分别加热,能产生红色沉淀的是甲酸(溶解)、乙醛(不溶解),不能产生红色沉淀的是甲醇(不溶解)、乙酸(溶解),D正确;
故选D;
5.C
A.甲苯与液溴(FeBr 催化):发生苯环上取代反应,甲基邻/对位的C-H键断裂,生成HBr,存在C-H键断裂,A不符合题意;
B.溴乙烷与NaOH乙醇溶液共热:发生消去反应,脱去β-H和Br形成乙烯,β-C的C-H键断裂,存在C-H键断裂,B不符合题意;
C.乙烯与Br /CCl 反应:发生加成反应,双键打开直接与Br 结合生成1,2-二溴乙烷,反应中仅涉及双键断裂,无C-H键断裂,C符合题意;
D.乙醇与浓硫酸(170℃):发生分子内脱水生成乙烯,需脱去β-H(C-H键断裂),存在C-H键断裂,D不符合题意;
故选C。
6.A
已知乙炔基中碳原子为sp杂化,为直线形结构,则与乙炔基相连的C原子共线,则共有3个;苯环上的碳原子和碳碳双键两端的碳原子均为sp2杂化,碳原子形成的三条键为平面三角形,则可能共面的碳原子最多为14;饱和的碳原子为sp3杂化,此有机物中乙基、甲基及甲基所在的C原子中共计6个碳原子为四面体结构,故本题选A。
7.C
分子式为的同分异构体中含醛基,故可看成-CHO取代C4H9Cl上的一个氢原子,分子式为 C4H9Cl的同分异构体主链有4个碳原子的: CH3CH2CH2CH2Cl,-CHO取代有4种;CH3CH2CHClCH3,-CHO取代有4种;主链有3个碳原子的:CH3CH(CH3)CH2Cl,-CHO取代有3种;CH3CCl(CH3 )2,-CHO取代有1种,则共有12种,故选C。
8.D
A.CH3OH与水分子能形成分子间氢键,所以CH3OH易溶于水,故不选A;
B.对羟基苯甲醛易形成分子间氢键,邻羟基苯甲醛易形成分子内氢键,所以对羟基苯甲醛的沸点高于邻羟基苯甲醛,故不选B;
C.冰的密度小于水是因为冰中水分子间形成氢键增多,故不选C;
D.甲基为推电子基,对甲基苯酚中羟基的极性减弱,氯原子为吸电子基,对氯苯酚中羟基的极性增强,所以、、的酸性依次增强,故选D;
选D。
9.C
能够发生消去反应,需要—OH所连碳原子的相邻碳上有H,能够发生氧化且生成醛,则要求—OH所连接的碳原子上至少有两个H,据此分析;
A.HOCH2C(CH3)3不能发生消去反应,A错误;
B.不能发生消去反应,B错误;
C.(CH3)3CCH2CH2OH既能发生消去反应,又能发生催化氧化反应生成醛,符合题意,C正确;
D.(CH3)2CHOH不能发生催化氧化反应生成醛,D错误;
故选C。
10.C
A.由于F的电负性比Cl大,吸引电子的能力更强,三氟乙酸羧基中的O-H键的极性更大,更易电离出H+,酸性更强,故A正确;
B.CS2相对分子质量比CO2大,CS2的范德华力更大,熔点更高,故B正确;
C.稳定性:H2O>H2S,是因为键能H-O>H-S,与氢键无关,故C错误;
D.18-冠-6(冠醚)空腔的直径与K+直径相当,与Li+的直径不匹配,因此能够与K+形成超分子,却不能与Li+形成超分子,故D正确;
故选C。
11.A
A.离子晶体的晶格能大小取决于离子半径和电荷,离子半径越小,电荷越多,晶格能越大,离子晶体的熔点越高,半径:Cl-
C.分子结构相似,且都为分子晶体,分子的相对分子质量越大,分子之间作用力越大,熔点越高,则有CH4<SiH4<GeH4,C错误;
D.碱金属从上到下,原子半径逐渐增大,金属键键能逐渐减小,金属晶体的熔点逐渐降低,则有熔点:K<Na<Li,D错误;
故选A。
12.B
由烷烃的通式为CnH2n+2可得:CnH2n+2—O2,1mol烷烃在氧气中充分燃烧消耗标准状况下179.2 L氧气,则由关系式可得:=,解得n=5,CH3CH2CH2CH2CH3、在光照的条件下与氯气反应生成一氯代物的数目分别为3、4,则烷烃的结构简式为CH3CH2CH2CH2CH3,故选B。
13.B
A.Co3+的价电子排布式为3d6,含有空轨道,NH3分子和Cl离子含有孤电子对,根据配位键形成条件可知,[Co(NH3)5Cl]Cl2中中心离子为Co3+,配体是NH3分子和Cl离子,A错误;
B.配合物Fe(CO)5中,中心原子是Fe,CO是配体,1个分子中含有5个配位键;每个CO中含有一个配位键,则1mol Fe(CO)5配合物中含有10mol配位键,B正确;
C.K4[Fe(CN)6]、[Ag(NH3)2]OH都是配合物,但NH4Cl不是配合物、无中心原子,C错误;
D.配合物[TiCl(H2O)5]Cl2 H2O的中心离子为Ti3+,溶于水能电离出2个Cl-,则1mol该配合物与足量AgNO3溶液反应生成2mol AgCl沉淀,D错误;
故选B。
14.B
由反应条件、目标物的结构简式可知,烃A与溴发生加成反应生成B,B发生卤代烃的水解反应生成C,2分子C之间脱去2分子水生成目标物,推知A为CH2=CH2、B为BrCH2CH2Br、 C为HOCH2CH2OH,则烯烃A的名称为乙烯。
故选B。
15.C
A.根据均摊法可知,晶胞中白球和黑球的数目均为4,故化学式为CuBr,故A项错误;
B.由图可知,溴位于晶胞顶角,其周围最近且距离相等的溴位于面心,有12个,故B项错误;
C.晶胞的质量为g,设晶胞参数为a cm,则晶体的密度为,,Cu原子与Br原子之间的最短距离为体对角线的,即Cu原子与Br原子之间的最短距离为,故C项正确;
D.溴化亚铜为离子晶体,故D项错误;
故本题选C。
16.(1)3
(2) V形 sp3
(3)8
(4) 6
(5)钛酸钡、钛酸钙都是离子晶体,半径小于,钛酸钙的晶格能大于钛酸钡
(1)氮元素的原子序数为7,价电子排布式为2s22p3,p轨道上有3个未成对电子;
(2)同周期元素,从左到右第一电离能呈增大趋势,氮原子的2p轨道为稳定的半充满结构,元素的第一电离能大于相邻元素,则第一电离能由大到小的顺序:F>N>O,氟元素和氧元素形成的化合物OF2分子中氧原子的价层电子对数:,含2对孤电子对,分子的空间构型为V形,原子的杂化方式为sp3杂化;
(3)配离子中配位键属于键,氰酸根离子的结构中有碳氮三键,碳氮三键中含有1个键和2个π键,所以配离子中含有8 mol键;
(4)根据均摊法计算:Ti位于8顶点,共有,Ca位于晶胞内部,共有1个,O位于棱上,共有,化学式:;由晶胞结构可知,1个位于顶点的钛离子与6个位于棱上的氧离子等距离且最近,连接这些氧离子构成正八面体,钛离子位于该正八面体的体心;
(5)钛酸钡、钛酸钙都是离子晶体,钙离子的离子半径小于钡离子,钛酸钙的晶格能大于钛酸钡,熔点高于钛酸钡。
17.(1)⑦⑨
(2)2
(3)3
(4)2-甲基-2-戊烯
(5)醇类
(6)2+Na2CO32+H2O+CO2↑
(7) 同分异构体 同系物
(8) 5
(1)芳香烃是含有苯环的烃,属于芳香烃的是⑦⑨;
(2)
某烃与氢气1:1加成后得到①,则该烃中应该含有1个碳碳双键,该烃的结构简式,有2种;
(3)碳碳叁键直接相连的原子共线,②分子中最多有3个碳原子在同一直线上;
(4)有机物系统命名法步骤:①最长-选最长碳链为主链;②最多-遇等长碳链时,支链最多为主链;③最近-离支链最近一端编号;④最小-支链编号之和最小(两端等距又同基,支链编号之和最小);⑤含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,并表示出官能团的位置,官能团的位次最小。③的系统命名为2-甲基-2-戊烯;
(5)④中羟基在支链上,属于醇类;
(6)
⑤中含羧基,能与碳酸钠溶液反应放出无色无味气体二氧化碳,同时生成羧酸钠和水,反应的化学方程式:2+Na2CO32+H2O+CO2↑;
(7)⑥与⑤的分子式相同,结构不同,两者互为:同分异构体;⑦和⑨结构相似,两者相差2个CH2,则两者互为同系物;
(8)
如图分子含有5种氢,其一氯代物有5种,其中一种一氯代物的核磁共振氢谱显示有4组峰,且峰面积比为3:4:4:2,则其结构对称,该一氯代物的结构简式。
18.(1)三角锥形
(2) 4 共价
(3) sp2 AD
(4)
(1)NF3价层电子对=,孤电子对1对,可知中心原子N采取sp3杂化,所以NF3的分子的空间构型为三角锥形;
(2)氮化铝晶体与金刚石类似,均是正四面体结构,每个铝原子与4个氮原子相连;AlN晶体与金刚石类似,属于共价晶体;
(3)环上N原子价层电子对数为3,采取sp2杂化,该环N原子价层孤对电子填充在2sp轨道;原子之间存在共价键,环上N原子与B原子之间形成配位键,不含氢键与离子键,故答案为AD;
(4)图1中A原子的坐标为,则B原子在x轴的,y轴的,z轴的,故分数坐标为;图中晶体密度为,由图可知一个晶胞中含有Ga的个数为:个,含有As原子个数为:4个,根据,则晶胞边长为:a=,由图可知晶胞中距离最近的两个As原子间距离为面对角线的一半,即。
19.(1) 氢氧化钠、乙醇、加热 甲基丙烯 加成反应
(2) 氯原子、(酚)羟基
(3)
(4)9
(5)
由M()逆推可知,E是(CH3)2CHCOOH,Z为,X的分子式为C7H8O,可知X的结构简式为,在光照条件下与氯气按物质的量之比1:2反应,甲基中的2个H被Cl取代,因此Y的结构简式为 ,Y→Z是水解反应;E是(CH3)2CHCOOH逆推,A的分子式为C4H9Cl,A→B是消去反应,所以B是(CH3)2C=CH2,B→C是加成反应,C是(CH3)2CHCH2OH,C→D是氧化反应,D是( CH3)2CHCHO,D→E是氧化反应,Z→E是酯化反应;据此分析;
(1)A→B是卤代烃的消去反应,反应条件为氢氧化钠、乙醇、加热;B是(CH3)2C=CH2名称为甲基丙烯; B是(CH3)2C=CH2,C是(CH3)2CHCH2OH,B→C的反应类型为加成反应;
(2)
Y的结构简式为,含有的官能团名称为氯原子、(酚)羟基;Z的结构简式为;
(3)C是(CH3)2CHCH2OH,D是( CH3)2CHCHO,C→D的化学方程式为;
(4)
X的结构简式为,W是X的同系物,相对分子质量比X大14,则W的分子中含有酚羟基,取代基①乙基和羟基,邻间对三种;②羟基和两个甲基,6种,共9种;
(5)
由逆推法可知得到需要催化氧化,需要加成得到,消去可得到,合成路线为:;
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
