盐类水解教学设计
图片预览


文档简介
《盐类的水解》教学设计
【教材分析】
盐类水解内容包括三个部分,分别是:盐类的水解规律、影响盐类水解的因素以及盐类水解的应用。本节课的教学设计主要是第一部分内容——盐类的水解规律。
本节内容是在学生已经学习过强弱电解质的电离、水的电离平衡以及化学平衡移动原理等知识基础上的综合应用。本节的教学与前面的教学有密切的联系,学生对前面所学知识的理解程度将直接影响本节的学习。在后面的教材编排中,有很多地方也要用到盐类水解的相关知识。
盐类水解的实质比较抽象,须要引导学生先由实验来学习。再由具体实例归纳出盐的组成与盐溶液酸碱性的关系,最后从理论上探究盐类水解的规律。帮助学生实现从具体认识到通性认识的转变,形成一种思维升华。
【学情分析】
学习本节内容前,学生已经对离子反应,强弱电解质的电离,化学平衡的建立以及水的电离和溶液的酸碱性等知识有了一定的基础,具备了分析溶液中各种离子水解平衡的能力。
由于学生连续学了两章全新的理论知识,这些知识没有元素化合物的知识形象,且难度也较大,这时学生心理上难免会产生一定的疲倦感和畏惧感。教师的教学应尽可能多地加入互动以提高学生的学习参与度与积极性。
【教学目标】
(1) 学生可以理解盐类水解的实质,能解释强酸弱碱盐和强碱弱酸盐的水解原因和差别。
(2) 能应用盐类水解规律判断盐溶液酸碱性。
(3) 学会书写盐类水解的离子方程式。
【教学重难点】
重点:盐类水解的实质及盐溶液酸碱性规律。
难点:令学生理解盐类水解的实质,在从现象到本质,再从具体实例总结出一般规律的过程中,培养学生归纳和理解能力
【教学流程】
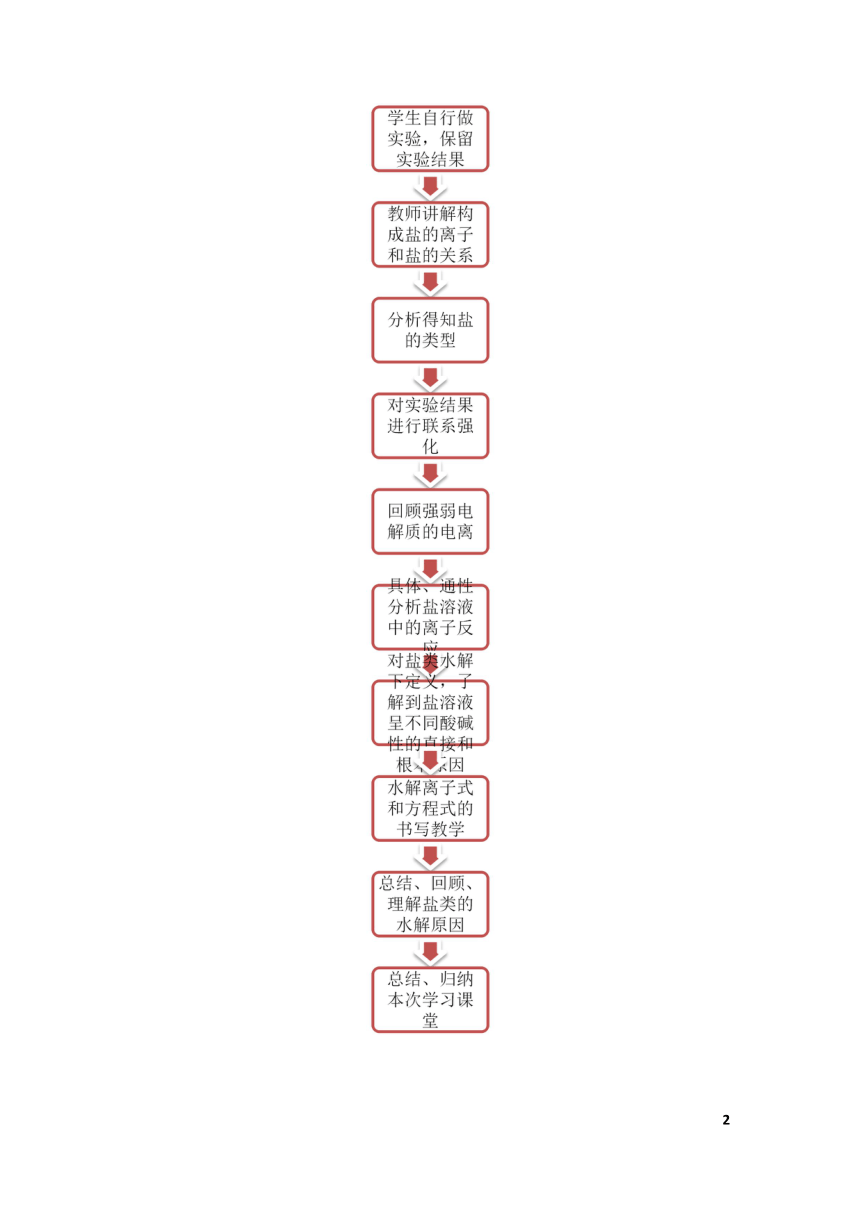
在下图,我采用流程图的方式进行表达。
以实验探究作为引入 【提问】同学们好,咱们今天学习的内容和盐有关。说起盐,大家最快能想到的是什么盐呢? 【提问】没错,咱们生活中最常见的盐就是食盐——主要成分是氯化钠,那么氯化钠是属于酸性还是碱性呢? 【引导】大家说得没错。尽管食盐是中性的物质也是最常见的盐,但是生活中还有更多的盐,其酸碱性也并不局限于中性,大家有所了解吗 【讲解实验要求】既然大家对生活中各种盐的相关性质并不太了解,那咱们就来探究一下吧!现在每两位同学为一小组,摆放在每个小组面前的是七种盐,量筒一个,小试管7个,试管夹一个,玻璃管一根,比色卡以及pH试纸若干。七种盐分别是氯化钠,碳酸钠,碳酸氢钠,氯化铵,醋酸钠以及硫酸铵。实验中,每组同学取一勺盐溶于5ml水中,充分振荡溶解以后用玻璃棒蘸取溶液测其pH,在表格内填入该种盐的水溶液的酸碱性。好的,请大家分组进行实验吧,注意不要玻璃仪器打破了。 【观察学生实验,指导】好的,咱们的实验就到这里暂停一下,请大家保存好刚才所测试的ph试纸,咱们来对实验现象进行分析和学习。 【回答】食盐。 【回答】都不是,氯化钠是中性的物质。 【尝试回答】苏打和小苏打也是盐。 【分组实验】两人合作实验,溶液盐后测试ph,再将其酸碱性填入表格内。 完成测量后示意教师。 采取实验的方式作为引入,让学生在极强的学习兴趣推动下对本次学习产生积极性。
引导学生思考,进行盐的种类初步探究 【提问】大家知道盐是如何构成的吗? 【引导】没错,盐一般都是由(金属)阳离子和(酸根)阴离子构成的,然而不同的阴阳离子组合在一起,构成的盐也具有不同的性质。为了表示不同性质的盐,我们从构成的离子入手进行分析。 【讲解盐分类和离子的关系】我们常说,比如第一主族的金属元素具有碱性,这也就间接地说明,金属离子可以和氢氧根结合生成碱,而碱有强弱之分;类比一下,酸根离子是显负性的离子,可以和氢离子结合生成强弱不同的酸。这个时候,盐的性质就能从组成的离子相关的强弱酸碱来解释了——把阴阳离子相关的“强弱酸碱性”结合起来,就可以得知构成离子的酸碱性质。大家将这里重点记忆一下,现在和老师一起看一下实例。 【举例】醋酸钠由钠离子和醋酸根离子组成,钠离子结合氢氧根后生成强碱氢氧化钠,醋酸根结合氢离子后生成弱酸醋酸。由此可知,醋酸钠是一个强碱弱酸盐。 【提问】请同学们尝试一下,那么氯化钠和氯化铵分别是什么性质的盐呢? 【反馈回答】没错,但是大家需要注意下,在表达盐的性质的时候,一般说强X弱Y盐,先说显强性的部分哦。 【尝试回答】由金属阳离子和酸根离子或者阴离子构成的。 【记录笔记】 【回顾】回顾第一主族元素如钠,就可以和水发生反应生成氢氧化钠。钠也被称作碱金属。理解老师为什么说金属阳离子要和氢氧根结合。 【记笔记】积累知识。 【倾听】 【回答】氯化钠是强酸强碱盐,氯化铵是弱酸强碱盐。 【记笔记】 先不就刚才的实验现象具体分析酸碱性,而是从通性上对盐的构成进而分析盐的性质,离子的性质影响组成的物质的性质,逐步递进,给学生反应和推导的过程和时间,使其能更好地理解盐类性质不同的原因。
回到实验,利用刚才所学的盐的分类对七种盐进行描述,再结合盐溶液的酸碱性进行总结 【布置任务】实验所使用的七种盐结合刚才咱们所学的盐的分类,请大家在“盐的类型”一行中写下你们的答案。并且老师请一位同学上台来分享ta的分类,并且填上ta的ph试纸测试结果。 【结果验证】好的,谢谢这位上台的同学,现在咱们一起验证一下。氯化钠是强酸强碱盐,水溶液显中性(余下六中盐和盐溶液表达如上)……同学们和这位同学和老师的结果相同吗?如果有不同的,请举手说明? 【提问】请同学们观察盐的类型和溶液的酸碱性,有没有发现什么规律?咱们请一位同学来说说他的想法。 【反馈并设问】没错,盐的类型确实影响到了溶液的酸碱性,似乎看起来是显强性的离子使得水溶液显同样的酸碱性呢。那么现在问题来了,盐的类型里所说的强弱到底有什么意义?这样的性质差别体现在什么地方呢?让咱们继续探究构成盐的离子性质不同带来的影响吧,接下来就要说到盐类在水溶液中发生的反应了。 座位上的学生自行填写盐溶液的酸碱性和盐的类型,上台的同当众写出自己的实验结果和分类结果。 【核对结果】如有不同或者不理解的可以举手提问。 【回答】如果是强酸弱碱盐,水溶液是酸性,如果是强碱弱酸盐,水溶液是碱性;如果是强酸强碱盐,水溶液就是中性。 尽量发挥学生的主体性,经过简单的盐的分类的学习后先让学生自行分类,再有典型学生上台书写自己的分类结果,并由教师对结果进行讲解,强化了学生的记忆和理解结果。 不直接讲实验结果,反而让学生先有一次尝试再让老师说出答案,课堂更生动,学习更活泼。
回顾强弱电解质的区别,尝试建立电离和水解的可逆关系 【回顾】老规矩,因为电离和水解具有密切的关系,咱们要探究盐类水解就不得不说到物质的电离。 【提问】同学们简单说一下,强弱电解质的电离有什么不同?常见的强电解质和弱电解质有哪些呢? 【小结】没错,强电解质如强酸、强碱、盐都是发生完全电离的,在水中没有物质“残留”,全都电离成离子。而弱电解质无法完全电离,原物质分子和电离出的离子共存在水溶液中,分子的电离是一个可逆反应。比如图片上的盐酸和醋酸就是典型的强电解质和弱电解质。 【提问并强调】老师再问问同学们,咱们今天探究的盐是强电解质还是弱电解质?电离完全吗? 【建立电离和水解联系】既然咱们说弱电解质是不完全电离,以弱酸HY为例,也就是说HY可以部分电离出H+和Y-,而Y-可以和H+再结合而可逆地生成HY分子。 【设问并引导】大家大胆猜想,既然弱电解质电离出的离子可以可逆地形成弱电解质,那么盐电离后生成的显弱性的离子是否也会结合水溶液中的其他离子、可逆地生成弱电解质呢?如果这个反应是存在的,对溶液的性质又有什么影响呢?电离和盐溶液中发生的反应有关联吗? 【思考】 【回答】强电解质在水溶液或者熔融状态下完全电离,常见的有强酸、强碱、盐。弱电解质相应地发生不完全电离,常见的是弱酸和弱碱。 【回顾知识点,加强记忆】 【回答】是强电解质,在水溶液中完全电离。 【倾听】注意听老师所举的例子,思考“弱离子”是否也会可逆地变回弱电解质,并且对溶液会有什么影响?电解和盐溶液中发生的反应有什么关系呢? 盐类的水解和物质的电离有密切联系,基本可以说盐的水解是物质电离的逆反应。故而此处回顾电离,并从电离的逆反应入手,让学生强化理解只有弱电解质电离出的离子会可逆地生成弱电解质,进而思考盐溶液体现不同酸碱性是因为有离子反应发生,而离子反应和离子是否发生电离的逆反应有关。
以强酸强碱盐为例进行具体分析 【提问】同学们,氯化钠咱们知道是什么盐呀? 【逐步分析】没错,是强酸强碱盐并且也是强电解质,也即氯化钠可以在水中发生完全电离生成钠离子和氯离子。与此同时,因为水作为溶剂不可忽略,水也会发生微弱的可逆电离生成氢离子和氢氧根离子。 【提问】请大家在草稿纸上写出氯化钠溶于水后,溶液中存在的分子和离子,并分析这几种离子是否能共存? 【具体分析】没错,氯化钠溶于水得到的溶液中所有离子可以共存而不发生反应,因此水电离后的等量氢离子和氢氧根离子浓度仍然相等,水溶液的酸碱性保持为中性。 【回答】强酸强碱盐。 【跟随老师写出电离式】 【倾听,思考】 书写出离子,并【回答】可以共存。 【倾听,理解强酸强碱盐的水溶液显中性的原因】 具体分析情况比较简单的强酸强碱盐,让学生有一个大致的印象——盐溶液的酸碱性和溶液中离子是否共存、发生反应有直接联系。
以强碱弱酸盐微粒进行具体分析 【点明】下一步咱们来看一个常见的强碱弱酸盐,醋酸钠。 【布置任务】请大家按照刚才的氯化钠分析,写出盐的电离及其逆反应,还有水的电离反应。 【提问】同学们再写出溶液中存在的离子,并告诉老师,这些离子可以共存吗? 【反馈】没错,溶液中的离子会发生反应,醋酸根离子会和溶液中的氢离子结合。 【提问】既然氢离子被醋酸根离子结合,那么大家猜想,溶液中的、由水电离提供的氢离子和氢氧根离子还相等吗?如果不等,哪种离子更多?对溶液的酸碱性有影响吗? 【具体分析】是的,让我们来具体看一下。首先,醋酸钠是完全电离的盐,而其完全电离出的醋酸根离子是“弱的”,可以和溶液中的氢离子结合成醋酸分子,也可以看做是醋酸电离的逆反应!因为氢离子被消耗,留下较多的氢氧根离子故而溶液才体现碱性。钠离子和氢氧根离子共存,并不发生反应。 【通性分析】通过上述分析,咱们可以发现——强酸强碱相应的离子不会和氢离子、氢氧根离子结合发生反应,而弱酸弱碱相应的离子却可以结合氢离子、氢氧根离子后生成弱电解质。 【小结】至此,大家应该对盐溶液体现不同酸碱性的原因有了明白的感知了吧? 【倾听,了解任务要求】 书写电离反应,电离逆反应以及水的电离反应。 【回答】不可以共存,醋酸根离子会和氢离子结合生成醋酸分子。 【回答】不再相等了,氢离子被消耗,即氢氧根离子浓度更大,使得溶液整体显碱性。 【倾听、理解】 记录并理解实验中的反应,只有弱酸弱碱对应的离子会发生电离的逆反应,而强酸强碱对应的离子可以在溶液中共存而不发生反应。 【理解,记笔记】 先具体分析强碱弱酸盐的溶液情况,再通过通性地分析盐溶液的酸碱性与离子之间的关系,让学生了解到:溶液的酸碱性来源于其中的氢离子和氢氧根离子浓度不等,更深的原因是弱电解质的离子会结合氢离子、氢氧根离子而发生电离的逆反应。
定义盐类的水解 【陈述】综上咱们可以知道,当盐溶于水时,其电离产生的“弱”阴阳离子可分别和水电力产生的氢离子、氢氧根离子结合生成弱电解质,也即弱酸或弱碱;盐与水发生的这种反应就叫做盐类的水解,在书写水解离子式时,常看作是离子和水发生的反应。 【练习】现在请大家尝试书写一下,强碱弱酸盐如醋酸钠,强酸弱碱盐如硫酸铵的水解离子式,并告诉老师二者的水溶液显什么性质? 【反馈练习结果】 【分析和理解】经过本次的学习,现在老师要带领同学们一起对盐类水解进行总结和理解。 1. 发生水解的部分一定是“弱酸”或“弱碱”离子,水解得到的是弱电解质分子。也可以理解为“弱离子”电离的逆反应。 2.强酸强碱盐不发生水解:其电离出的离子不与水电离出的H+和OH-结合。可以理解为这些不发生水解的离子可以共存,故而在书写离子方程式时不用写。 3.盐的水溶液的酸碱性不同,是因为溶液内的H+和OH-的浓度大小不同(直接原因),而更深层的原因是盐电离出的离子与水的反应(根本原因)。 4.可以从盐的类型直接看出盐的水溶液的酸碱性——口诀“谁强显谁性”。 5.注意电子守恒。 【倾听,记笔记】 【书写离子式】 【回答】分别显碱性和酸性。 【倾听】 【将老师所讲的注意事项和重点记录下来】 此处因为学生的自主归纳总结能力有限,主要以教师讲授为主,将总结的知识点和注意事项以条例的形式传授给学生,总结和概括本次“盐类水解第一学时”的学习内容和规律。 高度凝练,极简而可以体现本次学习的全部内容。
强化水解离子式的训练,并设置悬念,引出下次学习的多级水解 【布置任务】经过本次学习,咱们就用水解离子式来训练和总结一下。请同学们只写出盐的水解离子式和方程式,不用管盐的电离式。(碳酸氢钠,醋酸钠,碳酸钠) 【引导】碳酸钠的水解涉及到多级水解,请同学们先尝试书写一下,下课后复习多元弱酸的电离,咱们下节课继续讲解。 【反馈练习结果并适当讲解易错点】 草稿纸上书写要求的离子式和方程式。 【听取要求,下课后自行复习】 【核对正误,听取讲解】 用实际训练的方法作为学生本次学习的结尾,提高学生的学习效率和知识运用的能力。
教师回顾总结课堂学习内容 【设问】同学们,咱们这节课讲了些什么呢? 【回答】没错,咱们先自行动手做实验,了解了七种盐的水溶液的酸碱性;再通过构成盐的离子性质学习了解到不同的盐具有不同类型;进而了解到盐在水溶液中可能发生水解反应而影响溶液酸碱性;最后则学习了水解离子式和方程式的书写。 【倾听】 【思考】 【记笔记】 以教师的角度更为凝练地总结本次教学的主要流程和内容。
补充说明,结束教学 【补充并强调】在结束本次教学之前,老师需要再次强调,一定要分辨清强弱电解质的电离,以及盐类的水解之间的区别,其中可以是完全发生的反应,也可以是可逆反应;反应的产物可能会相同,但是发生的反应不一定也相同! 【结束】好的,本次“盐类的水解”第一部分课程就上到这里,咱们下课! 【倾听】 强调易错点,结束本次教学。
设计反思
教学设计较学期内的设计多了一些师生互动和问答,但经和同伴沟通以后认为留给学生反应时间仍然较短,可以将问题再分散一些、给学生更多的反应空间时间。
习题设计偏重于离子式的书写而忽略了文字性知识点的重要性。
教学环节之间的承接较为生硬。
2
【教材分析】
盐类水解内容包括三个部分,分别是:盐类的水解规律、影响盐类水解的因素以及盐类水解的应用。本节课的教学设计主要是第一部分内容——盐类的水解规律。
本节内容是在学生已经学习过强弱电解质的电离、水的电离平衡以及化学平衡移动原理等知识基础上的综合应用。本节的教学与前面的教学有密切的联系,学生对前面所学知识的理解程度将直接影响本节的学习。在后面的教材编排中,有很多地方也要用到盐类水解的相关知识。
盐类水解的实质比较抽象,须要引导学生先由实验来学习。再由具体实例归纳出盐的组成与盐溶液酸碱性的关系,最后从理论上探究盐类水解的规律。帮助学生实现从具体认识到通性认识的转变,形成一种思维升华。
【学情分析】
学习本节内容前,学生已经对离子反应,强弱电解质的电离,化学平衡的建立以及水的电离和溶液的酸碱性等知识有了一定的基础,具备了分析溶液中各种离子水解平衡的能力。
由于学生连续学了两章全新的理论知识,这些知识没有元素化合物的知识形象,且难度也较大,这时学生心理上难免会产生一定的疲倦感和畏惧感。教师的教学应尽可能多地加入互动以提高学生的学习参与度与积极性。
【教学目标】
(1) 学生可以理解盐类水解的实质,能解释强酸弱碱盐和强碱弱酸盐的水解原因和差别。
(2) 能应用盐类水解规律判断盐溶液酸碱性。
(3) 学会书写盐类水解的离子方程式。
【教学重难点】
重点:盐类水解的实质及盐溶液酸碱性规律。
难点:令学生理解盐类水解的实质,在从现象到本质,再从具体实例总结出一般规律的过程中,培养学生归纳和理解能力
【教学流程】
在下图,我采用流程图的方式进行表达。
以实验探究作为引入 【提问】同学们好,咱们今天学习的内容和盐有关。说起盐,大家最快能想到的是什么盐呢? 【提问】没错,咱们生活中最常见的盐就是食盐——主要成分是氯化钠,那么氯化钠是属于酸性还是碱性呢? 【引导】大家说得没错。尽管食盐是中性的物质也是最常见的盐,但是生活中还有更多的盐,其酸碱性也并不局限于中性,大家有所了解吗 【讲解实验要求】既然大家对生活中各种盐的相关性质并不太了解,那咱们就来探究一下吧!现在每两位同学为一小组,摆放在每个小组面前的是七种盐,量筒一个,小试管7个,试管夹一个,玻璃管一根,比色卡以及pH试纸若干。七种盐分别是氯化钠,碳酸钠,碳酸氢钠,氯化铵,醋酸钠以及硫酸铵。实验中,每组同学取一勺盐溶于5ml水中,充分振荡溶解以后用玻璃棒蘸取溶液测其pH,在表格内填入该种盐的水溶液的酸碱性。好的,请大家分组进行实验吧,注意不要玻璃仪器打破了。 【观察学生实验,指导】好的,咱们的实验就到这里暂停一下,请大家保存好刚才所测试的ph试纸,咱们来对实验现象进行分析和学习。 【回答】食盐。 【回答】都不是,氯化钠是中性的物质。 【尝试回答】苏打和小苏打也是盐。 【分组实验】两人合作实验,溶液盐后测试ph,再将其酸碱性填入表格内。 完成测量后示意教师。 采取实验的方式作为引入,让学生在极强的学习兴趣推动下对本次学习产生积极性。
引导学生思考,进行盐的种类初步探究 【提问】大家知道盐是如何构成的吗? 【引导】没错,盐一般都是由(金属)阳离子和(酸根)阴离子构成的,然而不同的阴阳离子组合在一起,构成的盐也具有不同的性质。为了表示不同性质的盐,我们从构成的离子入手进行分析。 【讲解盐分类和离子的关系】我们常说,比如第一主族的金属元素具有碱性,这也就间接地说明,金属离子可以和氢氧根结合生成碱,而碱有强弱之分;类比一下,酸根离子是显负性的离子,可以和氢离子结合生成强弱不同的酸。这个时候,盐的性质就能从组成的离子相关的强弱酸碱来解释了——把阴阳离子相关的“强弱酸碱性”结合起来,就可以得知构成离子的酸碱性质。大家将这里重点记忆一下,现在和老师一起看一下实例。 【举例】醋酸钠由钠离子和醋酸根离子组成,钠离子结合氢氧根后生成强碱氢氧化钠,醋酸根结合氢离子后生成弱酸醋酸。由此可知,醋酸钠是一个强碱弱酸盐。 【提问】请同学们尝试一下,那么氯化钠和氯化铵分别是什么性质的盐呢? 【反馈回答】没错,但是大家需要注意下,在表达盐的性质的时候,一般说强X弱Y盐,先说显强性的部分哦。 【尝试回答】由金属阳离子和酸根离子或者阴离子构成的。 【记录笔记】 【回顾】回顾第一主族元素如钠,就可以和水发生反应生成氢氧化钠。钠也被称作碱金属。理解老师为什么说金属阳离子要和氢氧根结合。 【记笔记】积累知识。 【倾听】 【回答】氯化钠是强酸强碱盐,氯化铵是弱酸强碱盐。 【记笔记】 先不就刚才的实验现象具体分析酸碱性,而是从通性上对盐的构成进而分析盐的性质,离子的性质影响组成的物质的性质,逐步递进,给学生反应和推导的过程和时间,使其能更好地理解盐类性质不同的原因。
回到实验,利用刚才所学的盐的分类对七种盐进行描述,再结合盐溶液的酸碱性进行总结 【布置任务】实验所使用的七种盐结合刚才咱们所学的盐的分类,请大家在“盐的类型”一行中写下你们的答案。并且老师请一位同学上台来分享ta的分类,并且填上ta的ph试纸测试结果。 【结果验证】好的,谢谢这位上台的同学,现在咱们一起验证一下。氯化钠是强酸强碱盐,水溶液显中性(余下六中盐和盐溶液表达如上)……同学们和这位同学和老师的结果相同吗?如果有不同的,请举手说明? 【提问】请同学们观察盐的类型和溶液的酸碱性,有没有发现什么规律?咱们请一位同学来说说他的想法。 【反馈并设问】没错,盐的类型确实影响到了溶液的酸碱性,似乎看起来是显强性的离子使得水溶液显同样的酸碱性呢。那么现在问题来了,盐的类型里所说的强弱到底有什么意义?这样的性质差别体现在什么地方呢?让咱们继续探究构成盐的离子性质不同带来的影响吧,接下来就要说到盐类在水溶液中发生的反应了。 座位上的学生自行填写盐溶液的酸碱性和盐的类型,上台的同当众写出自己的实验结果和分类结果。 【核对结果】如有不同或者不理解的可以举手提问。 【回答】如果是强酸弱碱盐,水溶液是酸性,如果是强碱弱酸盐,水溶液是碱性;如果是强酸强碱盐,水溶液就是中性。 尽量发挥学生的主体性,经过简单的盐的分类的学习后先让学生自行分类,再有典型学生上台书写自己的分类结果,并由教师对结果进行讲解,强化了学生的记忆和理解结果。 不直接讲实验结果,反而让学生先有一次尝试再让老师说出答案,课堂更生动,学习更活泼。
回顾强弱电解质的区别,尝试建立电离和水解的可逆关系 【回顾】老规矩,因为电离和水解具有密切的关系,咱们要探究盐类水解就不得不说到物质的电离。 【提问】同学们简单说一下,强弱电解质的电离有什么不同?常见的强电解质和弱电解质有哪些呢? 【小结】没错,强电解质如强酸、强碱、盐都是发生完全电离的,在水中没有物质“残留”,全都电离成离子。而弱电解质无法完全电离,原物质分子和电离出的离子共存在水溶液中,分子的电离是一个可逆反应。比如图片上的盐酸和醋酸就是典型的强电解质和弱电解质。 【提问并强调】老师再问问同学们,咱们今天探究的盐是强电解质还是弱电解质?电离完全吗? 【建立电离和水解联系】既然咱们说弱电解质是不完全电离,以弱酸HY为例,也就是说HY可以部分电离出H+和Y-,而Y-可以和H+再结合而可逆地生成HY分子。 【设问并引导】大家大胆猜想,既然弱电解质电离出的离子可以可逆地形成弱电解质,那么盐电离后生成的显弱性的离子是否也会结合水溶液中的其他离子、可逆地生成弱电解质呢?如果这个反应是存在的,对溶液的性质又有什么影响呢?电离和盐溶液中发生的反应有关联吗? 【思考】 【回答】强电解质在水溶液或者熔融状态下完全电离,常见的有强酸、强碱、盐。弱电解质相应地发生不完全电离,常见的是弱酸和弱碱。 【回顾知识点,加强记忆】 【回答】是强电解质,在水溶液中完全电离。 【倾听】注意听老师所举的例子,思考“弱离子”是否也会可逆地变回弱电解质,并且对溶液会有什么影响?电解和盐溶液中发生的反应有什么关系呢? 盐类的水解和物质的电离有密切联系,基本可以说盐的水解是物质电离的逆反应。故而此处回顾电离,并从电离的逆反应入手,让学生强化理解只有弱电解质电离出的离子会可逆地生成弱电解质,进而思考盐溶液体现不同酸碱性是因为有离子反应发生,而离子反应和离子是否发生电离的逆反应有关。
以强酸强碱盐为例进行具体分析 【提问】同学们,氯化钠咱们知道是什么盐呀? 【逐步分析】没错,是强酸强碱盐并且也是强电解质,也即氯化钠可以在水中发生完全电离生成钠离子和氯离子。与此同时,因为水作为溶剂不可忽略,水也会发生微弱的可逆电离生成氢离子和氢氧根离子。 【提问】请大家在草稿纸上写出氯化钠溶于水后,溶液中存在的分子和离子,并分析这几种离子是否能共存? 【具体分析】没错,氯化钠溶于水得到的溶液中所有离子可以共存而不发生反应,因此水电离后的等量氢离子和氢氧根离子浓度仍然相等,水溶液的酸碱性保持为中性。 【回答】强酸强碱盐。 【跟随老师写出电离式】 【倾听,思考】 书写出离子,并【回答】可以共存。 【倾听,理解强酸强碱盐的水溶液显中性的原因】 具体分析情况比较简单的强酸强碱盐,让学生有一个大致的印象——盐溶液的酸碱性和溶液中离子是否共存、发生反应有直接联系。
以强碱弱酸盐微粒进行具体分析 【点明】下一步咱们来看一个常见的强碱弱酸盐,醋酸钠。 【布置任务】请大家按照刚才的氯化钠分析,写出盐的电离及其逆反应,还有水的电离反应。 【提问】同学们再写出溶液中存在的离子,并告诉老师,这些离子可以共存吗? 【反馈】没错,溶液中的离子会发生反应,醋酸根离子会和溶液中的氢离子结合。 【提问】既然氢离子被醋酸根离子结合,那么大家猜想,溶液中的、由水电离提供的氢离子和氢氧根离子还相等吗?如果不等,哪种离子更多?对溶液的酸碱性有影响吗? 【具体分析】是的,让我们来具体看一下。首先,醋酸钠是完全电离的盐,而其完全电离出的醋酸根离子是“弱的”,可以和溶液中的氢离子结合成醋酸分子,也可以看做是醋酸电离的逆反应!因为氢离子被消耗,留下较多的氢氧根离子故而溶液才体现碱性。钠离子和氢氧根离子共存,并不发生反应。 【通性分析】通过上述分析,咱们可以发现——强酸强碱相应的离子不会和氢离子、氢氧根离子结合发生反应,而弱酸弱碱相应的离子却可以结合氢离子、氢氧根离子后生成弱电解质。 【小结】至此,大家应该对盐溶液体现不同酸碱性的原因有了明白的感知了吧? 【倾听,了解任务要求】 书写电离反应,电离逆反应以及水的电离反应。 【回答】不可以共存,醋酸根离子会和氢离子结合生成醋酸分子。 【回答】不再相等了,氢离子被消耗,即氢氧根离子浓度更大,使得溶液整体显碱性。 【倾听、理解】 记录并理解实验中的反应,只有弱酸弱碱对应的离子会发生电离的逆反应,而强酸强碱对应的离子可以在溶液中共存而不发生反应。 【理解,记笔记】 先具体分析强碱弱酸盐的溶液情况,再通过通性地分析盐溶液的酸碱性与离子之间的关系,让学生了解到:溶液的酸碱性来源于其中的氢离子和氢氧根离子浓度不等,更深的原因是弱电解质的离子会结合氢离子、氢氧根离子而发生电离的逆反应。
定义盐类的水解 【陈述】综上咱们可以知道,当盐溶于水时,其电离产生的“弱”阴阳离子可分别和水电力产生的氢离子、氢氧根离子结合生成弱电解质,也即弱酸或弱碱;盐与水发生的这种反应就叫做盐类的水解,在书写水解离子式时,常看作是离子和水发生的反应。 【练习】现在请大家尝试书写一下,强碱弱酸盐如醋酸钠,强酸弱碱盐如硫酸铵的水解离子式,并告诉老师二者的水溶液显什么性质? 【反馈练习结果】 【分析和理解】经过本次的学习,现在老师要带领同学们一起对盐类水解进行总结和理解。 1. 发生水解的部分一定是“弱酸”或“弱碱”离子,水解得到的是弱电解质分子。也可以理解为“弱离子”电离的逆反应。 2.强酸强碱盐不发生水解:其电离出的离子不与水电离出的H+和OH-结合。可以理解为这些不发生水解的离子可以共存,故而在书写离子方程式时不用写。 3.盐的水溶液的酸碱性不同,是因为溶液内的H+和OH-的浓度大小不同(直接原因),而更深层的原因是盐电离出的离子与水的反应(根本原因)。 4.可以从盐的类型直接看出盐的水溶液的酸碱性——口诀“谁强显谁性”。 5.注意电子守恒。 【倾听,记笔记】 【书写离子式】 【回答】分别显碱性和酸性。 【倾听】 【将老师所讲的注意事项和重点记录下来】 此处因为学生的自主归纳总结能力有限,主要以教师讲授为主,将总结的知识点和注意事项以条例的形式传授给学生,总结和概括本次“盐类水解第一学时”的学习内容和规律。 高度凝练,极简而可以体现本次学习的全部内容。
强化水解离子式的训练,并设置悬念,引出下次学习的多级水解 【布置任务】经过本次学习,咱们就用水解离子式来训练和总结一下。请同学们只写出盐的水解离子式和方程式,不用管盐的电离式。(碳酸氢钠,醋酸钠,碳酸钠) 【引导】碳酸钠的水解涉及到多级水解,请同学们先尝试书写一下,下课后复习多元弱酸的电离,咱们下节课继续讲解。 【反馈练习结果并适当讲解易错点】 草稿纸上书写要求的离子式和方程式。 【听取要求,下课后自行复习】 【核对正误,听取讲解】 用实际训练的方法作为学生本次学习的结尾,提高学生的学习效率和知识运用的能力。
教师回顾总结课堂学习内容 【设问】同学们,咱们这节课讲了些什么呢? 【回答】没错,咱们先自行动手做实验,了解了七种盐的水溶液的酸碱性;再通过构成盐的离子性质学习了解到不同的盐具有不同类型;进而了解到盐在水溶液中可能发生水解反应而影响溶液酸碱性;最后则学习了水解离子式和方程式的书写。 【倾听】 【思考】 【记笔记】 以教师的角度更为凝练地总结本次教学的主要流程和内容。
补充说明,结束教学 【补充并强调】在结束本次教学之前,老师需要再次强调,一定要分辨清强弱电解质的电离,以及盐类的水解之间的区别,其中可以是完全发生的反应,也可以是可逆反应;反应的产物可能会相同,但是发生的反应不一定也相同! 【结束】好的,本次“盐类的水解”第一部分课程就上到这里,咱们下课! 【倾听】 强调易错点,结束本次教学。
设计反思
教学设计较学期内的设计多了一些师生互动和问答,但经和同伴沟通以后认为留给学生反应时间仍然较短,可以将问题再分散一些、给学生更多的反应空间时间。
习题设计偏重于离子式的书写而忽略了文字性知识点的重要性。
教学环节之间的承接较为生硬。
2
