11 酸、碱、盐专题训练(含答案)2025年中考化学一轮专题复习(山西)
文档属性
| 名称 | 11 酸、碱、盐专题训练(含答案)2025年中考化学一轮专题复习(山西) |

|
|
| 格式 | docx | ||
| 文件大小 | 152.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-04 21:42:02 | ||
图片预览




文档简介
11 酸、碱、盐(专题训练)
题号 一 二 三 四 五 六 总分 累分人
得分
注意事项:1.共六大题,20小题,满分70分,化学与物理的考试时间共150分钟。
2.可能用到的相对原子质量:H-1 O-16 Mg-24 Cl-35.5
试卷好题分析 最新科技T1、T15
中考押题点分析 化学在生活、生产中的应用T3、T4、T5、T11~T14、T20,新题型新考法T19
一、选择题(本大题共10个小题。每小题2分,共20分。在每小题给出的4个选项中,只有1个选项符合题目要求。)
1.截至2024年5月,我国神舟载人飞船共执行任务18次。在飞船太空舱中,常用铁酸镍[Ni(FeO2)2]作为催化剂将航天员呼出的CO2转化为O2。Ni(FeO2)2的物质类别为 ( )
A.氧化物
B.酸
C.碱
D.盐
2.酸碱指示剂的发明对化学的发展意义重大。下列物质能使紫色石蕊溶液变蓝的是 ( )
A.KOH
B.O2
C.NaCl
D.CO2
3.游泳池中池水的pH偏低,会刺激人的皮肤和眼睛。下列物质中能对池水的pH进行调节的是 ( )
A.NaCl
B.Na2CO3
C.HCl
D.CO2
4.人体摄入过量的镉会引发疾病。研究发现,土壤的pH越小,水稻对镉的吸收率越高。以下物质可用于降低水稻对镉吸收的是 ( )
A.熟石灰
B.烧碱
C.氯化钠
D.稀盐酸
5.钢铁生锈会降低其强度和韧性,缩短钢铁制品的使用寿命。下列物质中,可用来除铁锈的是 ( )
A.氢氧化钠
B.稀盐酸
C.食盐水
D.蒸馏水
6.逻辑推理是一种重要的化学思维方法。下列推理正确的是 ( )
A.中和反应生成盐和水,生成盐和水的反应一定是中和反应
B.碱溶液能使无色酚酞溶液变红,能使无色酚酞溶液变红的一定是碱溶液
C.同种元素的质子数相同,具有相同质子数的原子一定是同种元素
D.碳酸盐能与酸反应生成气体,能与酸反应生成气体的一定是碳酸盐
7.小明按下图配方在家中自制苏打冰红茶,把全部原料加入塑料瓶中,拧紧瓶盖、摇匀、静置即可制成。以下有关说法正确的是 ( )
A.维生素C是有机物
B.配制过程中水是反应物
C.小苏打的化学式是Na2CO3
D.柠檬酸在水中解离出OH-
8.实验室中有两瓶失去标签的无色溶液,分别为稀盐酸与氢氧化钠溶液,下列选用的物质不能将它们鉴别出来的是 ( )
A.紫色石蕊溶液
B.镁条
C.氧化铜
D.硫酸钠溶液
9.向氢氧化钠溶液中加入一定量稀硫酸,取少量反应后的溶液进行下列实验,能证明二者恰好完全反应的是 ( )
A.滴入几滴无色酚酞溶液,溶液变为红色
B.滴入适量CuCl2溶液,无沉淀生成
C.滴入几滴紫色石蕊溶液,溶液呈紫色
D.滴入适量BaCl2溶液和稀硝酸,有白色沉淀生成
10.为测定某氢氧化钠固体是否变质,兴趣小组同学取一定量样品配制成溶液,再逐滴滴加稀盐酸至过量,并用传感器测定CO2的含量(如图所示),下列分析不正确的是 ( )
A.氢氧化钠固体已变质
B.0~50 s时段有中和反应发生
C.100 s时溶液的pH>7
D.200 s时溶液中的溶质只有一种
二、工程、技术应用题(本大题共5个小题。化学方程式每空2分,其余每空1分,共16分。)
【化学与工程】
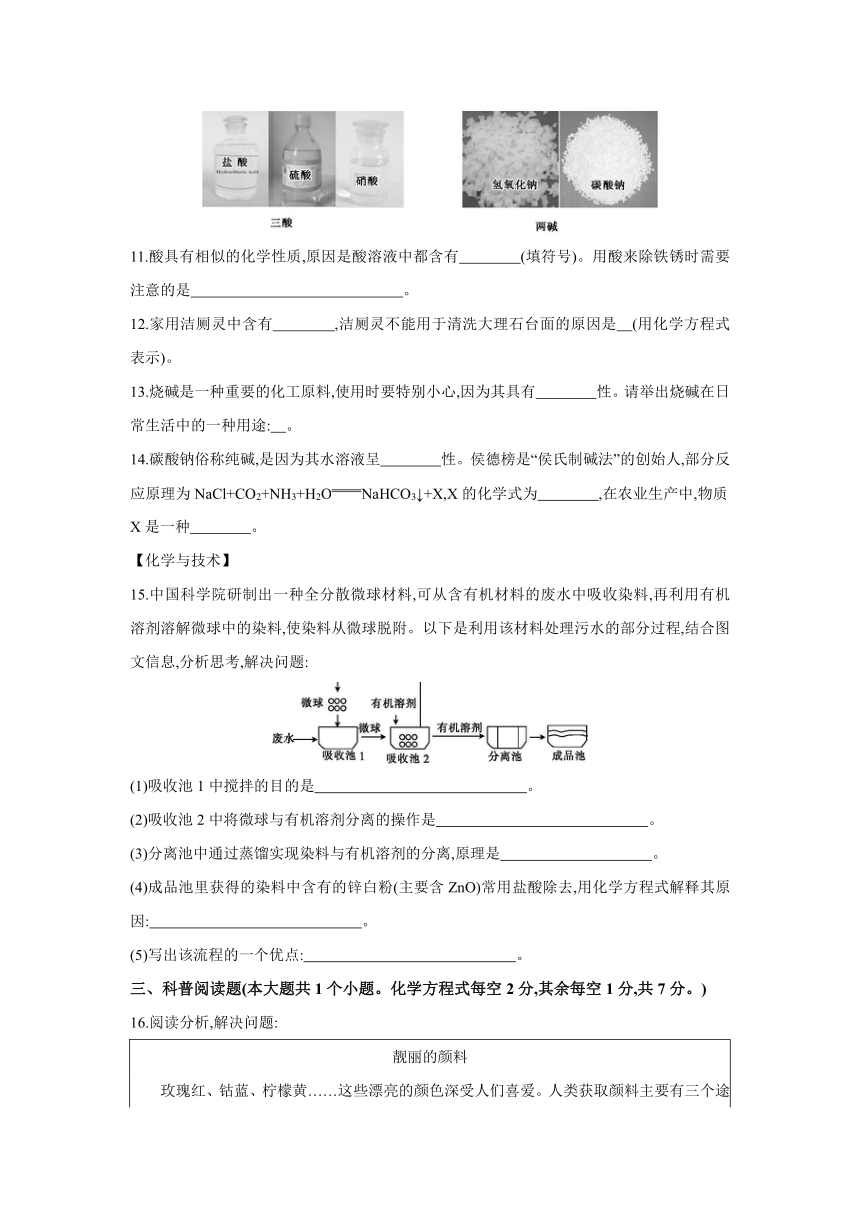
化学工业上常说的“三酸两碱”是指硫酸、盐酸、硝酸和烧碱、纯碱。酸、碱、盐在工农业生产和日常生活中的广泛应用,促进了人类文明的进步和社会的可持续发展。请分析图文信息,回答11~14题的相关问题。
11.酸具有相似的化学性质,原因是酸溶液中都含有 (填符号)。用酸来除铁锈时需要注意的是 。
12.家用洁厕灵中含有 ,洁厕灵不能用于清洗大理石台面的原因是 (用化学方程式表示)。
13.烧碱是一种重要的化工原料,使用时要特别小心,因为其具有 性。请举出烧碱在日常生活中的一种用途: 。
14.碳酸钠俗称纯碱,是因为其水溶液呈 性。侯德榜是“侯氏制碱法”的创始人,部分反应原理为NaCl+CO2+NH3+H2ONaHCO3↓+X,X的化学式为 ,在农业生产中,物质X是一种 。
【化学与技术】
15.中国科学院研制出一种全分散微球材料,可从含有机材料的废水中吸收染料,再利用有机溶剂溶解微球中的染料,使染料从微球脱附。以下是利用该材料处理污水的部分过程,结合图文信息,分析思考,解决问题:
(1)吸收池1中搅拌的目的是 。
(2)吸收池2中将微球与有机溶剂分离的操作是 。
(3)分离池中通过蒸馏实现染料与有机溶剂的分离,原理是 。
(4)成品池里获得的染料中含有的锌白粉(主要含ZnO)常用盐酸除去,用化学方程式解释其原因: 。
(5)写出该流程的一个优点: 。
三、科普阅读题(本大题共1个小题。化学方程式每空2分,其余每空1分,共7分。)
16.阅读分析,解决问题:
靓丽的颜料
玫瑰红、钴蓝、柠檬黄……这些漂亮的颜色深受人们喜爱。人类获取颜料主要有三个途径。天然矿物是早期颜料的主要来源,大多数颜料来自特殊地区出产的矿物,如北宋《千里江山图》便是用朱砂(主要成分为HgS)、赭石(主要成分为Fe2O3)、石青[主要成分为Cu2(OH)2CO3]等绘制的,时隔千年,画卷中的颜色依然层次分明、色彩浓丽。
动植物中,比如从雌胭脂虫体内提取的胭脂虫红,从蓝草、桑、紫草中提取的色素,广泛用于食品、化妆品、纺织品等。据记载,早在公元4世纪,人类就掌握了合成颜料铅白的加工方法。将铅条堆放在醋和发酵物上,置于密闭空间,利用发酵产生的热量,铅与氧气、水和二氧化碳反应,最终只生成铅白一种物质。随着科技的发展,还会有更多靓丽的颜色点缀我们的生活。
(1)天然矿物的颜料有 (答一种)。
(2)《千里江山图》历经千年,画卷中的颜色依然分明,说明 。
(3)赭石遇到酸性物质会变成 色,用化学方程式解释其原因: 。
(4)铅白由 种元素组成,制取铅白的反应属于基本反应类型中的 。
四、物质性质及应用题(本大题共1个小题。化学方程式每空2分,其余每空1分,共6分。)
17.利用对比的方法研究物质是一种高效的学习方法。小华同学对两种常见物质的相关内容以结构图的形式进行了如下梳理。请回答下列问题:
(1)氯化钠和氯化氢都能与 反应,原因是它们都含有 (填离子符号)。
(2)从构成物质微观粒子的角度分析,氯化钠由 构成,氯化氢由分子构成。
(3)氯化钠在生活中的一种用途是 。
(4)氯化氢转化为氯化钠,发生的反应的化学方程式为 。
五、定量分析题(本大题共1个小题。(1)1分,(2)5分,共6分。)
18.某氯化钠溶液中含有少量氯化镁,学习小组为测定其中氯化镁的质量分数,取50.0 g该溶液,向其中加入50.0 g氢氧化钠溶液恰好完全反应,生成沉淀的质量为2.9 g。请计算:
(1)反应后溶液的质量为 g。
(2)该氯化钠溶液中氯化镁的质量分数。(写出计算过程)
六、科学探究题(本大题共2个小题。化学方程式每空2分,其余每空1分,共15分。)
19.波尔多液是一种杀菌剂,由石灰乳与硫酸铜溶液配制而成。为验证氢氧化钙与硫酸铜的反应,并认识其反应的原理,同学们设计了如下实验方案,请根据提示,补全实验内容。
【实验方案】
(1)实验方法:将适量的硫酸铜溶液加入氢氧化钙溶液中,振荡。
(2)实验原理: (用化学方程式表示)。
(3)实验现象: 。
(4)实验结论: 。
【问题与交流】
(1)硫酸铜与氢氧化钙发生反应的微观实质是 。
(2)盛放波尔多液时需要注意的是 。
20.生活中经常采用果蔬洗涤盐清洗蔬菜和水果。某校化学兴趣小组的同学对此产生了极大的兴趣,并对果蔬洗涤盐的成分、作用、含量等展开项目化学习之旅。
任务一:认识并使用果蔬洗涤盐
【调查咨询】通过超市、电商等渠道,了解到常用的果蔬洗涤盐有柠檬酸型和碳酸氢钠型两种。
【查阅资料】使用波尔多液作杀虫剂的果蔬,其残留的农药以碱性物质为主。含有机磷成分的杀虫剂,有机磷在碱性环境中可以迅速分解。
【交流讨论】对于使用波尔多液作杀虫剂的果蔬,选用 型果蔬洗涤盐浸泡效果更佳。
任务二:探究果蔬洗涤盐成分
同学们在超市中买到某品牌的碳酸氢钠型果蔬洗涤盐,该产品配料表显示其中含有NaCl、Na2CO3和NaHCO3。
【进行实验1】为探究该果蔬洗涤盐的成分,小组同学设计如下实验方案。
实验步骤 实验现象 实验结论
①取少量果蔬洗涤盐于烧杯中,加足量水充分溶解 - -
②取①中少量溶液于试管中,滴加几滴稀盐酸 含有Na2CO3
③取①中少量溶液于试管中,先滴加足量稀硝酸,再滴加几滴 含有NaCl
【反思评价】(1)步骤②中发生反应的化学方程式为 。
(2)小明同学对步骤②结论提出疑问,认为该方案不能证明该果蔬洗涤盐中含有Na2CO3,理由是 。
任务三:测定各成分质量分数
【信息检索】①碳酸氢钠固体常温下性质稳定,在约50 ℃时开始分解,生成碳酸钠、二氧化碳和水;②在干燥空气中无变化,在潮湿空气中缓慢分解。
【进行实验2】同学们精确称取该果蔬洗涤盐样品5.00 g,在老师的指导下,经过一系列的实验,测出其中含有2.30 g NaHCO3和1.61 g Na2CO3。
【小组交流】该碳酸氢钠型果蔬洗涤盐中NaCl的质量分数是 。
任务四:自制碳酸氢钠型果蔬洗涤盐
【成果展示】同学们自制了300 g碳酸氢钠型果蔬洗涤盐,并制作了该果蔬洗涤盐的使用说明。请你将其补充完整。
参考答案
1.D 2.A 3.B 4.A 5.B 6.C 7.A 8.D 9.C
10.D 【解析】A.由图示可知,随着反应的进行,二氧化碳的质量逐渐增加,说明氢氧化钠固体已变质,选项说法正确;B.0~50 s时段,发生的是氢氧化钠和稀盐酸的反应,是中和反应,选项说法正确;C.100 s后还继续产生二氧化碳气体,说明100 s时碳酸钠有剩余,溶液显碱性,pH>7,选项说法正确;D.200 s时,稀盐酸过量,溶液中的溶质有氯化钠、氯化氢两种,选项说法错误。
11.H+ 不能长时间浸泡
12.盐酸 CaCO3+2HClCaCl2+H2O+CO2↑
13.腐蚀 去除油污(合理即可)
14.碱 NH4Cl 氮肥
15.(1)使微球与废水充分接触,更好地吸收染料
(2)过滤
(3)染料与有机溶剂的沸点不同
(4)ZnO+2HClZnCl2+H2O
(5)微球可循环利用(合理即可)
【解析】(1)吸收池1中搅拌能使微球与废水充分接触,更好地吸收染料。
(2)微球不溶于有机溶剂,染料能被有机溶剂溶解,因此可通过过滤的方法,将它们分离。
(3)蒸馏是将沸点不同的物质进行物质分离的一种方法。
(4)氧化锌属于金属氧化物,金属氧化物能与酸反应,生成盐和水。
(5)该流程中,微球经处理后可以循环使用。
16.(1)赭石(或朱砂,或石青)
(2)所用矿石颜料化学性质稳定
(3)黄 Fe2O3+6HCl2FeCl3+3H2O(合理即可)
(4)四(或4) 化合反应
17.(1)硝酸银溶液 Cl-
(2)离子
(3)作调味品
(4)NaOH+HClNaCl+H2O(合理即可)
18.(1)97.1(1分)
(2)解:设参加反应的氯化镁的质量为x。
2NaOH+MgCl2Mg(OH)2↓+2NaCl(1分)
95 58
x 2.9 g(1分)
=(1分)
x=4.75 g(1分)
该氯化钠溶液中氯化镁的质量分数为×100%=9.5%(1分)
答:该氯化钠溶液中氯化镁的质量分数为9.5%。
19.【实验方案】
(2)CuSO4+Ca(OH)2Cu(OH)2↓+CaSO4
(3)产生蓝色沉淀
(4)反应物均可溶,生成物中有沉淀,符合复分解反应发生的条件
【问题与交流】
(1)铜离子与氢氧根离子结合生成氢氧化铜沉淀
(2)不能用铁制容器盛放
20.任务一:
【交流讨论】柠檬酸
任务二:
【进行实验1】有气泡产生 硝酸银溶液 产生白色沉淀
【反思评价】(1)Na2CO3+2HCl2NaCl+H2O+CO2↑
(2)NaHCO3也会与稀盐酸反应产生气泡
任务三:
【小组交流】21.8%
任务四:
【成果展示】阴凉干燥处密封保存
【解析】任务一:使用波尔多液作杀虫剂,其残留的农药以碱性物质为主。使用酸性物质可将其反应除去。
任务二:探究果蔬洗涤盐中是否含有NaCl、Na2CO3、NaHCO3。取少量含果蔬洗涤盐的溶液,滴加稀盐酸,有气泡产生;再加入足量稀硝酸和硝酸银溶液,有白色沉淀生成,根据现象分析,可得出溶液中含有氯化钠,不能确定溶液中是否含有碳酸钠,因为碳酸氢钠也能与盐酸反应,生成二氧化碳气体。
任务三:已知5.00 g果蔬洗涤盐中含有2.30 g NaHCO3和1.61 g Na2CO3,则含有氯化钠的质量是5.0 g-2.30 g-1.61 g=1.09 g,5 g果蔬洗涤盐中氯化钠的质量分数为×100%=21.8%。
任务四:碳酸氢钠受热易分解,在潮湿的空气中缓慢分解,因此需要放在阴凉干燥处密封保存。
题号 一 二 三 四 五 六 总分 累分人
得分
注意事项:1.共六大题,20小题,满分70分,化学与物理的考试时间共150分钟。
2.可能用到的相对原子质量:H-1 O-16 Mg-24 Cl-35.5
试卷好题分析 最新科技T1、T15
中考押题点分析 化学在生活、生产中的应用T3、T4、T5、T11~T14、T20,新题型新考法T19
一、选择题(本大题共10个小题。每小题2分,共20分。在每小题给出的4个选项中,只有1个选项符合题目要求。)
1.截至2024年5月,我国神舟载人飞船共执行任务18次。在飞船太空舱中,常用铁酸镍[Ni(FeO2)2]作为催化剂将航天员呼出的CO2转化为O2。Ni(FeO2)2的物质类别为 ( )
A.氧化物
B.酸
C.碱
D.盐
2.酸碱指示剂的发明对化学的发展意义重大。下列物质能使紫色石蕊溶液变蓝的是 ( )
A.KOH
B.O2
C.NaCl
D.CO2
3.游泳池中池水的pH偏低,会刺激人的皮肤和眼睛。下列物质中能对池水的pH进行调节的是 ( )
A.NaCl
B.Na2CO3
C.HCl
D.CO2
4.人体摄入过量的镉会引发疾病。研究发现,土壤的pH越小,水稻对镉的吸收率越高。以下物质可用于降低水稻对镉吸收的是 ( )
A.熟石灰
B.烧碱
C.氯化钠
D.稀盐酸
5.钢铁生锈会降低其强度和韧性,缩短钢铁制品的使用寿命。下列物质中,可用来除铁锈的是 ( )
A.氢氧化钠
B.稀盐酸
C.食盐水
D.蒸馏水
6.逻辑推理是一种重要的化学思维方法。下列推理正确的是 ( )
A.中和反应生成盐和水,生成盐和水的反应一定是中和反应
B.碱溶液能使无色酚酞溶液变红,能使无色酚酞溶液变红的一定是碱溶液
C.同种元素的质子数相同,具有相同质子数的原子一定是同种元素
D.碳酸盐能与酸反应生成气体,能与酸反应生成气体的一定是碳酸盐
7.小明按下图配方在家中自制苏打冰红茶,把全部原料加入塑料瓶中,拧紧瓶盖、摇匀、静置即可制成。以下有关说法正确的是 ( )
A.维生素C是有机物
B.配制过程中水是反应物
C.小苏打的化学式是Na2CO3
D.柠檬酸在水中解离出OH-
8.实验室中有两瓶失去标签的无色溶液,分别为稀盐酸与氢氧化钠溶液,下列选用的物质不能将它们鉴别出来的是 ( )
A.紫色石蕊溶液
B.镁条
C.氧化铜
D.硫酸钠溶液
9.向氢氧化钠溶液中加入一定量稀硫酸,取少量反应后的溶液进行下列实验,能证明二者恰好完全反应的是 ( )
A.滴入几滴无色酚酞溶液,溶液变为红色
B.滴入适量CuCl2溶液,无沉淀生成
C.滴入几滴紫色石蕊溶液,溶液呈紫色
D.滴入适量BaCl2溶液和稀硝酸,有白色沉淀生成
10.为测定某氢氧化钠固体是否变质,兴趣小组同学取一定量样品配制成溶液,再逐滴滴加稀盐酸至过量,并用传感器测定CO2的含量(如图所示),下列分析不正确的是 ( )
A.氢氧化钠固体已变质
B.0~50 s时段有中和反应发生
C.100 s时溶液的pH>7
D.200 s时溶液中的溶质只有一种
二、工程、技术应用题(本大题共5个小题。化学方程式每空2分,其余每空1分,共16分。)
【化学与工程】
化学工业上常说的“三酸两碱”是指硫酸、盐酸、硝酸和烧碱、纯碱。酸、碱、盐在工农业生产和日常生活中的广泛应用,促进了人类文明的进步和社会的可持续发展。请分析图文信息,回答11~14题的相关问题。
11.酸具有相似的化学性质,原因是酸溶液中都含有 (填符号)。用酸来除铁锈时需要注意的是 。
12.家用洁厕灵中含有 ,洁厕灵不能用于清洗大理石台面的原因是 (用化学方程式表示)。
13.烧碱是一种重要的化工原料,使用时要特别小心,因为其具有 性。请举出烧碱在日常生活中的一种用途: 。
14.碳酸钠俗称纯碱,是因为其水溶液呈 性。侯德榜是“侯氏制碱法”的创始人,部分反应原理为NaCl+CO2+NH3+H2ONaHCO3↓+X,X的化学式为 ,在农业生产中,物质X是一种 。
【化学与技术】
15.中国科学院研制出一种全分散微球材料,可从含有机材料的废水中吸收染料,再利用有机溶剂溶解微球中的染料,使染料从微球脱附。以下是利用该材料处理污水的部分过程,结合图文信息,分析思考,解决问题:
(1)吸收池1中搅拌的目的是 。
(2)吸收池2中将微球与有机溶剂分离的操作是 。
(3)分离池中通过蒸馏实现染料与有机溶剂的分离,原理是 。
(4)成品池里获得的染料中含有的锌白粉(主要含ZnO)常用盐酸除去,用化学方程式解释其原因: 。
(5)写出该流程的一个优点: 。
三、科普阅读题(本大题共1个小题。化学方程式每空2分,其余每空1分,共7分。)
16.阅读分析,解决问题:
靓丽的颜料
玫瑰红、钴蓝、柠檬黄……这些漂亮的颜色深受人们喜爱。人类获取颜料主要有三个途径。天然矿物是早期颜料的主要来源,大多数颜料来自特殊地区出产的矿物,如北宋《千里江山图》便是用朱砂(主要成分为HgS)、赭石(主要成分为Fe2O3)、石青[主要成分为Cu2(OH)2CO3]等绘制的,时隔千年,画卷中的颜色依然层次分明、色彩浓丽。
动植物中,比如从雌胭脂虫体内提取的胭脂虫红,从蓝草、桑、紫草中提取的色素,广泛用于食品、化妆品、纺织品等。据记载,早在公元4世纪,人类就掌握了合成颜料铅白的加工方法。将铅条堆放在醋和发酵物上,置于密闭空间,利用发酵产生的热量,铅与氧气、水和二氧化碳反应,最终只生成铅白一种物质。随着科技的发展,还会有更多靓丽的颜色点缀我们的生活。
(1)天然矿物的颜料有 (答一种)。
(2)《千里江山图》历经千年,画卷中的颜色依然分明,说明 。
(3)赭石遇到酸性物质会变成 色,用化学方程式解释其原因: 。
(4)铅白由 种元素组成,制取铅白的反应属于基本反应类型中的 。
四、物质性质及应用题(本大题共1个小题。化学方程式每空2分,其余每空1分,共6分。)
17.利用对比的方法研究物质是一种高效的学习方法。小华同学对两种常见物质的相关内容以结构图的形式进行了如下梳理。请回答下列问题:
(1)氯化钠和氯化氢都能与 反应,原因是它们都含有 (填离子符号)。
(2)从构成物质微观粒子的角度分析,氯化钠由 构成,氯化氢由分子构成。
(3)氯化钠在生活中的一种用途是 。
(4)氯化氢转化为氯化钠,发生的反应的化学方程式为 。
五、定量分析题(本大题共1个小题。(1)1分,(2)5分,共6分。)
18.某氯化钠溶液中含有少量氯化镁,学习小组为测定其中氯化镁的质量分数,取50.0 g该溶液,向其中加入50.0 g氢氧化钠溶液恰好完全反应,生成沉淀的质量为2.9 g。请计算:
(1)反应后溶液的质量为 g。
(2)该氯化钠溶液中氯化镁的质量分数。(写出计算过程)
六、科学探究题(本大题共2个小题。化学方程式每空2分,其余每空1分,共15分。)
19.波尔多液是一种杀菌剂,由石灰乳与硫酸铜溶液配制而成。为验证氢氧化钙与硫酸铜的反应,并认识其反应的原理,同学们设计了如下实验方案,请根据提示,补全实验内容。
【实验方案】
(1)实验方法:将适量的硫酸铜溶液加入氢氧化钙溶液中,振荡。
(2)实验原理: (用化学方程式表示)。
(3)实验现象: 。
(4)实验结论: 。
【问题与交流】
(1)硫酸铜与氢氧化钙发生反应的微观实质是 。
(2)盛放波尔多液时需要注意的是 。
20.生活中经常采用果蔬洗涤盐清洗蔬菜和水果。某校化学兴趣小组的同学对此产生了极大的兴趣,并对果蔬洗涤盐的成分、作用、含量等展开项目化学习之旅。
任务一:认识并使用果蔬洗涤盐
【调查咨询】通过超市、电商等渠道,了解到常用的果蔬洗涤盐有柠檬酸型和碳酸氢钠型两种。
【查阅资料】使用波尔多液作杀虫剂的果蔬,其残留的农药以碱性物质为主。含有机磷成分的杀虫剂,有机磷在碱性环境中可以迅速分解。
【交流讨论】对于使用波尔多液作杀虫剂的果蔬,选用 型果蔬洗涤盐浸泡效果更佳。
任务二:探究果蔬洗涤盐成分
同学们在超市中买到某品牌的碳酸氢钠型果蔬洗涤盐,该产品配料表显示其中含有NaCl、Na2CO3和NaHCO3。
【进行实验1】为探究该果蔬洗涤盐的成分,小组同学设计如下实验方案。
实验步骤 实验现象 实验结论
①取少量果蔬洗涤盐于烧杯中,加足量水充分溶解 - -
②取①中少量溶液于试管中,滴加几滴稀盐酸 含有Na2CO3
③取①中少量溶液于试管中,先滴加足量稀硝酸,再滴加几滴 含有NaCl
【反思评价】(1)步骤②中发生反应的化学方程式为 。
(2)小明同学对步骤②结论提出疑问,认为该方案不能证明该果蔬洗涤盐中含有Na2CO3,理由是 。
任务三:测定各成分质量分数
【信息检索】①碳酸氢钠固体常温下性质稳定,在约50 ℃时开始分解,生成碳酸钠、二氧化碳和水;②在干燥空气中无变化,在潮湿空气中缓慢分解。
【进行实验2】同学们精确称取该果蔬洗涤盐样品5.00 g,在老师的指导下,经过一系列的实验,测出其中含有2.30 g NaHCO3和1.61 g Na2CO3。
【小组交流】该碳酸氢钠型果蔬洗涤盐中NaCl的质量分数是 。
任务四:自制碳酸氢钠型果蔬洗涤盐
【成果展示】同学们自制了300 g碳酸氢钠型果蔬洗涤盐,并制作了该果蔬洗涤盐的使用说明。请你将其补充完整。
参考答案
1.D 2.A 3.B 4.A 5.B 6.C 7.A 8.D 9.C
10.D 【解析】A.由图示可知,随着反应的进行,二氧化碳的质量逐渐增加,说明氢氧化钠固体已变质,选项说法正确;B.0~50 s时段,发生的是氢氧化钠和稀盐酸的反应,是中和反应,选项说法正确;C.100 s后还继续产生二氧化碳气体,说明100 s时碳酸钠有剩余,溶液显碱性,pH>7,选项说法正确;D.200 s时,稀盐酸过量,溶液中的溶质有氯化钠、氯化氢两种,选项说法错误。
11.H+ 不能长时间浸泡
12.盐酸 CaCO3+2HClCaCl2+H2O+CO2↑
13.腐蚀 去除油污(合理即可)
14.碱 NH4Cl 氮肥
15.(1)使微球与废水充分接触,更好地吸收染料
(2)过滤
(3)染料与有机溶剂的沸点不同
(4)ZnO+2HClZnCl2+H2O
(5)微球可循环利用(合理即可)
【解析】(1)吸收池1中搅拌能使微球与废水充分接触,更好地吸收染料。
(2)微球不溶于有机溶剂,染料能被有机溶剂溶解,因此可通过过滤的方法,将它们分离。
(3)蒸馏是将沸点不同的物质进行物质分离的一种方法。
(4)氧化锌属于金属氧化物,金属氧化物能与酸反应,生成盐和水。
(5)该流程中,微球经处理后可以循环使用。
16.(1)赭石(或朱砂,或石青)
(2)所用矿石颜料化学性质稳定
(3)黄 Fe2O3+6HCl2FeCl3+3H2O(合理即可)
(4)四(或4) 化合反应
17.(1)硝酸银溶液 Cl-
(2)离子
(3)作调味品
(4)NaOH+HClNaCl+H2O(合理即可)
18.(1)97.1(1分)
(2)解:设参加反应的氯化镁的质量为x。
2NaOH+MgCl2Mg(OH)2↓+2NaCl(1分)
95 58
x 2.9 g(1分)
=(1分)
x=4.75 g(1分)
该氯化钠溶液中氯化镁的质量分数为×100%=9.5%(1分)
答:该氯化钠溶液中氯化镁的质量分数为9.5%。
19.【实验方案】
(2)CuSO4+Ca(OH)2Cu(OH)2↓+CaSO4
(3)产生蓝色沉淀
(4)反应物均可溶,生成物中有沉淀,符合复分解反应发生的条件
【问题与交流】
(1)铜离子与氢氧根离子结合生成氢氧化铜沉淀
(2)不能用铁制容器盛放
20.任务一:
【交流讨论】柠檬酸
任务二:
【进行实验1】有气泡产生 硝酸银溶液 产生白色沉淀
【反思评价】(1)Na2CO3+2HCl2NaCl+H2O+CO2↑
(2)NaHCO3也会与稀盐酸反应产生气泡
任务三:
【小组交流】21.8%
任务四:
【成果展示】阴凉干燥处密封保存
【解析】任务一:使用波尔多液作杀虫剂,其残留的农药以碱性物质为主。使用酸性物质可将其反应除去。
任务二:探究果蔬洗涤盐中是否含有NaCl、Na2CO3、NaHCO3。取少量含果蔬洗涤盐的溶液,滴加稀盐酸,有气泡产生;再加入足量稀硝酸和硝酸银溶液,有白色沉淀生成,根据现象分析,可得出溶液中含有氯化钠,不能确定溶液中是否含有碳酸钠,因为碳酸氢钠也能与盐酸反应,生成二氧化碳气体。
任务三:已知5.00 g果蔬洗涤盐中含有2.30 g NaHCO3和1.61 g Na2CO3,则含有氯化钠的质量是5.0 g-2.30 g-1.61 g=1.09 g,5 g果蔬洗涤盐中氯化钠的质量分数为×100%=21.8%。
任务四:碳酸氢钠受热易分解,在潮湿的空气中缓慢分解,因此需要放在阴凉干燥处密封保存。
同课章节目录
