9 常见的酸、碱、盐 专项练习 (含答案) 2025年中考化学一轮专题复习(安徽)
文档属性
| 名称 | 9 常见的酸、碱、盐 专项练习 (含答案) 2025年中考化学一轮专题复习(安徽) |  | |
| 格式 | docx | ||
| 文件大小 | 192.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-05 11:06:04 | ||
图片预览


文档简介
9 常见的酸、碱、盐
题号 一 二 总分 累分人
得分
注意事项:1.共两大题17小题,满分40分。考试时间45分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5
试卷好题分析 优秀传统文化T1、T13,生产、生活情境T2、T5、T15,化学模型T4、T13
中考押题点分析 情境化命题T6、T8、T9等,项目式探究T16
一、选择题(本大题包括12小题,每小题1分,共12分。每小题的4个选项中只有1个符合题意)
1.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”里的“碱”主要是碳酸钾。物质分类中碳酸钾属于 ( )
A.酸 B.碱
C.盐 D.单质
2.化学与生活密切相关。下列叙述错误的是 ( )
A.酸和碱都有腐蚀性,使用时一定要注意安全
B.酸雨对农作物、桥梁、房子等有破坏作用
C.腌制食品时大量使用亚硝酸盐,起到保鲜作用
D.新药物的研发和使用保障了人们的身体健康
3.如图所示,一天平A、B两端各放一个烧杯,两烧杯中分别盛有浓硫酸和浓盐酸,此时,天平恰好平衡,一段时间后 ( )
A.天平A端上升
B.天平B端上升
C.天平仍处于平衡状态
D.以上情况都有可能
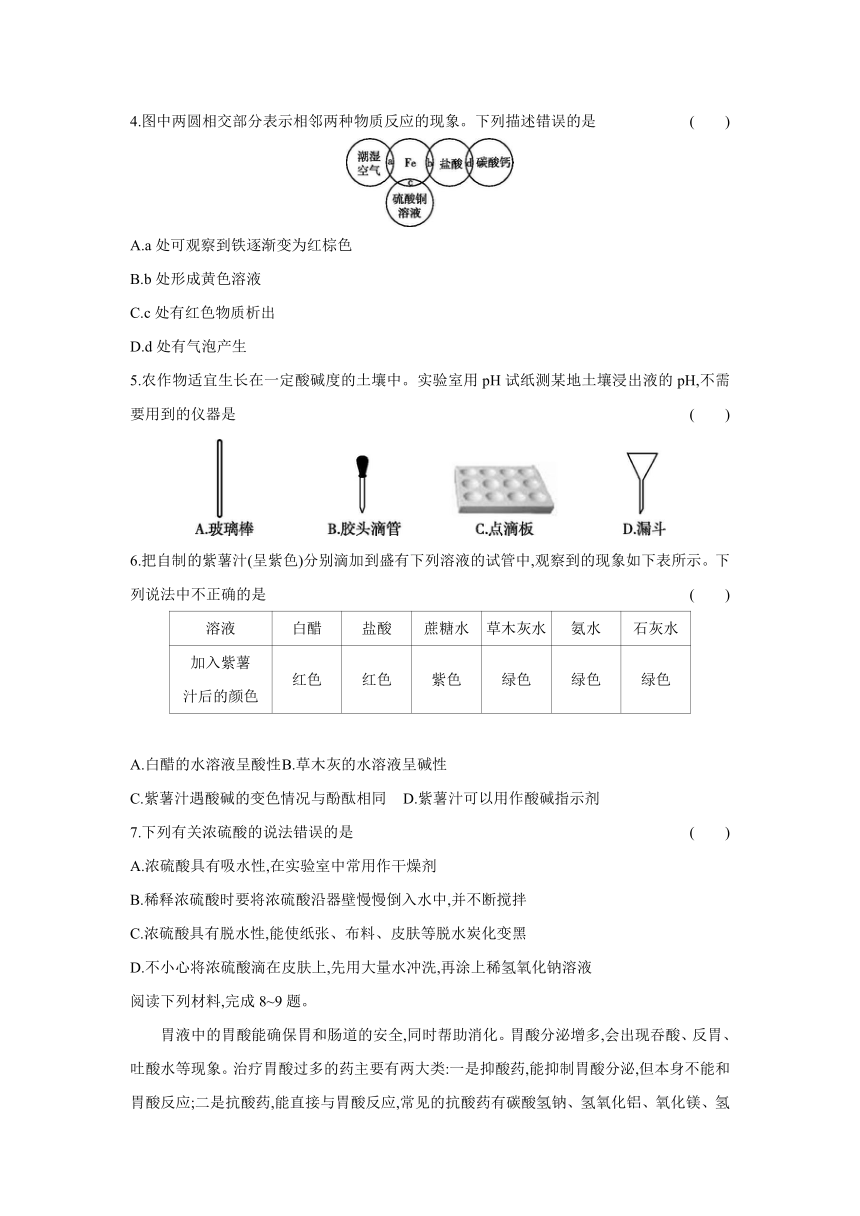
4.图中两圆相交部分表示相邻两种物质反应的现象。下列描述错误的是 ( )
A.a处可观察到铁逐渐变为红棕色
B.b处形成黄色溶液
C.c处有红色物质析出
D.d处有气泡产生
5.农作物适宜生长在一定酸碱度的土壤中。实验室用pH试纸测某地土壤浸出液的pH,不需要用到的仪器是 ( )
6.把自制的紫薯汁(呈紫色)分别滴加到盛有下列溶液的试管中,观察到的现象如下表所示。下列说法中不正确的是 ( )
溶液 白醋 盐酸 蔗糖水 草木灰水 氨水 石灰水
加入紫薯 汁后的颜色 红色 红色 紫色 绿色 绿色 绿色
A.白醋的水溶液呈酸性 B.草木灰的水溶液呈碱性
C.紫薯汁遇酸碱的变色情况与酚酞相同 D.紫薯汁可以用作酸碱指示剂
7.下列有关浓硫酸的说法错误的是 ( )
A.浓硫酸具有吸水性,在实验室中常用作干燥剂
B.稀释浓硫酸时要将浓硫酸沿器壁慢慢倒入水中,并不断搅拌
C.浓硫酸具有脱水性,能使纸张、布料、皮肤等脱水炭化变黑
D.不小心将浓硫酸滴在皮肤上,先用大量水冲洗,再涂上稀氢氧化钠溶液
阅读下列材料,完成8~9题。
胃液中的胃酸能确保胃和肠道的安全,同时帮助消化。胃酸分泌增多,会出现吞酸、反胃、吐酸水等现象。治疗胃酸过多的药主要有两大类:一是抑酸药,能抑制胃酸分泌,但本身不能和胃酸反应;二是抗酸药,能直接与胃酸反应,常见的抗酸药有碳酸氢钠、氢氧化铝、氧化镁、氢氧化镁和碳酸钙等。胃溃疡患者若服用不合适的抗酸药,会因胃内气体压力增大而引起胃穿孔。治疗胃酸过多时,应遵医嘱合理使用药物。
8.下列说法正确的是 ( )
A.胃酸属于纯净物 B.胃溃疡患者可服用抗酸药碳酸氢钠
C.文中提到的抗酸药都不能溶于水 D.氢氧化铝治疗胃酸发生的反应属于复分解反应
9.关于材料中提到的几种抗酸药,下列说法不正确的是 ( )
A.均属于盐或碱 B.抗酸药的用量不是越多越好
C.碳酸钙治疗胃酸过多的同时能补钙 D.碳酸氢钠治疗胃酸过多易造成胃胀气
10.化学知识对学生全面发展有重要价值,下列示例说法错误的是 ( )
A.美育:我们的青春像无色酚酞溶液遇碱一样鲜红火热
B.体育:举重、体操、单杠运动员做引体向上项目时,手上擦的镁粉(碳酸镁)能与碱反应
C.劳育:去农场帮忙,用氢氧化钙、硫酸铜溶液配制波尔多液,喷洒农药
D.德育:《天工开物》记载的“骨灰蘸秧根,……石灰淹苗足”利用石灰的碱性改良酸性土壤
11.下列关于酸碱中和反应的说法中,正确的是 ( )
A.酸碱中和反应的实质是H++OH-H2O B.生成盐和水的反应,都是中和反应
C.当酸碱完全中和时,两者所用质量一定相等 D.当酸碱完全中和时,所得盐溶液pH等于0
12.某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器测量反应过程中pH随时间的变化情况(如图2)。下列说法错误的是 ( )
A.a为稀盐酸 B.b点所示溶液中的溶质是NaCl和NaOH
C.e点所示溶液加热蒸干所得固体为纯净物 D.d→e过程所示溶液中NaCl的质量不断增加
二、非选择题(本大题包括5小题,共28分)
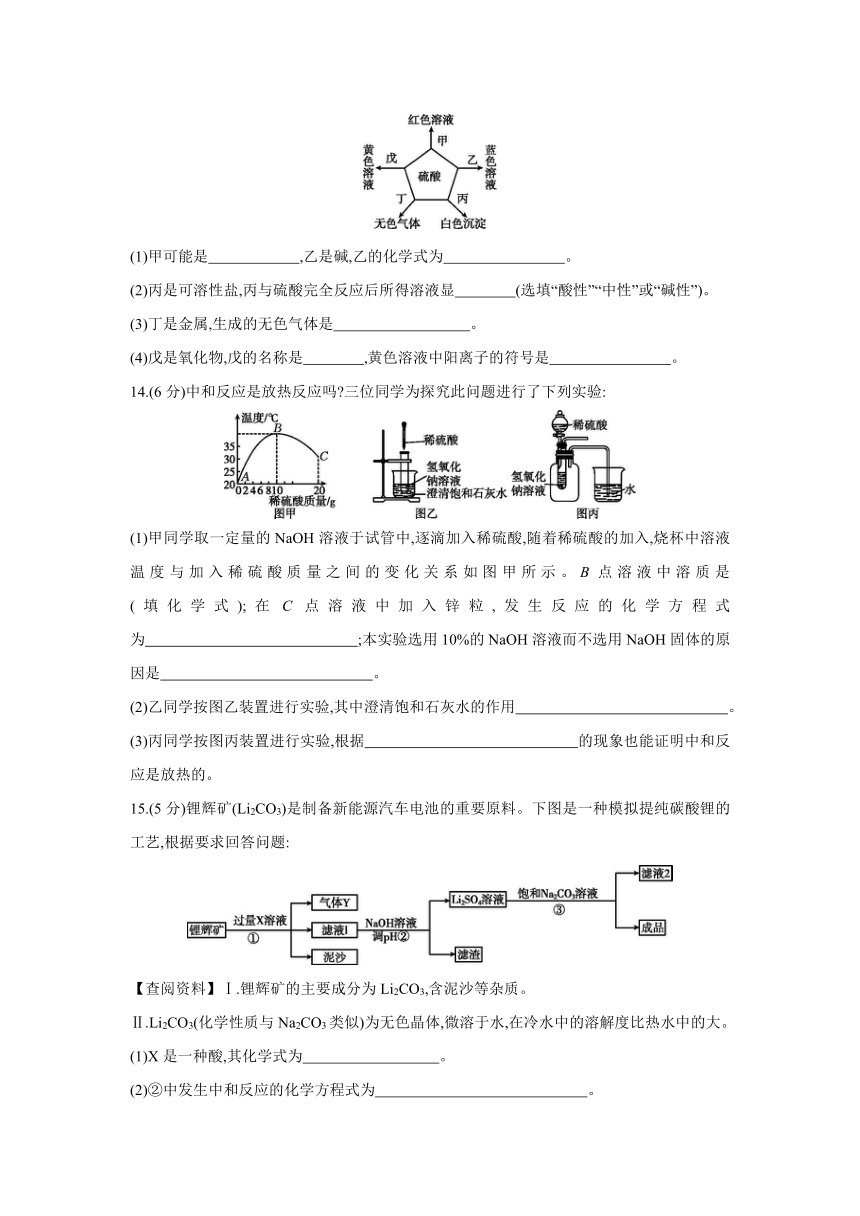
13.(6分)我国早期科技丛书《物理小识·金石类》记有“矶油”硫酸,小赣同学利用思维导图归纳硫酸性质如图所示。硫酸分别与甲、乙、丙、丁、戊五种常见物质反应,请回答下列问题:
(1)甲可能是 ,乙是碱,乙的化学式为 。
(2)丙是可溶性盐,丙与硫酸完全反应后所得溶液显 (选填“酸性”“中性”或“碱性”)。
(3)丁是金属,生成的无色气体是 。
(4)戊是氧化物,戊的名称是 ,黄色溶液中阳离子的符号是 。
14.(6分)中和反应是放热反应吗 三位同学为探究此问题进行了下列实验:
(1)甲同学取一定量的NaOH溶液于试管中,逐滴加入稀硫酸,随着稀硫酸的加入,烧杯中溶液温度与加入稀硫酸质量之间的变化关系如图甲所示。B点溶液中溶质是 (填化学式);在C点溶液中加入锌粒,发生反应的化学方程式为 ;本实验选用10%的NaOH溶液而不选用NaOH固体的原因是 。
(2)乙同学按图乙装置进行实验,其中澄清饱和石灰水的作用 。
(3)丙同学按图丙装置进行实验,根据 的现象也能证明中和反应是放热的。
15.(5分)锂辉矿(Li2CO3)是制备新能源汽车电池的重要原料。下图是一种模拟提纯碳酸锂的工艺,根据要求回答问题:
【查阅资料】Ⅰ.锂辉矿的主要成分为Li2CO3,含泥沙等杂质。
Ⅱ.Li2CO3(化学性质与Na2CO3类似)为无色晶体,微溶于水,在冷水中的溶解度比热水中的大。
(1)X是一种酸,其化学式为 。
(2)②中发生中和反应的化学方程式为 。
(3)有以下三种温度的饱和Na2CO3溶液,③中你选择的温度是 (填字母)。
A.0 ℃ B.25 ℃ C.80 ℃
(4)将滤液2蒸发,当观察到有 时,停止加热,可得到其他化工产品。
16.(6分)小志同学喜欢喝苏打水,每次他大口喝完都忍不住打嗝。对此他感到困惑:为什么喝苏打水会打嗝呢
探究一:喝苏打水打嗝的原因
成分表
品名:苏打水饮料
配料:水,碳酸氢钠,氯化钾,柠檬酸,安赛蜜,食用香精
查看苏打水成分表后,他猜想是碳酸氢钠和胃酸发生反应生成大量的二氧化碳,导致打嗝。
(1)为了验证猜想,他在实验室取一定量稀盐酸,将苏打水和其反应生成的气体通入澄清石灰水中,观察到 ,小志验证了猜想。
探究二:苏打水中碳酸氢钠的质量
小志同学又有了新的问题:这瓶500 mL苏打水中含有多少碳酸氢钠 于是小志设计了如下实验装置。
【查阅资料】碱石灰的成分是氢氧化钠和氧化钙。
【实验过程】Ⅰ.检查装置气密性,量取200 mL苏打水加入锥形瓶中,往分液漏斗中加入足量稀盐酸,连接已加入足量试剂的其他装置。
Ⅱ.实验开始前,打开弹簧夹a先通入一定量空气,然后称量装置D的质量m1。
Ⅲ.关闭弹簧夹a,拿掉分液漏斗的玻璃塞,转动活塞,使稀盐酸缓缓滴下。
Ⅳ.待装置B内反应结束,关闭分液漏斗活塞,打开弹簧夹a通入一段时间空气,测得装置D增重m2。
【实验分析】
(2)步骤Ⅳ中打开弹簧夹a通入一段时间空气的目的是 。
(3)装置C中盛装的试剂是 ;如何判断装置B中反应结束了 。
(4)写出苏打水中的碳酸氢钠与胃酸反应的化学方程式: 。
注意:若答对第(5)(6)小题奖励3分,化学总得分不超过40分。
(5)用所给数据表示出500 mL苏打水中碳酸氢钠的质量: (用代数式表示)。
(6)关于该实验,下列说法正确的是 (填标号)。
①实验前先通空气是为了除去装置内空气中的二氧化碳,防止其影响实验结果
②若无装置A,改通氮气也能完成实验
③若无装置E,会使测量结果偏小
④适量饮用苏打水可缓解胃酸过多
17.(5分)同学们在劳动课上给班级小菜园施肥。为测定所用化肥中硝酸铵的质量分数,进行了如下实验:称取20 g化肥样品于烧杯中,加水至样品完全溶解,向所得溶液中逐滴加入150 g氢氧化钠溶液,发生反应NH4NO3+NaOHNaNO3+NH3↑+H2O,测得产生氨气的质量与滴加氢氧化钠溶液的质量的关系如图所示。(假设氨气全部逸出且被测量)
(1)硝酸铵属于 (选填“氮肥”或“复合肥”)。
(2)计算该化肥中硝酸铵的质量分数。(写出计算过程)
参考答案
1.C 2.C 3.B
4.B
【解析】A.铁在潮湿空气中锈蚀,a处可观察到铁逐渐变为红棕色,正确;B.铁与稀盐酸反应生成氯化亚铁和氢气,b处形成浅绿色溶液,错误;C.铁与硫酸铜反应生成硫酸亚铁和铜,c处有红色物质析出,正确;D.稀盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,d处有气泡产生,正确。
5.D 6.C 7.D 8.D 9.A 10.B
11.A
【解析】A.酸碱中和反应的实质是H+和OH-结合生成水分子,即H++OH-H2O,正确;B.中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如用稀盐酸除铁锈生成氯化铁和水,错误;C.氢氧化钠和盐酸反应生成了氯化钠和水,每40份质量的NaOH能和36.5份质量的HCl恰好完全反应,错误;D.氢氧化钠和盐酸反应生成了氯化钠和水,完全中和时,所得溶液即氯化钠溶液为中性,pH等于7,错误。
12.D
【解析】A.由图像可知,开始时pH大于7,逐渐减小到7,然后小于7,可知原溶液显碱性,然后不断地加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中,则图1中滴加的a溶液为稀盐酸,正确;B.盐酸与氢氧化钠反应生成氯化钠和水,b点所示溶液pH大于7,说明氢氧化钠有剩余,故b点所示溶液中的溶质是NaCl和NaOH,正确;C.e点所示溶液pH小于7,盐酸过量,溶液中溶质为NaCl和HCl,加热蒸干过程中HCl挥发掉,所得固体只有NaCl,为纯净物,正确;D.d点所示溶液pH=7,盐酸与氢氧化钠恰好完全反应,d→e过程中盐酸过量,溶液中NaCl的质量不变,错误。
13.(6分)
(1)紫色石蕊溶液 Cu(OH)2
(2)酸性
(3)氢气(或H2)
(4)氧化铁 Fe3+
【解析】(1)硫酸能使紫色石蕊溶液变红色,甲可能是紫色石蕊溶液;氧化铜或氢氧化铜与硫酸反应得到蓝色溶液,含有铜离子的溶液呈蓝色,乙是碱,乙是氢氧化铜,与硫酸反应生成蓝色的硫酸铜溶液,乙的化学式为Cu(OH)2。
(2)硝酸钡(或氯化钡)与硫酸反应生成硫酸钡沉淀和硝酸(或盐酸),反应后溶液呈酸性。
(3)丁是金属,丁与稀硫酸反应的基本类型是置换反应,生成的无色气体是氢气。
(4)氧化铁或氢氧化铁与硫酸反应得到黄色溶液硫酸铁,戊是氧化物,戊的名称是氧化铁,黄色溶液中溶质成分是硫酸铁,溶液中阳离子的符号是Fe3+。
14.(6分)
(1)Na2SO4 Zn+H2SO4ZnSO4+H2↑(2分) 氢氧化钠固体溶于水也会放出热量
(2)通过澄清饱和石灰水变浑浊证明反应放热
(3)浸入烧杯水中的导管口有气泡产生
15.(5分)
(1)H2SO4
(2)2NaOH+H2SO4Na2SO4+2H2O(2分)
(3)C
(4)较多固体出现
【解析】(1)锂辉矿的主要成分为Li2CO3,X是一种酸,与碳酸锂反应生成滤液1,滤液1与氢氧化钠溶液反应生成硫酸锂溶液,则说明加入的X溶液是硫酸溶液,X的化学式为H2SO4。
(2)②中发生中和反应,即硫酸和氢氧化钠反应生成硫酸钠和水,反应的化学方程式为2NaOH+H2SO4Na2SO4+2H2O。
(3)Li2CO3在冷水中的溶解度比热水中的大,则③中应选择80 ℃,此时碳酸锂溶解度小,易结晶析出。
(4)蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余水分蒸干。
16.(6分)
(1)澄清石灰水变浑浊
(2)使产生的气体全部排入装置D中
(3)浓硫酸 B中不再产生气泡
(4)NaHCO3+HClNaCl+H2O+CO2↑(2分)
(5)(2分)
(6)①②④
17.(5分)
(1)氮肥(1分)
(2)解:设20 g该化肥中硝酸铵的质量为x。
NH4NO3+NaOHNaNO3+NH3↑+H2O
80 17
x 3.4 g(1分)
=(1分)
x=16 g(1分)
该化肥中硝酸铵的质量分数为×100%=80%(1分)
答:该化肥中硝酸铵的质量分数为80%。
题号 一 二 总分 累分人
得分
注意事项:1.共两大题17小题,满分40分。考试时间45分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5
试卷好题分析 优秀传统文化T1、T13,生产、生活情境T2、T5、T15,化学模型T4、T13
中考押题点分析 情境化命题T6、T8、T9等,项目式探究T16
一、选择题(本大题包括12小题,每小题1分,共12分。每小题的4个选项中只有1个符合题意)
1.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”里的“碱”主要是碳酸钾。物质分类中碳酸钾属于 ( )
A.酸 B.碱
C.盐 D.单质
2.化学与生活密切相关。下列叙述错误的是 ( )
A.酸和碱都有腐蚀性,使用时一定要注意安全
B.酸雨对农作物、桥梁、房子等有破坏作用
C.腌制食品时大量使用亚硝酸盐,起到保鲜作用
D.新药物的研发和使用保障了人们的身体健康
3.如图所示,一天平A、B两端各放一个烧杯,两烧杯中分别盛有浓硫酸和浓盐酸,此时,天平恰好平衡,一段时间后 ( )
A.天平A端上升
B.天平B端上升
C.天平仍处于平衡状态
D.以上情况都有可能
4.图中两圆相交部分表示相邻两种物质反应的现象。下列描述错误的是 ( )
A.a处可观察到铁逐渐变为红棕色
B.b处形成黄色溶液
C.c处有红色物质析出
D.d处有气泡产生
5.农作物适宜生长在一定酸碱度的土壤中。实验室用pH试纸测某地土壤浸出液的pH,不需要用到的仪器是 ( )
6.把自制的紫薯汁(呈紫色)分别滴加到盛有下列溶液的试管中,观察到的现象如下表所示。下列说法中不正确的是 ( )
溶液 白醋 盐酸 蔗糖水 草木灰水 氨水 石灰水
加入紫薯 汁后的颜色 红色 红色 紫色 绿色 绿色 绿色
A.白醋的水溶液呈酸性 B.草木灰的水溶液呈碱性
C.紫薯汁遇酸碱的变色情况与酚酞相同 D.紫薯汁可以用作酸碱指示剂
7.下列有关浓硫酸的说法错误的是 ( )
A.浓硫酸具有吸水性,在实验室中常用作干燥剂
B.稀释浓硫酸时要将浓硫酸沿器壁慢慢倒入水中,并不断搅拌
C.浓硫酸具有脱水性,能使纸张、布料、皮肤等脱水炭化变黑
D.不小心将浓硫酸滴在皮肤上,先用大量水冲洗,再涂上稀氢氧化钠溶液
阅读下列材料,完成8~9题。
胃液中的胃酸能确保胃和肠道的安全,同时帮助消化。胃酸分泌增多,会出现吞酸、反胃、吐酸水等现象。治疗胃酸过多的药主要有两大类:一是抑酸药,能抑制胃酸分泌,但本身不能和胃酸反应;二是抗酸药,能直接与胃酸反应,常见的抗酸药有碳酸氢钠、氢氧化铝、氧化镁、氢氧化镁和碳酸钙等。胃溃疡患者若服用不合适的抗酸药,会因胃内气体压力增大而引起胃穿孔。治疗胃酸过多时,应遵医嘱合理使用药物。
8.下列说法正确的是 ( )
A.胃酸属于纯净物 B.胃溃疡患者可服用抗酸药碳酸氢钠
C.文中提到的抗酸药都不能溶于水 D.氢氧化铝治疗胃酸发生的反应属于复分解反应
9.关于材料中提到的几种抗酸药,下列说法不正确的是 ( )
A.均属于盐或碱 B.抗酸药的用量不是越多越好
C.碳酸钙治疗胃酸过多的同时能补钙 D.碳酸氢钠治疗胃酸过多易造成胃胀气
10.化学知识对学生全面发展有重要价值,下列示例说法错误的是 ( )
A.美育:我们的青春像无色酚酞溶液遇碱一样鲜红火热
B.体育:举重、体操、单杠运动员做引体向上项目时,手上擦的镁粉(碳酸镁)能与碱反应
C.劳育:去农场帮忙,用氢氧化钙、硫酸铜溶液配制波尔多液,喷洒农药
D.德育:《天工开物》记载的“骨灰蘸秧根,……石灰淹苗足”利用石灰的碱性改良酸性土壤
11.下列关于酸碱中和反应的说法中,正确的是 ( )
A.酸碱中和反应的实质是H++OH-H2O B.生成盐和水的反应,都是中和反应
C.当酸碱完全中和时,两者所用质量一定相等 D.当酸碱完全中和时,所得盐溶液pH等于0
12.某同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器测量反应过程中pH随时间的变化情况(如图2)。下列说法错误的是 ( )
A.a为稀盐酸 B.b点所示溶液中的溶质是NaCl和NaOH
C.e点所示溶液加热蒸干所得固体为纯净物 D.d→e过程所示溶液中NaCl的质量不断增加
二、非选择题(本大题包括5小题,共28分)
13.(6分)我国早期科技丛书《物理小识·金石类》记有“矶油”硫酸,小赣同学利用思维导图归纳硫酸性质如图所示。硫酸分别与甲、乙、丙、丁、戊五种常见物质反应,请回答下列问题:
(1)甲可能是 ,乙是碱,乙的化学式为 。
(2)丙是可溶性盐,丙与硫酸完全反应后所得溶液显 (选填“酸性”“中性”或“碱性”)。
(3)丁是金属,生成的无色气体是 。
(4)戊是氧化物,戊的名称是 ,黄色溶液中阳离子的符号是 。
14.(6分)中和反应是放热反应吗 三位同学为探究此问题进行了下列实验:
(1)甲同学取一定量的NaOH溶液于试管中,逐滴加入稀硫酸,随着稀硫酸的加入,烧杯中溶液温度与加入稀硫酸质量之间的变化关系如图甲所示。B点溶液中溶质是 (填化学式);在C点溶液中加入锌粒,发生反应的化学方程式为 ;本实验选用10%的NaOH溶液而不选用NaOH固体的原因是 。
(2)乙同学按图乙装置进行实验,其中澄清饱和石灰水的作用 。
(3)丙同学按图丙装置进行实验,根据 的现象也能证明中和反应是放热的。
15.(5分)锂辉矿(Li2CO3)是制备新能源汽车电池的重要原料。下图是一种模拟提纯碳酸锂的工艺,根据要求回答问题:
【查阅资料】Ⅰ.锂辉矿的主要成分为Li2CO3,含泥沙等杂质。
Ⅱ.Li2CO3(化学性质与Na2CO3类似)为无色晶体,微溶于水,在冷水中的溶解度比热水中的大。
(1)X是一种酸,其化学式为 。
(2)②中发生中和反应的化学方程式为 。
(3)有以下三种温度的饱和Na2CO3溶液,③中你选择的温度是 (填字母)。
A.0 ℃ B.25 ℃ C.80 ℃
(4)将滤液2蒸发,当观察到有 时,停止加热,可得到其他化工产品。
16.(6分)小志同学喜欢喝苏打水,每次他大口喝完都忍不住打嗝。对此他感到困惑:为什么喝苏打水会打嗝呢
探究一:喝苏打水打嗝的原因
成分表
品名:苏打水饮料
配料:水,碳酸氢钠,氯化钾,柠檬酸,安赛蜜,食用香精
查看苏打水成分表后,他猜想是碳酸氢钠和胃酸发生反应生成大量的二氧化碳,导致打嗝。
(1)为了验证猜想,他在实验室取一定量稀盐酸,将苏打水和其反应生成的气体通入澄清石灰水中,观察到 ,小志验证了猜想。
探究二:苏打水中碳酸氢钠的质量
小志同学又有了新的问题:这瓶500 mL苏打水中含有多少碳酸氢钠 于是小志设计了如下实验装置。
【查阅资料】碱石灰的成分是氢氧化钠和氧化钙。
【实验过程】Ⅰ.检查装置气密性,量取200 mL苏打水加入锥形瓶中,往分液漏斗中加入足量稀盐酸,连接已加入足量试剂的其他装置。
Ⅱ.实验开始前,打开弹簧夹a先通入一定量空气,然后称量装置D的质量m1。
Ⅲ.关闭弹簧夹a,拿掉分液漏斗的玻璃塞,转动活塞,使稀盐酸缓缓滴下。
Ⅳ.待装置B内反应结束,关闭分液漏斗活塞,打开弹簧夹a通入一段时间空气,测得装置D增重m2。
【实验分析】
(2)步骤Ⅳ中打开弹簧夹a通入一段时间空气的目的是 。
(3)装置C中盛装的试剂是 ;如何判断装置B中反应结束了 。
(4)写出苏打水中的碳酸氢钠与胃酸反应的化学方程式: 。
注意:若答对第(5)(6)小题奖励3分,化学总得分不超过40分。
(5)用所给数据表示出500 mL苏打水中碳酸氢钠的质量: (用代数式表示)。
(6)关于该实验,下列说法正确的是 (填标号)。
①实验前先通空气是为了除去装置内空气中的二氧化碳,防止其影响实验结果
②若无装置A,改通氮气也能完成实验
③若无装置E,会使测量结果偏小
④适量饮用苏打水可缓解胃酸过多
17.(5分)同学们在劳动课上给班级小菜园施肥。为测定所用化肥中硝酸铵的质量分数,进行了如下实验:称取20 g化肥样品于烧杯中,加水至样品完全溶解,向所得溶液中逐滴加入150 g氢氧化钠溶液,发生反应NH4NO3+NaOHNaNO3+NH3↑+H2O,测得产生氨气的质量与滴加氢氧化钠溶液的质量的关系如图所示。(假设氨气全部逸出且被测量)
(1)硝酸铵属于 (选填“氮肥”或“复合肥”)。
(2)计算该化肥中硝酸铵的质量分数。(写出计算过程)
参考答案
1.C 2.C 3.B
4.B
【解析】A.铁在潮湿空气中锈蚀,a处可观察到铁逐渐变为红棕色,正确;B.铁与稀盐酸反应生成氯化亚铁和氢气,b处形成浅绿色溶液,错误;C.铁与硫酸铜反应生成硫酸亚铁和铜,c处有红色物质析出,正确;D.稀盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,d处有气泡产生,正确。
5.D 6.C 7.D 8.D 9.A 10.B
11.A
【解析】A.酸碱中和反应的实质是H+和OH-结合生成水分子,即H++OH-H2O,正确;B.中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如用稀盐酸除铁锈生成氯化铁和水,错误;C.氢氧化钠和盐酸反应生成了氯化钠和水,每40份质量的NaOH能和36.5份质量的HCl恰好完全反应,错误;D.氢氧化钠和盐酸反应生成了氯化钠和水,完全中和时,所得溶液即氯化钠溶液为中性,pH等于7,错误。
12.D
【解析】A.由图像可知,开始时pH大于7,逐渐减小到7,然后小于7,可知原溶液显碱性,然后不断地加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中,则图1中滴加的a溶液为稀盐酸,正确;B.盐酸与氢氧化钠反应生成氯化钠和水,b点所示溶液pH大于7,说明氢氧化钠有剩余,故b点所示溶液中的溶质是NaCl和NaOH,正确;C.e点所示溶液pH小于7,盐酸过量,溶液中溶质为NaCl和HCl,加热蒸干过程中HCl挥发掉,所得固体只有NaCl,为纯净物,正确;D.d点所示溶液pH=7,盐酸与氢氧化钠恰好完全反应,d→e过程中盐酸过量,溶液中NaCl的质量不变,错误。
13.(6分)
(1)紫色石蕊溶液 Cu(OH)2
(2)酸性
(3)氢气(或H2)
(4)氧化铁 Fe3+
【解析】(1)硫酸能使紫色石蕊溶液变红色,甲可能是紫色石蕊溶液;氧化铜或氢氧化铜与硫酸反应得到蓝色溶液,含有铜离子的溶液呈蓝色,乙是碱,乙是氢氧化铜,与硫酸反应生成蓝色的硫酸铜溶液,乙的化学式为Cu(OH)2。
(2)硝酸钡(或氯化钡)与硫酸反应生成硫酸钡沉淀和硝酸(或盐酸),反应后溶液呈酸性。
(3)丁是金属,丁与稀硫酸反应的基本类型是置换反应,生成的无色气体是氢气。
(4)氧化铁或氢氧化铁与硫酸反应得到黄色溶液硫酸铁,戊是氧化物,戊的名称是氧化铁,黄色溶液中溶质成分是硫酸铁,溶液中阳离子的符号是Fe3+。
14.(6分)
(1)Na2SO4 Zn+H2SO4ZnSO4+H2↑(2分) 氢氧化钠固体溶于水也会放出热量
(2)通过澄清饱和石灰水变浑浊证明反应放热
(3)浸入烧杯水中的导管口有气泡产生
15.(5分)
(1)H2SO4
(2)2NaOH+H2SO4Na2SO4+2H2O(2分)
(3)C
(4)较多固体出现
【解析】(1)锂辉矿的主要成分为Li2CO3,X是一种酸,与碳酸锂反应生成滤液1,滤液1与氢氧化钠溶液反应生成硫酸锂溶液,则说明加入的X溶液是硫酸溶液,X的化学式为H2SO4。
(2)②中发生中和反应,即硫酸和氢氧化钠反应生成硫酸钠和水,反应的化学方程式为2NaOH+H2SO4Na2SO4+2H2O。
(3)Li2CO3在冷水中的溶解度比热水中的大,则③中应选择80 ℃,此时碳酸锂溶解度小,易结晶析出。
(4)蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余水分蒸干。
16.(6分)
(1)澄清石灰水变浑浊
(2)使产生的气体全部排入装置D中
(3)浓硫酸 B中不再产生气泡
(4)NaHCO3+HClNaCl+H2O+CO2↑(2分)
(5)(2分)
(6)①②④
17.(5分)
(1)氮肥(1分)
(2)解:设20 g该化肥中硝酸铵的质量为x。
NH4NO3+NaOHNaNO3+NH3↑+H2O
80 17
x 3.4 g(1分)
=(1分)
x=16 g(1分)
该化肥中硝酸铵的质量分数为×100%=80%(1分)
答:该化肥中硝酸铵的质量分数为80%。
同课章节目录
