2025年中考化学一轮专题复习 科学探究与化学实验 专题测试卷(一)(含答案)
文档属性
| 名称 | 2025年中考化学一轮专题复习 科学探究与化学实验 专题测试卷(一)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 226.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-06 15:16:10 | ||
图片预览

文档简介
科学探究与化学实验 专题测试卷(一)
一、选择题
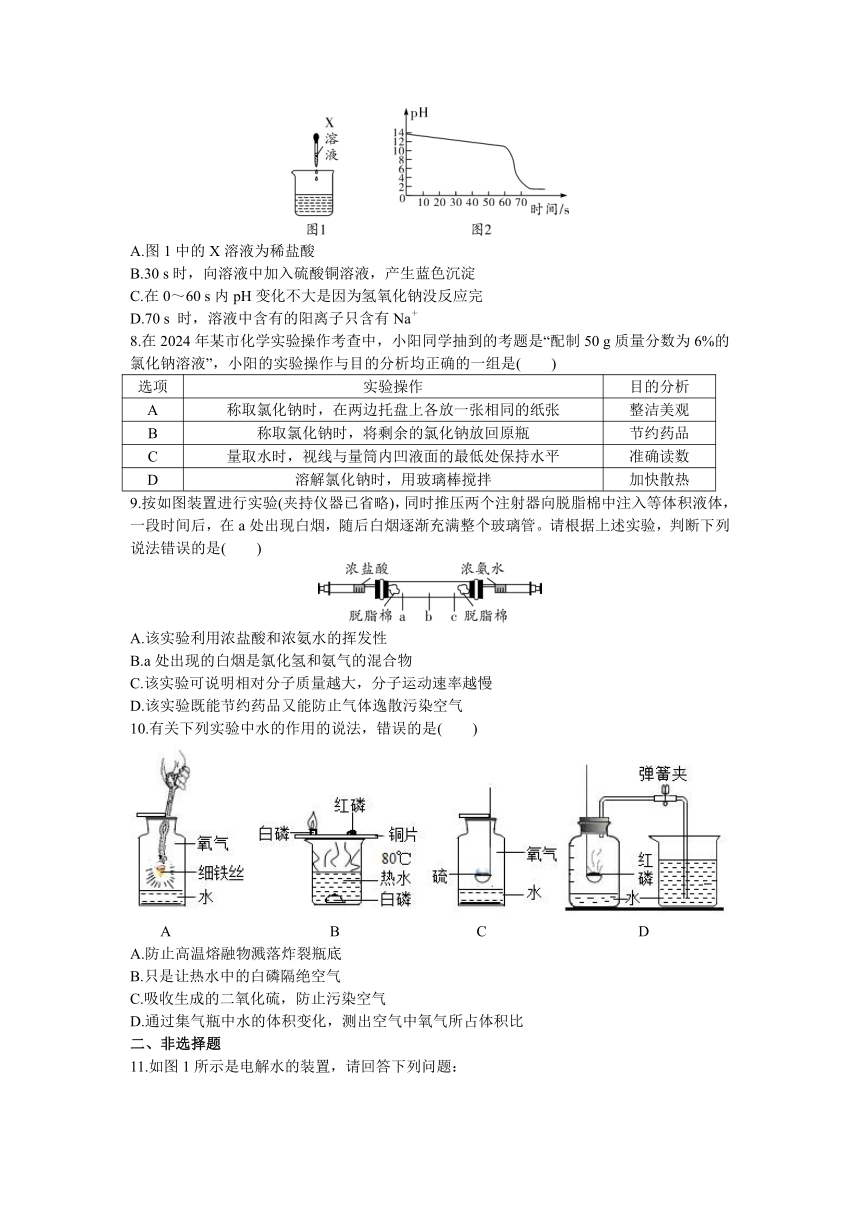
1.下列基本实验操作正确的是( )
2.下面是某同学学习笔记中有关实验现象的描述,其中正确的是( )
A.打开浓硫酸试剂瓶的瓶盖,瓶口出现白雾
B.木炭在空气中燃烧,生成二氧化碳
C.向稀盐酸中滴加酚酞溶液,溶液由无色变为红色
D.氯化铵与熟石灰混合研磨,会闻到刺激性气味
3.氢氧化钙是常见的碱,下列有关其说法正确的是( )
A.易溶于水且溶解时放出大量热 B.溶解度随温度的升高而增大
C.可用于处理酸性废水 D.其溶液常用于实验室吸收二氧化碳
4.下列实验现象既能体现二氧化碳的物理性质,又能体现其化学性质的是( )
A.蜡烛自下而上熄灭 B.软塑料瓶变瘪 C.石蕊溶液变红 D.气球上浮
5.某金属R在化合物中常显+1价,R的金属活动性比铜弱。某同学为了验证R、铝、铜的金属活动性顺序,取三种金属片,并选用了下列的溶液进行探究,无法达到实验目的的是( )
A.CuSO4溶液 B.稀硫酸、CuSO4溶液
C.稀硫酸、Al2(SO4)3溶液 D.Al(NO3)3溶液、RNO3溶液
6.下列探究燃烧条件的实验中,只能得出“燃烧需要温度达到可燃物的着火点”的是( )
7.实验室利用数字化实验测定氢氧化钠溶液和稀盐酸反应(图1)的pH变化曲线如图2所示,下列说法错误的是( )
A.图1中的X溶液为稀盐酸
B.30 s时,向溶液中加入硫酸铜溶液,产生蓝色沉淀
C.在0~60 s内pH变化不大是因为氢氧化钠没反应完
D.70 s 时,溶液中含有的阳离子只含有Na+
8.在2024年某市化学实验操作考查中,小阳同学抽到的考题是“配制50 g质量分数为6%的氯化钠溶液”,小阳的实验操作与目的分析均正确的一组是( )
选项 实验操作 目的分析
A 称取氯化钠时,在两边托盘上各放一张相同的纸张 整洁美观
B 称取氯化钠时,将剩余的氯化钠放回原瓶 节约药品
C 量取水时,视线与量筒内凹液面的最低处保持水平 准确读数
D 溶解氯化钠时,用玻璃棒搅拌 加快散热
9.按如图装置进行实验(夹持仪器已省略),同时推压两个注射器向脱脂棉中注入等体积液体,一段时间后,在a处出现白烟,随后白烟逐渐充满整个玻璃管。请根据上述实验,判断下列说法错误的是( )
A.该实验利用浓盐酸和浓氨水的挥发性
B.a处出现的白烟是氯化氢和氨气的混合物
C.该实验可说明相对分子质量越大,分子运动速率越慢
D.该实验既能节约药品又能防止气体逸散污染空气
10.有关下列实验中水的作用的说法,错误的是( )
A B C D
A.防止高温熔融物溅落炸裂瓶底
B.只是让热水中的白磷隔绝空气
C.吸收生成的二氧化硫,防止污染空气
D.通过集气瓶中水的体积变化,测出空气中氧气所占体积比
二、非选择题
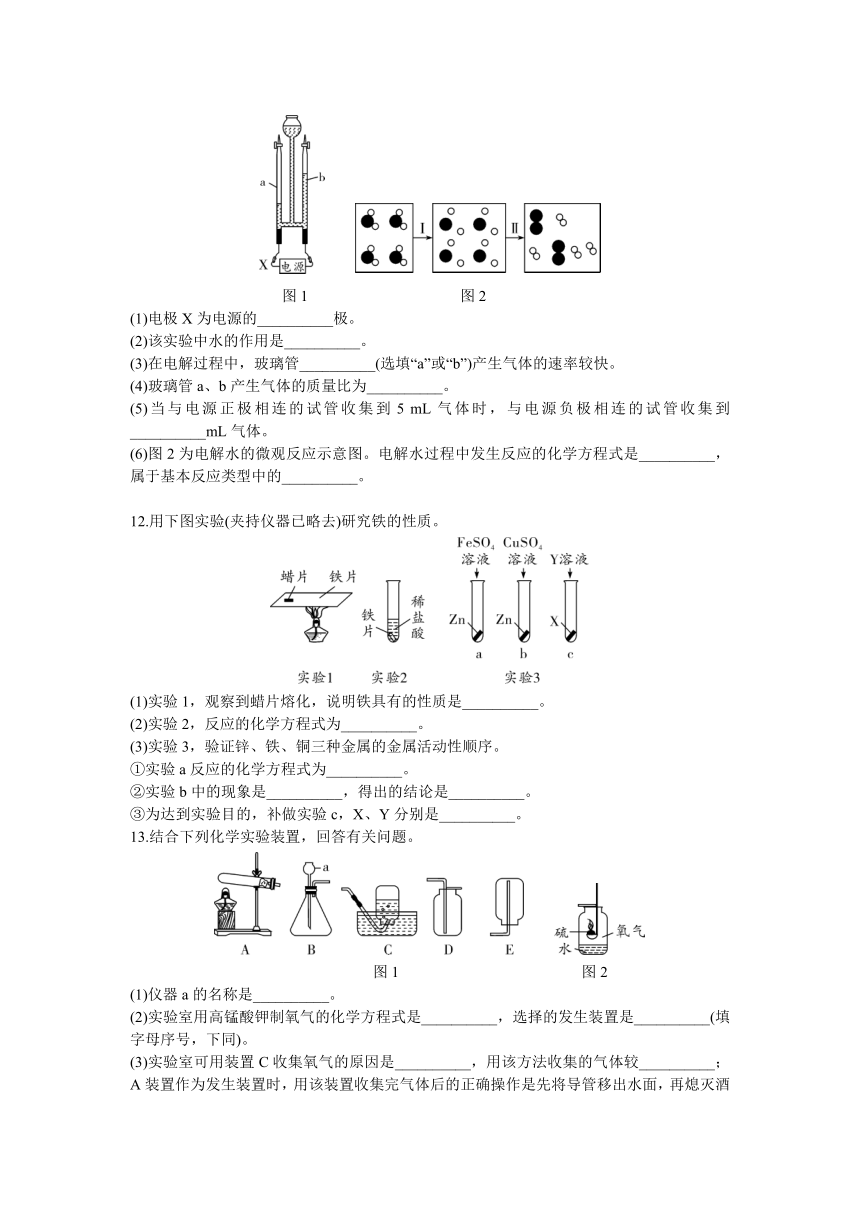
11.如图1所示是电解水的装置,请回答下列问题:
图1 图2
(1)电极X为电源的__________极。
(2)该实验中水的作用是__________。
(3)在电解过程中,玻璃管__________(选填“a”或“b”)产生气体的速率较快。
(4)玻璃管a、b产生气体的质量比为__________。
(5)当与电源正极相连的试管收集到5 mL气体时,与电源负极相连的试管收集到__________mL气体。
(6)图2为电解水的微观反应示意图。电解水过程中发生反应的化学方程式是__________,属于基本反应类型中的__________。
12.用下图实验(夹持仪器已略去)研究铁的性质。
(1)实验1,观察到蜡片熔化,说明铁具有的性质是__________。
(2)实验2,反应的化学方程式为__________。
(3)实验3,验证锌、铁、铜三种金属的金属活动性顺序。
①实验a反应的化学方程式为__________。
②实验b中的现象是__________,得出的结论是__________。
③为达到实验目的,补做实验c,X、Y分别是__________。
13.结合下列化学实验装置,回答有关问题。
图1 图2
(1)仪器a的名称是__________。
(2)实验室用高锰酸钾制氧气的化学方程式是__________,选择的发生装置是__________(填字母序号,下同)。
(3)实验室可用装置C收集氧气的原因是__________,用该方法收集的气体较__________;A装置作为发生装置时,用该装置收集完气体后的正确操作是先将导管移出水面,再熄灭酒精灯,原因是__________。
(4)硫在氧气中燃烧的实验装置如图2所示,当火焰变得微弱时,将燃烧匙进一步伸入瓶底,火焰又变旺,可得出氧气的一条物理性质是__________。
(5)用装置C收集气体时,待集气瓶里的水排完后,__________(填操作),把集气瓶移出水槽,正放在桌上。
14.实验室对含有MgCl2的粗盐进行提纯。步骤如下图所示:
(1)步骤①中,称量50 g粗盐需用到的主要仪器是__________。
(2)步骤②中,量取液体时,视线与__________相平。
(3)步骤③中,滴加过量NaOH溶液除去MgCl2反应的化学方程式为__________。
(4)步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是__________(填代号)。
A.稀盐酸 B.稀硫酸 C.稀硝酸
(5)步骤⑥中,操作的名称是__________。
(6)步骤④过滤后滤液仍出现浑浊,产生该现象的原因是__________。
(7)步骤⑥中,用玻璃棒不断搅拌的目的是__________。
15.工业上处理黄铜渣(含Cu、Zn、CuO、ZnO和杂质)废料时,通常将其转化为硫酸锌并回收铜(黄铜渣中的杂质不溶于水,也不参与反应),其主要流程如图所示:
查阅资料: 2Cu+2H2SO4+O22CuSO4+2H2O。
(1)黄铜的熔点比铜的熔点__________(填“高”或“低”)。
(2)过程Ⅱ中发生反应的化学方程式是__________。
(3)过程Ⅲ中分离操作需要用到的玻璃仪器有烧杯、玻璃棒和__________(填仪器名称)。
(4)过程Ⅱ中加入过量锌的目的是__________。
(5)上述流程中,能判断出锌的金属活动性比铜强的事实是__________。
(6)溶液C的溶质成分为__________(填化学式),欲从该溶液中获得相应晶体,应进行的操作为__________。
16.班级兴趣小组将一定量的稀盐酸加入到盛有足量石灰石的烧杯中,一段时间后,发现烧杯中仍有固体剩余,但不再有气泡产生。同学们对此展开了如下探究:
(1)写出石灰石与稀盐酸反应的化学方程式__________。
【提出问题】肉眼看不到气泡,反应是不是真的停止了?
猜想1:反应停止,稀盐酸反应完了。
猜想2:反应没有停止,只是稀盐酸浓度太小。
【查阅资料】氯化钙溶液显中性;碳酸钠溶液与少量盐酸反应生成碳酸氢钠和氯化钠。
【定性研究】根据猜想1、2,设计下表实验:
实验编号 实验步骤 实验现象
① 取碳酸钠溶液2 mL于试管中,滴加3滴反应后剩余溶液 无气泡产生
② 取反应后剩余溶液2 mL于试管中,滴加无色酚酞溶液 无明显现象
(2)根据实验①中的现象,小明认为猜想1合理,你是否赞同他的说法,请说明理由__________。大家都认为实验②设计不合理,请你说出理由并进行改进__________。
【实验结论】根据改进后实验的现象,得知反应后的溶液仍然显酸性。
【定量研究】资料表明二氧化碳饱和溶液的pH约为5.6。小明用pH试纸测得待测溶液的pH=2.3。
(3)大家认为小明的实验数据不合理,请你作出解释__________。通过定量研究,大家都认为盐酸没有反应完,原因是__________。
【查阅资料】碳酸钙和二氧化碳、水反应生成碳酸氢钙,其溶液的pH>5.6。
(4)兴趣小组同学用pH传感器测出反应后不同时间溶液的pH(如图)。
①A点对应溶液中含有的溶质为__________(写化学式)。
②BC段发生反应的化学方程式为__________。
17.酸碱盐是初中化学的重点,某实验小组对氢氧化钙的部分化学性质进行研究:
(1)与指示剂作用:向氢氧化钙溶液中滴加无色酚酞溶液,观察到的现象是__________。
(2)与酸反应:将氢氧化钙溶液滴加到稀盐酸中,没有明显现象,可用下列试剂__________(填序号)验证该反应发生了。
①硝酸银溶液 ②氯化钠溶液 ③紫色石蕊溶液
(3)与盐溶液反应:碳酸钠溶液与氢氧化钙溶液发生反应的化学方程式是__________。
同学们用饱和澄清石灰水与碳酸钠溶液进行如图所示实验,实验中未观察到浑浊现象,于是对此异常现象进行如下探究。
【猜想与假设】
猜想一:氢氧化钙溶液的浓度偏低;
猜想二:碳酸钠溶液的浓度偏低。
(4)经讨论,同学们认为猜想一不合理,理由是__________。
【实验设计】
编号 1 2 3
实验方案
现象 浑浊 浑浊 不浑浊
【得出结论】由上述实验过程可知,猜想二__________(填“成立”或“不成立”)。
(5)小明提出可能是反应生成的沉淀溶于碳酸钠溶液中了,为进一步验证猜想,小明将实验1所得的浑浊液过滤,将滤渣分为两等份分别加入A、B两支试管中,向 A试管中加入2mL水,向 B试管中加入__________,振荡,观察到__________,证明此猜想正确。
(6)由上述实验方案可知,反应物浓度不同可能会影响反应的现象或结果,请你举出一个此类现象的例子__________。
18.课外活动小组为测定某未知稀硫酸的质量分数,进行了下面实验:
①取10g稀硫酸于烧杯中,逐滴滴加BaCl2溶液,至不再产生白色沉淀为止,经过滤、洗涤、干燥后,称得沉淀物的质量为4.71g。
②为保障测定结果的精确性,按实验①操作又连续进行了四次相同的实验。几次实验所得数据见下表:
第一次 第二次 第三次 第四次 第五次
固体质量/g 4.71 4.63 4.64 4.66 4.66
分析实验与表中数据后,回答下列问题:
(1)第一次实验测得数据明显偏高,可能的原因是__________。
(2)五次测定结果的平均值是__________。
(3)请利用(2)中数据计算未知稀硫酸的质量分数。(写出计算过程)
参考答案
1.D 2.D 3.C 4.A 5.C 6.B 7.D 8.C 9.B 10.B
11.(1)负 (2)作反应物 (3)a (4)1∶8 (5)10 (6)2H2O2H2↑+O2↑ 分解反应
12.(1)导热性 (2)Fe+2HCl=FeCl2+H2↑ (3)①Zn+FeSO4=Fe+ZnSO4 ②锌片表面有红色固体析出,溶液颜色逐渐变浅 锌的金属活动性大于铜 ③Fe、CuSO4 (或Cu、FeSO4)
13.(1)长颈漏斗 (2)2KMnO4K2MnO4+MnO2+O2 ↑ A (3)氧气不易溶于水 纯净 防止水槽中的水倒吸入热的试管中,导致试管炸裂 (4)密度比空气大 (5)在水面下用玻璃片盖住集气瓶瓶口
14.(1)托盘天平 (2)液体凹液面的最低处 (3)MgCl2+2NaOH=Mg(OH)2↓+2NaCl (4)A (5)蒸发
15.(1)低 (2)Zn+CuSO4=ZnSO4+Cu (3)漏斗 (4)将溶液中的硫酸铜全部转化为硫酸锌和铜 (5)过程Ⅱ 中,锌能置换出硫酸铜中的铜(合理即可) (6)ZnSO4 蒸发溶剂(合理即可)
16. (1)CaCO3+2HCl=CaCl2+H2O+CO2↑ (2)不赞同;当反应后剩余溶液中盐酸浓度太小时,滴加到碳酸钠溶液中反应生成氯化钠和碳酸氢钠,没有气泡产生 滴加无色酚酞溶液后不变色只能说明溶液不显碱性,若溶液中含有盐酸,也不能使无色酚酞溶液变色,需要换成紫色石蕊溶液(合理即可) (3)pH试纸测得的pH只能为整数 二氧化碳饱和溶液的pH约为5.6,测得溶液的pH=2.3,说明盐酸没有反应完 (4)①HCl、CaCl2 ②CaCO3+H2O+CO2= Ca(HCO3)2
17.(1)溶液变红 (2)③ (3)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH (4)饱和石灰水已是实验温度下溶质质量分数最大的溶液(或该温度下氢氧化钙饱和溶液的溶质质量分数最大) 【得出结论】不成立 附加问:(5)2mL 10%碳酸钠溶液 试管A中滤渣不溶解,试管B中滤渣溶解(或减少) (6)硫在空气中燃烧发出微弱的淡蓝色火焰,在氧气中燃烧发出明亮的蓝紫色火焰(合理即可)
18.(1)沉淀未完全干燥(合理即可) (2)4.66 g
(3)解:设10g该稀硫酸中溶质的质量为x
BaCl2+H2SO4=BaSO4↓+2HCl
98 233
x 4.66 g
=
X=1.96g
所以该稀硫酸的溶质质量分数是×100%=19.6%
答:未知稀硫酸的溶质质量分数为19.6%。
一、选择题
1.下列基本实验操作正确的是( )
2.下面是某同学学习笔记中有关实验现象的描述,其中正确的是( )
A.打开浓硫酸试剂瓶的瓶盖,瓶口出现白雾
B.木炭在空气中燃烧,生成二氧化碳
C.向稀盐酸中滴加酚酞溶液,溶液由无色变为红色
D.氯化铵与熟石灰混合研磨,会闻到刺激性气味
3.氢氧化钙是常见的碱,下列有关其说法正确的是( )
A.易溶于水且溶解时放出大量热 B.溶解度随温度的升高而增大
C.可用于处理酸性废水 D.其溶液常用于实验室吸收二氧化碳
4.下列实验现象既能体现二氧化碳的物理性质,又能体现其化学性质的是( )
A.蜡烛自下而上熄灭 B.软塑料瓶变瘪 C.石蕊溶液变红 D.气球上浮
5.某金属R在化合物中常显+1价,R的金属活动性比铜弱。某同学为了验证R、铝、铜的金属活动性顺序,取三种金属片,并选用了下列的溶液进行探究,无法达到实验目的的是( )
A.CuSO4溶液 B.稀硫酸、CuSO4溶液
C.稀硫酸、Al2(SO4)3溶液 D.Al(NO3)3溶液、RNO3溶液
6.下列探究燃烧条件的实验中,只能得出“燃烧需要温度达到可燃物的着火点”的是( )
7.实验室利用数字化实验测定氢氧化钠溶液和稀盐酸反应(图1)的pH变化曲线如图2所示,下列说法错误的是( )
A.图1中的X溶液为稀盐酸
B.30 s时,向溶液中加入硫酸铜溶液,产生蓝色沉淀
C.在0~60 s内pH变化不大是因为氢氧化钠没反应完
D.70 s 时,溶液中含有的阳离子只含有Na+
8.在2024年某市化学实验操作考查中,小阳同学抽到的考题是“配制50 g质量分数为6%的氯化钠溶液”,小阳的实验操作与目的分析均正确的一组是( )
选项 实验操作 目的分析
A 称取氯化钠时,在两边托盘上各放一张相同的纸张 整洁美观
B 称取氯化钠时,将剩余的氯化钠放回原瓶 节约药品
C 量取水时,视线与量筒内凹液面的最低处保持水平 准确读数
D 溶解氯化钠时,用玻璃棒搅拌 加快散热
9.按如图装置进行实验(夹持仪器已省略),同时推压两个注射器向脱脂棉中注入等体积液体,一段时间后,在a处出现白烟,随后白烟逐渐充满整个玻璃管。请根据上述实验,判断下列说法错误的是( )
A.该实验利用浓盐酸和浓氨水的挥发性
B.a处出现的白烟是氯化氢和氨气的混合物
C.该实验可说明相对分子质量越大,分子运动速率越慢
D.该实验既能节约药品又能防止气体逸散污染空气
10.有关下列实验中水的作用的说法,错误的是( )
A B C D
A.防止高温熔融物溅落炸裂瓶底
B.只是让热水中的白磷隔绝空气
C.吸收生成的二氧化硫,防止污染空气
D.通过集气瓶中水的体积变化,测出空气中氧气所占体积比
二、非选择题
11.如图1所示是电解水的装置,请回答下列问题:
图1 图2
(1)电极X为电源的__________极。
(2)该实验中水的作用是__________。
(3)在电解过程中,玻璃管__________(选填“a”或“b”)产生气体的速率较快。
(4)玻璃管a、b产生气体的质量比为__________。
(5)当与电源正极相连的试管收集到5 mL气体时,与电源负极相连的试管收集到__________mL气体。
(6)图2为电解水的微观反应示意图。电解水过程中发生反应的化学方程式是__________,属于基本反应类型中的__________。
12.用下图实验(夹持仪器已略去)研究铁的性质。
(1)实验1,观察到蜡片熔化,说明铁具有的性质是__________。
(2)实验2,反应的化学方程式为__________。
(3)实验3,验证锌、铁、铜三种金属的金属活动性顺序。
①实验a反应的化学方程式为__________。
②实验b中的现象是__________,得出的结论是__________。
③为达到实验目的,补做实验c,X、Y分别是__________。
13.结合下列化学实验装置,回答有关问题。
图1 图2
(1)仪器a的名称是__________。
(2)实验室用高锰酸钾制氧气的化学方程式是__________,选择的发生装置是__________(填字母序号,下同)。
(3)实验室可用装置C收集氧气的原因是__________,用该方法收集的气体较__________;A装置作为发生装置时,用该装置收集完气体后的正确操作是先将导管移出水面,再熄灭酒精灯,原因是__________。
(4)硫在氧气中燃烧的实验装置如图2所示,当火焰变得微弱时,将燃烧匙进一步伸入瓶底,火焰又变旺,可得出氧气的一条物理性质是__________。
(5)用装置C收集气体时,待集气瓶里的水排完后,__________(填操作),把集气瓶移出水槽,正放在桌上。
14.实验室对含有MgCl2的粗盐进行提纯。步骤如下图所示:
(1)步骤①中,称量50 g粗盐需用到的主要仪器是__________。
(2)步骤②中,量取液体时,视线与__________相平。
(3)步骤③中,滴加过量NaOH溶液除去MgCl2反应的化学方程式为__________。
(4)步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是__________(填代号)。
A.稀盐酸 B.稀硫酸 C.稀硝酸
(5)步骤⑥中,操作的名称是__________。
(6)步骤④过滤后滤液仍出现浑浊,产生该现象的原因是__________。
(7)步骤⑥中,用玻璃棒不断搅拌的目的是__________。
15.工业上处理黄铜渣(含Cu、Zn、CuO、ZnO和杂质)废料时,通常将其转化为硫酸锌并回收铜(黄铜渣中的杂质不溶于水,也不参与反应),其主要流程如图所示:
查阅资料: 2Cu+2H2SO4+O22CuSO4+2H2O。
(1)黄铜的熔点比铜的熔点__________(填“高”或“低”)。
(2)过程Ⅱ中发生反应的化学方程式是__________。
(3)过程Ⅲ中分离操作需要用到的玻璃仪器有烧杯、玻璃棒和__________(填仪器名称)。
(4)过程Ⅱ中加入过量锌的目的是__________。
(5)上述流程中,能判断出锌的金属活动性比铜强的事实是__________。
(6)溶液C的溶质成分为__________(填化学式),欲从该溶液中获得相应晶体,应进行的操作为__________。
16.班级兴趣小组将一定量的稀盐酸加入到盛有足量石灰石的烧杯中,一段时间后,发现烧杯中仍有固体剩余,但不再有气泡产生。同学们对此展开了如下探究:
(1)写出石灰石与稀盐酸反应的化学方程式__________。
【提出问题】肉眼看不到气泡,反应是不是真的停止了?
猜想1:反应停止,稀盐酸反应完了。
猜想2:反应没有停止,只是稀盐酸浓度太小。
【查阅资料】氯化钙溶液显中性;碳酸钠溶液与少量盐酸反应生成碳酸氢钠和氯化钠。
【定性研究】根据猜想1、2,设计下表实验:
实验编号 实验步骤 实验现象
① 取碳酸钠溶液2 mL于试管中,滴加3滴反应后剩余溶液 无气泡产生
② 取反应后剩余溶液2 mL于试管中,滴加无色酚酞溶液 无明显现象
(2)根据实验①中的现象,小明认为猜想1合理,你是否赞同他的说法,请说明理由__________。大家都认为实验②设计不合理,请你说出理由并进行改进__________。
【实验结论】根据改进后实验的现象,得知反应后的溶液仍然显酸性。
【定量研究】资料表明二氧化碳饱和溶液的pH约为5.6。小明用pH试纸测得待测溶液的pH=2.3。
(3)大家认为小明的实验数据不合理,请你作出解释__________。通过定量研究,大家都认为盐酸没有反应完,原因是__________。
【查阅资料】碳酸钙和二氧化碳、水反应生成碳酸氢钙,其溶液的pH>5.6。
(4)兴趣小组同学用pH传感器测出反应后不同时间溶液的pH(如图)。
①A点对应溶液中含有的溶质为__________(写化学式)。
②BC段发生反应的化学方程式为__________。
17.酸碱盐是初中化学的重点,某实验小组对氢氧化钙的部分化学性质进行研究:
(1)与指示剂作用:向氢氧化钙溶液中滴加无色酚酞溶液,观察到的现象是__________。
(2)与酸反应:将氢氧化钙溶液滴加到稀盐酸中,没有明显现象,可用下列试剂__________(填序号)验证该反应发生了。
①硝酸银溶液 ②氯化钠溶液 ③紫色石蕊溶液
(3)与盐溶液反应:碳酸钠溶液与氢氧化钙溶液发生反应的化学方程式是__________。
同学们用饱和澄清石灰水与碳酸钠溶液进行如图所示实验,实验中未观察到浑浊现象,于是对此异常现象进行如下探究。
【猜想与假设】
猜想一:氢氧化钙溶液的浓度偏低;
猜想二:碳酸钠溶液的浓度偏低。
(4)经讨论,同学们认为猜想一不合理,理由是__________。
【实验设计】
编号 1 2 3
实验方案
现象 浑浊 浑浊 不浑浊
【得出结论】由上述实验过程可知,猜想二__________(填“成立”或“不成立”)。
(5)小明提出可能是反应生成的沉淀溶于碳酸钠溶液中了,为进一步验证猜想,小明将实验1所得的浑浊液过滤,将滤渣分为两等份分别加入A、B两支试管中,向 A试管中加入2mL水,向 B试管中加入__________,振荡,观察到__________,证明此猜想正确。
(6)由上述实验方案可知,反应物浓度不同可能会影响反应的现象或结果,请你举出一个此类现象的例子__________。
18.课外活动小组为测定某未知稀硫酸的质量分数,进行了下面实验:
①取10g稀硫酸于烧杯中,逐滴滴加BaCl2溶液,至不再产生白色沉淀为止,经过滤、洗涤、干燥后,称得沉淀物的质量为4.71g。
②为保障测定结果的精确性,按实验①操作又连续进行了四次相同的实验。几次实验所得数据见下表:
第一次 第二次 第三次 第四次 第五次
固体质量/g 4.71 4.63 4.64 4.66 4.66
分析实验与表中数据后,回答下列问题:
(1)第一次实验测得数据明显偏高,可能的原因是__________。
(2)五次测定结果的平均值是__________。
(3)请利用(2)中数据计算未知稀硫酸的质量分数。(写出计算过程)
参考答案
1.D 2.D 3.C 4.A 5.C 6.B 7.D 8.C 9.B 10.B
11.(1)负 (2)作反应物 (3)a (4)1∶8 (5)10 (6)2H2O2H2↑+O2↑ 分解反应
12.(1)导热性 (2)Fe+2HCl=FeCl2+H2↑ (3)①Zn+FeSO4=Fe+ZnSO4 ②锌片表面有红色固体析出,溶液颜色逐渐变浅 锌的金属活动性大于铜 ③Fe、CuSO4 (或Cu、FeSO4)
13.(1)长颈漏斗 (2)2KMnO4K2MnO4+MnO2+O2 ↑ A (3)氧气不易溶于水 纯净 防止水槽中的水倒吸入热的试管中,导致试管炸裂 (4)密度比空气大 (5)在水面下用玻璃片盖住集气瓶瓶口
14.(1)托盘天平 (2)液体凹液面的最低处 (3)MgCl2+2NaOH=Mg(OH)2↓+2NaCl (4)A (5)蒸发
15.(1)低 (2)Zn+CuSO4=ZnSO4+Cu (3)漏斗 (4)将溶液中的硫酸铜全部转化为硫酸锌和铜 (5)过程Ⅱ 中,锌能置换出硫酸铜中的铜(合理即可) (6)ZnSO4 蒸发溶剂(合理即可)
16. (1)CaCO3+2HCl=CaCl2+H2O+CO2↑ (2)不赞同;当反应后剩余溶液中盐酸浓度太小时,滴加到碳酸钠溶液中反应生成氯化钠和碳酸氢钠,没有气泡产生 滴加无色酚酞溶液后不变色只能说明溶液不显碱性,若溶液中含有盐酸,也不能使无色酚酞溶液变色,需要换成紫色石蕊溶液(合理即可) (3)pH试纸测得的pH只能为整数 二氧化碳饱和溶液的pH约为5.6,测得溶液的pH=2.3,说明盐酸没有反应完 (4)①HCl、CaCl2 ②CaCO3+H2O+CO2= Ca(HCO3)2
17.(1)溶液变红 (2)③ (3)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH (4)饱和石灰水已是实验温度下溶质质量分数最大的溶液(或该温度下氢氧化钙饱和溶液的溶质质量分数最大) 【得出结论】不成立 附加问:(5)2mL 10%碳酸钠溶液 试管A中滤渣不溶解,试管B中滤渣溶解(或减少) (6)硫在空气中燃烧发出微弱的淡蓝色火焰,在氧气中燃烧发出明亮的蓝紫色火焰(合理即可)
18.(1)沉淀未完全干燥(合理即可) (2)4.66 g
(3)解:设10g该稀硫酸中溶质的质量为x
BaCl2+H2SO4=BaSO4↓+2HCl
98 233
x 4.66 g
=
X=1.96g
所以该稀硫酸的溶质质量分数是×100%=19.6%
答:未知稀硫酸的溶质质量分数为19.6%。
同课章节目录
