2025中考化学专题复习练习题:构成物质的微粒元素(含解析)
文档属性
| 名称 | 2025中考化学专题复习练习题:构成物质的微粒元素(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 545.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-06 22:51:38 | ||
图片预览

文档简介
2025中考化学专题复习练习题构成物质的微粒、元素
一、选择题
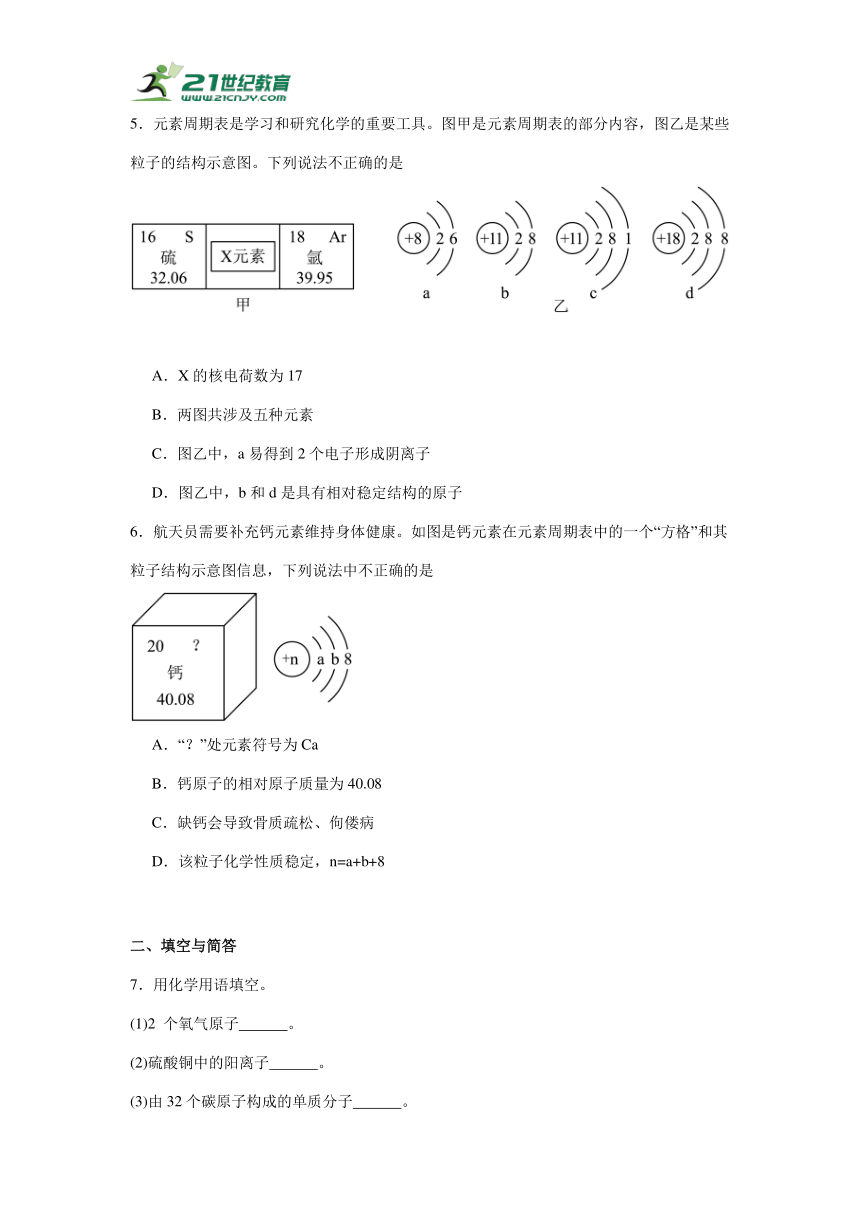
1.下列关于相应微粒的描述中,正确的是
A.化学性质稳定 B.易形成阳离子
C.带正电荷 D.易得电子
2.物质由微观粒子构成。下列都由离子构成的一组物质是
A.氯化钠、硫酸铜 B.水、干冰 C.金刚石、氧化汞 D.氦气、氨气
3.近日,我国科学家利用氢化镧成功研发出首个室温环境下超快氢负离子导体,这一成果将为未来新能源的发展带来革命性的突破。氢元素、镧元素的相关信息如图,下列有关说法正确的是
A.镧原子核内中子数为57 B.氢负离子比核外多2个电子
C.镧原子的质量为 D.表示两个氢原子
4.推理是化学学习的重要思维方法。下列推理正确的是
A.碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定显碱性
B.物质燃烧时发光放热,所以有发光放热现象的变化都是燃烧
C.酸和碱中都含氢元素,所以含氢元素的化合物一定是酸或碱
D.同种元素原子的质子数相同,所以质子数相同的粒子一定属于同种元素
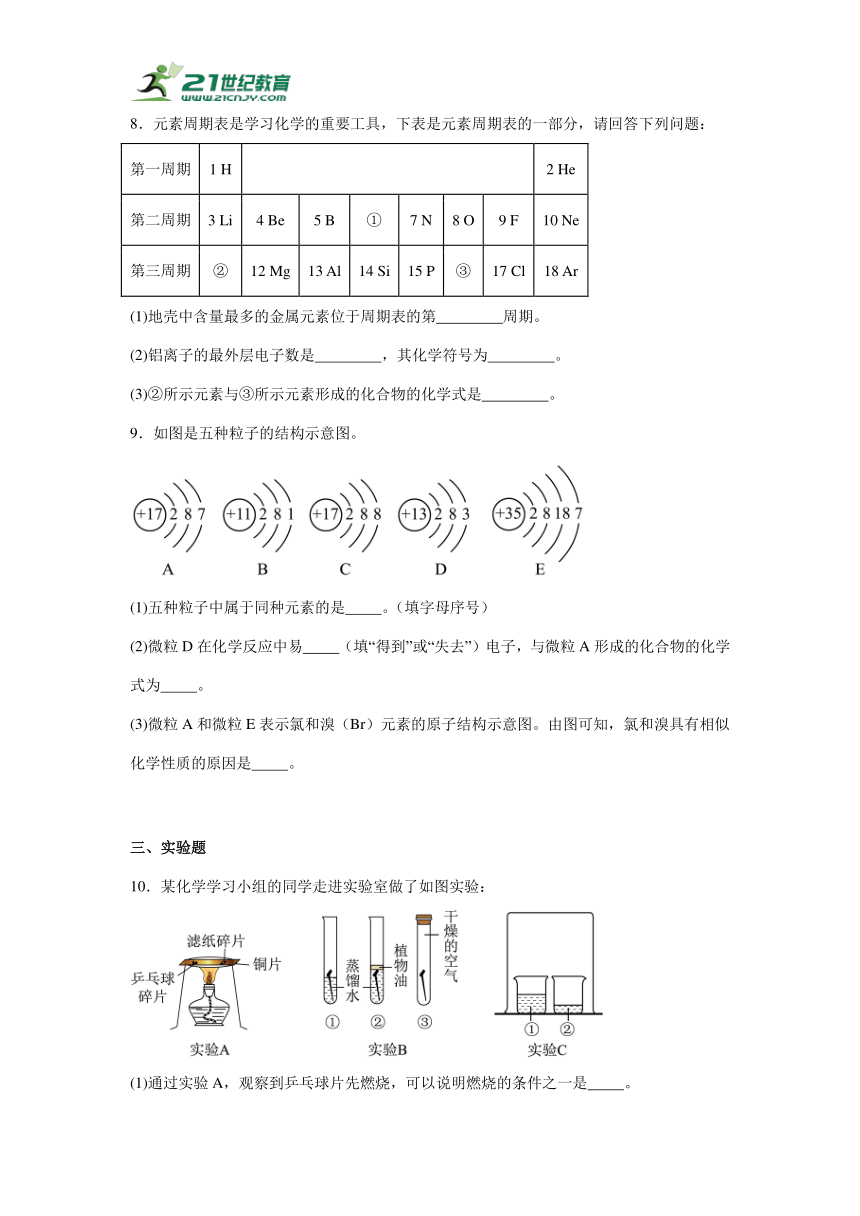
5.元素周期表是学习和研究化学的重要工具。图甲是元素周期表的部分内容,图乙是某些粒子的结构示意图。下列说法不正确的是
A.X的核电荷数为17
B.两图共涉及五种元素
C.图乙中,a易得到2个电子形成阴离子
D.图乙中,b和d是具有相对稳定结构的原子
6.航天员需要补充钙元素维持身体健康。如图是钙元素在元素周期表中的一个“方格”和其粒子结构示意图信息,下列说法中不正确的是
A.“?”处元素符号为Ca
B.钙原子的相对原子质量为40.08
C.缺钙会导致骨质疏松、佝偻病
D.该粒子化学性质稳定,n=a+b+8
二、填空与简答
7.用化学用语填空。
(1)2 个氧气原子 。
(2)硫酸铜中的阳离子 。
(3)由32个碳原子构成的单质分子 。
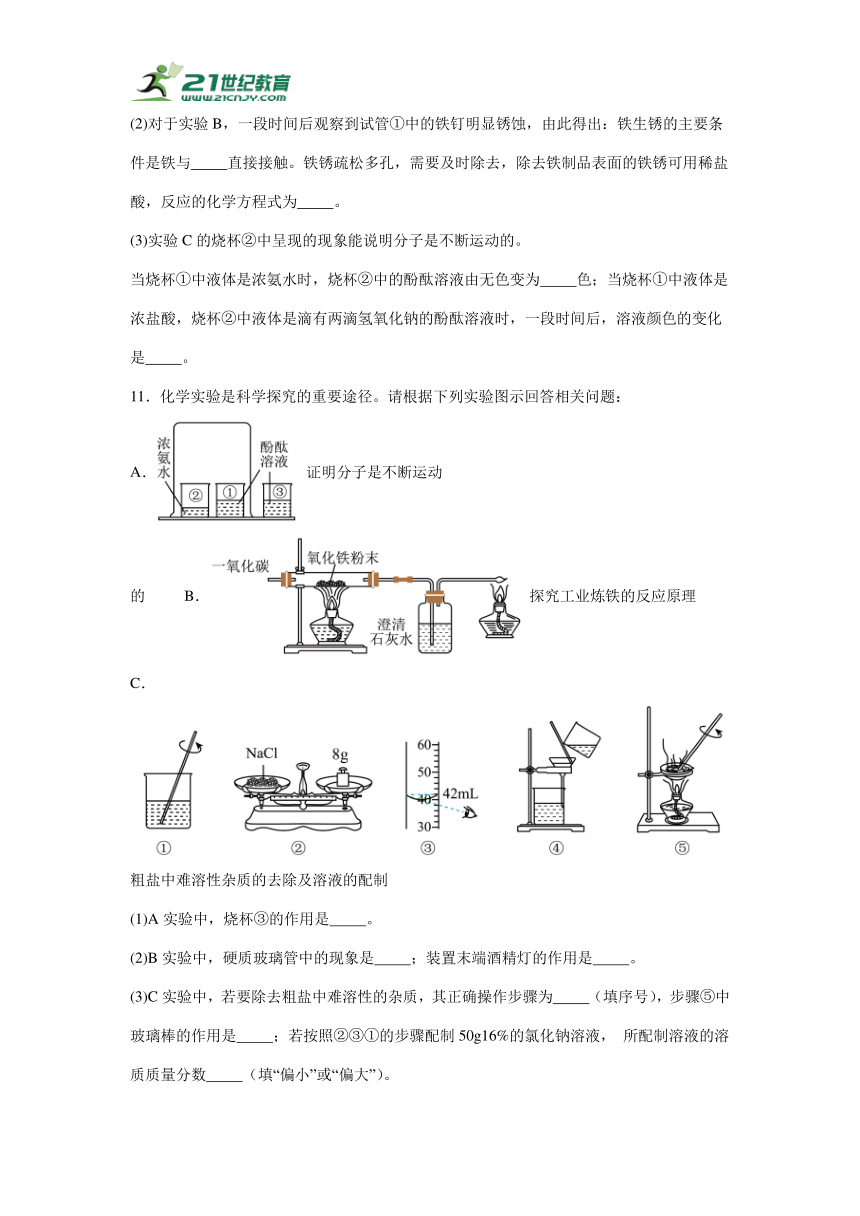
8.元素周期表是学习化学的重要工具,下表是元素周期表的一部分,请回答下列问题:
第一周期 1 H 2 He
第二周期 3 Li 4 Be 5 B ① 7 N 8 O 9 F 10 Ne
第三周期 ② 12 Mg 13 Al 14 Si 15 P ③ 17 Cl 18 Ar
(1)地壳中含量最多的金属元素位于周期表的第 周期。
(2)铝离子的最外层电子数是 ,其化学符号为 。
(3)②所示元素与③所示元素形成的化合物的化学式是 。
9.如图是五种粒子的结构示意图。
(1)五种粒子中属于同种元素的是 。(填字母序号)
(2)微粒D在化学反应中易 (填“得到”或“失去”)电子,与微粒A形成的化合物的化学式为 。
(3)微粒A和微粒E表示氯和溴(Br)元素的原子结构示意图。由图可知,氯和溴具有相似化学性质的原因是 。
三、实验题
10.某化学学习小组的同学走进实验室做了如图实验:
(1)通过实验A,观察到乒乓球片先燃烧,可以说明燃烧的条件之一是 。
(2)对于实验B,一段时间后观察到试管①中的铁钉明显锈蚀,由此得出:铁生锈的主要条件是铁与 直接接触。铁锈疏松多孔,需要及时除去,除去铁制品表面的铁锈可用稀盐酸,反应的化学方程式为 。
(3)实验C的烧杯②中呈现的现象能说明分子是不断运动的。
当烧杯①中液体是浓氨水时,烧杯②中的酚酞溶液由无色变为 色;当烧杯①中液体是浓盐酸,烧杯②中液体是滴有两滴氢氧化钠的酚酞溶液时,一段时间后,溶液颜色的变化是 。
11.化学实验是科学探究的重要途径。请根据下列实验图示回答相关问题:
A. 证明分子是不断运动的 B. 探究工业炼铁的反应原理
C.粗盐中难溶性杂质的去除及溶液的配制
(1)A实验中,烧杯③的作用是 。
(2)B实验中,硬质玻璃管中的现象是 ;装置末端酒精灯的作用是 。
(3)C实验中,若要除去粗盐中难溶性的杂质,其正确操作步骤为 (填序号),步骤⑤中玻璃棒的作用是 ;若按照②③①的步骤配制50g16%的氯化钠溶液, 所配制溶液的溶质质量分数 (填“偏小”或“偏大”)。
参考答案
题号 1 2 3 4 5 6
答案 A A B A D D
1.A
【详解】A、由微粒结构示意图可知,该图示为原子结构示意图,且最外层电子数为8,是稳定结构,在化学反应中既不得电子也不失电子,化学性质稳定,A项正确;
B、由微粒结构示意图可知,该图示为原子结构示意图,最外层电子数为6,在化学反应中容易得电子,即核外电子数大于核内质子数,为阴离子,B项不正确;
C、由微粒结构示意图可知,该图示为阴离子结构示意图,即核外电子数大于核内质子数,电子带负电,整个微粒结构带负电,C项不正确;
D、由微粒结构示意图可知,该图示为原子结构示意图,外层电子为1且小于4,在化学反应中容易失电子达到稳定结构,D项不正确;
故选A。
2.A
【详解】A、氯化钠由钠离子和氯离子构成,硫酸铜由铜离子和硫酸根离子构成,符合题意;
B、水由水分子构成,干冰是固体二氧化碳,由二氧化碳分子构成,不符合题意;
C、金刚石由碳原子构成,氧化汞由氧化汞分子构成,不符合题意;
D、氦气由氦原子构成,氨气由氨分子构成,不符合题意。
故选A。
3.B
【详解】A、相对原子质量=质子数+中子数,故镧原子的核内中子数是:139 57=82,故A错误;
B、氢负离子是氢原子得到了一个电子,H+是氢原子失去了一个电子,所以氢负离子比 H+ 核外多2个电子,故B正确;
C、元素周期表每一小格中,最下面的数字表示相对原子质量,不是实际质量,故C错误;
D、在元素符号前加数字表示几个原子,两个氢原子表示为2H;H2表示氢气这种物质,一个氢分子,故D错误。
故选B。
4.A
【详解】A、碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定显碱性,正确;
B、燃烧是一种发光、发热的剧烈化学反应,物质燃烧时发光发热,但有发光、放热的现象不一定是燃烧,例如灯泡发光放热,属于物理变化,不是燃烧,错误;
C、酸是指电离时产生的阳离子全部都是氢离子的化合物,碱是电离时产生的阴离子全部都是氢氧根离子的化合物,酸和碱中都含氢元素,但含氢元素的化合物不一定是酸和碱,例如水中含有氢元素,既不是酸也不是碱,错误;
D、质子数或核电荷数决定元素的种类,同种元素的质子数相同,但是质子数相同的粒子不一定属于同种元素,如水分子和氖原子,质子数都为10,但不属于同种元素,故选项说法错误。
故选:A。
5.D
【详解】A、根据元素周期表中,同一周期元素其原子序数依次增大,因此X的原子序数为17,在原子中,质子数=原子序数=核电荷数=核外电子数,故X的核电荷数为17,故A说法正确;
B、元素是质子数相同的一类原子的总称,质子数=原子序数,甲中为硫元素、氯元素和氩元素,乙图中a为氧元素、b和c为钠元素,d为氩元素,故两图共涉及硫、氯、氩、氧、钠五种元素,故B说法正确;
C、图乙中,a原子最外层电子数为6>4,在化学反应中易得到2个电子形成阴离子,故C说法正确;
D、图乙中,b粒子质子数为11,核外电子数为2+8=10,质子数>核外电子数,表示的是阳离子而不是原子,d粒子中质子数=核外电子数,表示的是原子,图乙中,b和d最外层电子数都是8,都是具有相对稳定结构的粒子,故D说法错误;
故选D。
6.D
【详解】A、由元素周期表可以获得的信息:字母表示该元素的元素符号,“?”处是钙元素的元素符号,“?”处元素符号为Ca,故选项A说法正确;
B、由元素周期表一格中的信息可知,钙原子的相对原子质量为40.089(最下方数字),故选项B说法正确;
C、钙是人体骨骼的主要组成元素,缺钙会导致骨质疏松、佝偻病,故选项C说法正确;
D、由元素周期表一格中的信息可知,质子数n=原子序数=17,该微粒结构示意图最外层电子数为8,则该微粒为Cl得到一个电子变成Cl-,其中a=2,b=8,则n=a+b+7,故选项D说法错误;
故选:D。
7.(1)2O
(2)Cu2+
(3)C32
【详解】(1)氧元素符号为O,故2个氧原子表示为2O;
(2)硫酸铜在溶液中电离产生Cu2+、,阳离子为Cu2+;
(3)32个碳原子构成的单质分子表示为C32。
8.(1)三
(2) 8 Al3+
(3)Na2S
【详解】(1)地壳中含量最多的金属元素是铝元素,符合为Al,位于第三周期。
(2)铝原子核外电子排布为2、8、3,最外层电子小于3,易失去最外层3个电子变成带3个单位正电荷的铝离子。所以铝离子的最外层电子数是8,符号是Al3+。
(3)②是11号元素钠元素,③是16号元素硫元素,形成的化合物是硫化钠。化合物中各元素化合价代数和为0,钠元素为+1,硫元素为-2,所以化学式为Na2S。
9.(1)AC
(2) 失去 AlCl3
(3)氯原子和溴原子的最外层电子数相同
【详解】(1)元素是质子数相同的一类原子的总称,A、C质子数相同,属于同种元素;
(2)D原子的最外层电子数为3,小于4,在化学反应中,容易失去电子,从而带上3个单位的正电荷;
质子数=原子序数,13号元素是铝元素,17号元素是氯元素,故微粒D与微粒A形成的化合物为氯化铝,氯化铝中铝元素显+3价,氯元素显-1价,化学式为:AlCl3;
(3)由图可知,氯原子和溴原子的最外层电子数相同,均是7,化学性质相似。
10.(1)温度需达到可燃物的着火点
(2) 氧气和水/空气和水 Fe2O3+6HCl=2FeCl3+3H2O
(3) 红 红色逐渐褪去变为无色
【详解】(1)燃烧的条件:物质具有可燃性、与氧气接触、温度达到可燃物的着火点,实验A中滤纸碎片和乒乓球碎片都与氧气接触,在加热过程中,利用铜片的导热性,在中间加热,能够提供均匀的热量,由于乒乓球碎片的着火点较低,首先燃烧起来,说明燃烧需要温度达到可燃物的着火点;
(2)对于实验B,一段时间观察试管①中的铁钉明显锈蚀,①试管中即提供了空气,也提供了水,由此得出:铁生锈的主要条件是铁与水和空气直接接触;氧化铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(3)当烧杯①中液体时浓氨水时,浓氨水具有挥发性,挥发出的氨气溶于水显碱性,所以烧杯②中的酚酞溶液由无色变为红色;当烧杯①中液体换成浓盐酸,浓盐酸具有挥发性,挥发出的氯化氢气体溶于水显酸性,烧杯②中液体换成滴有酚酞NaOH溶液时,一段时间后,溶液颜色的变化是红色逐渐褪去变为无色。
11.(1)对照(或对比)
(2) 红色粉末变为黑色 点燃尾气中剩余的CO,防止污染空气
(3) ①④⑤ 防止液体局部过热导致液滴飞溅 偏小
【详解】(1)③暴露在空气中,不和浓氨水挥发出的氨气接触,不会变红,则作用是对照。排除空气对酚酞溶液变色的影响。
(2)B中硬质玻璃管中发生的反应是氧化铁和一氧化碳高温反应生成铁和二氧化碳,则现象是红色粉末变为黑色。一氧化碳有毒、污染空气,在玻璃管中无法被完全消化,直接排放会污染空气。一氧化碳具有可燃性,一氧化碳与氧气点燃生成二氧化碳,所以装置末端酒精灯的作用是点燃尾气中剩余的CO,防止污染空气。
(3)除去粗盐中难溶性的杂质,操作步骤溶解、过滤、蒸发,则正确操作步骤为①④⑤。
蒸发过程中,玻璃棒的作用是搅拌,防止液体局部过热导致液滴飞溅。
配制50g 16%的氯化钠溶液,需要氯化钠的质量为50g×16%=8g,需要水50g-8g=42g,即42mL。③量取水时仰视度数,读数偏小,实际量取液体体积偏大,溶剂偏多,则溶质质量分数偏小。
一、选择题
1.下列关于相应微粒的描述中,正确的是
A.化学性质稳定 B.易形成阳离子
C.带正电荷 D.易得电子
2.物质由微观粒子构成。下列都由离子构成的一组物质是
A.氯化钠、硫酸铜 B.水、干冰 C.金刚石、氧化汞 D.氦气、氨气
3.近日,我国科学家利用氢化镧成功研发出首个室温环境下超快氢负离子导体,这一成果将为未来新能源的发展带来革命性的突破。氢元素、镧元素的相关信息如图,下列有关说法正确的是
A.镧原子核内中子数为57 B.氢负离子比核外多2个电子
C.镧原子的质量为 D.表示两个氢原子
4.推理是化学学习的重要思维方法。下列推理正确的是
A.碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定显碱性
B.物质燃烧时发光放热,所以有发光放热现象的变化都是燃烧
C.酸和碱中都含氢元素,所以含氢元素的化合物一定是酸或碱
D.同种元素原子的质子数相同,所以质子数相同的粒子一定属于同种元素
5.元素周期表是学习和研究化学的重要工具。图甲是元素周期表的部分内容,图乙是某些粒子的结构示意图。下列说法不正确的是
A.X的核电荷数为17
B.两图共涉及五种元素
C.图乙中,a易得到2个电子形成阴离子
D.图乙中,b和d是具有相对稳定结构的原子
6.航天员需要补充钙元素维持身体健康。如图是钙元素在元素周期表中的一个“方格”和其粒子结构示意图信息,下列说法中不正确的是
A.“?”处元素符号为Ca
B.钙原子的相对原子质量为40.08
C.缺钙会导致骨质疏松、佝偻病
D.该粒子化学性质稳定,n=a+b+8
二、填空与简答
7.用化学用语填空。
(1)2 个氧气原子 。
(2)硫酸铜中的阳离子 。
(3)由32个碳原子构成的单质分子 。
8.元素周期表是学习化学的重要工具,下表是元素周期表的一部分,请回答下列问题:
第一周期 1 H 2 He
第二周期 3 Li 4 Be 5 B ① 7 N 8 O 9 F 10 Ne
第三周期 ② 12 Mg 13 Al 14 Si 15 P ③ 17 Cl 18 Ar
(1)地壳中含量最多的金属元素位于周期表的第 周期。
(2)铝离子的最外层电子数是 ,其化学符号为 。
(3)②所示元素与③所示元素形成的化合物的化学式是 。
9.如图是五种粒子的结构示意图。
(1)五种粒子中属于同种元素的是 。(填字母序号)
(2)微粒D在化学反应中易 (填“得到”或“失去”)电子,与微粒A形成的化合物的化学式为 。
(3)微粒A和微粒E表示氯和溴(Br)元素的原子结构示意图。由图可知,氯和溴具有相似化学性质的原因是 。
三、实验题
10.某化学学习小组的同学走进实验室做了如图实验:
(1)通过实验A,观察到乒乓球片先燃烧,可以说明燃烧的条件之一是 。
(2)对于实验B,一段时间后观察到试管①中的铁钉明显锈蚀,由此得出:铁生锈的主要条件是铁与 直接接触。铁锈疏松多孔,需要及时除去,除去铁制品表面的铁锈可用稀盐酸,反应的化学方程式为 。
(3)实验C的烧杯②中呈现的现象能说明分子是不断运动的。
当烧杯①中液体是浓氨水时,烧杯②中的酚酞溶液由无色变为 色;当烧杯①中液体是浓盐酸,烧杯②中液体是滴有两滴氢氧化钠的酚酞溶液时,一段时间后,溶液颜色的变化是 。
11.化学实验是科学探究的重要途径。请根据下列实验图示回答相关问题:
A. 证明分子是不断运动的 B. 探究工业炼铁的反应原理
C.粗盐中难溶性杂质的去除及溶液的配制
(1)A实验中,烧杯③的作用是 。
(2)B实验中,硬质玻璃管中的现象是 ;装置末端酒精灯的作用是 。
(3)C实验中,若要除去粗盐中难溶性的杂质,其正确操作步骤为 (填序号),步骤⑤中玻璃棒的作用是 ;若按照②③①的步骤配制50g16%的氯化钠溶液, 所配制溶液的溶质质量分数 (填“偏小”或“偏大”)。
参考答案
题号 1 2 3 4 5 6
答案 A A B A D D
1.A
【详解】A、由微粒结构示意图可知,该图示为原子结构示意图,且最外层电子数为8,是稳定结构,在化学反应中既不得电子也不失电子,化学性质稳定,A项正确;
B、由微粒结构示意图可知,该图示为原子结构示意图,最外层电子数为6,在化学反应中容易得电子,即核外电子数大于核内质子数,为阴离子,B项不正确;
C、由微粒结构示意图可知,该图示为阴离子结构示意图,即核外电子数大于核内质子数,电子带负电,整个微粒结构带负电,C项不正确;
D、由微粒结构示意图可知,该图示为原子结构示意图,外层电子为1且小于4,在化学反应中容易失电子达到稳定结构,D项不正确;
故选A。
2.A
【详解】A、氯化钠由钠离子和氯离子构成,硫酸铜由铜离子和硫酸根离子构成,符合题意;
B、水由水分子构成,干冰是固体二氧化碳,由二氧化碳分子构成,不符合题意;
C、金刚石由碳原子构成,氧化汞由氧化汞分子构成,不符合题意;
D、氦气由氦原子构成,氨气由氨分子构成,不符合题意。
故选A。
3.B
【详解】A、相对原子质量=质子数+中子数,故镧原子的核内中子数是:139 57=82,故A错误;
B、氢负离子是氢原子得到了一个电子,H+是氢原子失去了一个电子,所以氢负离子比 H+ 核外多2个电子,故B正确;
C、元素周期表每一小格中,最下面的数字表示相对原子质量,不是实际质量,故C错误;
D、在元素符号前加数字表示几个原子,两个氢原子表示为2H;H2表示氢气这种物质,一个氢分子,故D错误。
故选B。
4.A
【详解】A、碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定显碱性,正确;
B、燃烧是一种发光、发热的剧烈化学反应,物质燃烧时发光发热,但有发光、放热的现象不一定是燃烧,例如灯泡发光放热,属于物理变化,不是燃烧,错误;
C、酸是指电离时产生的阳离子全部都是氢离子的化合物,碱是电离时产生的阴离子全部都是氢氧根离子的化合物,酸和碱中都含氢元素,但含氢元素的化合物不一定是酸和碱,例如水中含有氢元素,既不是酸也不是碱,错误;
D、质子数或核电荷数决定元素的种类,同种元素的质子数相同,但是质子数相同的粒子不一定属于同种元素,如水分子和氖原子,质子数都为10,但不属于同种元素,故选项说法错误。
故选:A。
5.D
【详解】A、根据元素周期表中,同一周期元素其原子序数依次增大,因此X的原子序数为17,在原子中,质子数=原子序数=核电荷数=核外电子数,故X的核电荷数为17,故A说法正确;
B、元素是质子数相同的一类原子的总称,质子数=原子序数,甲中为硫元素、氯元素和氩元素,乙图中a为氧元素、b和c为钠元素,d为氩元素,故两图共涉及硫、氯、氩、氧、钠五种元素,故B说法正确;
C、图乙中,a原子最外层电子数为6>4,在化学反应中易得到2个电子形成阴离子,故C说法正确;
D、图乙中,b粒子质子数为11,核外电子数为2+8=10,质子数>核外电子数,表示的是阳离子而不是原子,d粒子中质子数=核外电子数,表示的是原子,图乙中,b和d最外层电子数都是8,都是具有相对稳定结构的粒子,故D说法错误;
故选D。
6.D
【详解】A、由元素周期表可以获得的信息:字母表示该元素的元素符号,“?”处是钙元素的元素符号,“?”处元素符号为Ca,故选项A说法正确;
B、由元素周期表一格中的信息可知,钙原子的相对原子质量为40.089(最下方数字),故选项B说法正确;
C、钙是人体骨骼的主要组成元素,缺钙会导致骨质疏松、佝偻病,故选项C说法正确;
D、由元素周期表一格中的信息可知,质子数n=原子序数=17,该微粒结构示意图最外层电子数为8,则该微粒为Cl得到一个电子变成Cl-,其中a=2,b=8,则n=a+b+7,故选项D说法错误;
故选:D。
7.(1)2O
(2)Cu2+
(3)C32
【详解】(1)氧元素符号为O,故2个氧原子表示为2O;
(2)硫酸铜在溶液中电离产生Cu2+、,阳离子为Cu2+;
(3)32个碳原子构成的单质分子表示为C32。
8.(1)三
(2) 8 Al3+
(3)Na2S
【详解】(1)地壳中含量最多的金属元素是铝元素,符合为Al,位于第三周期。
(2)铝原子核外电子排布为2、8、3,最外层电子小于3,易失去最外层3个电子变成带3个单位正电荷的铝离子。所以铝离子的最外层电子数是8,符号是Al3+。
(3)②是11号元素钠元素,③是16号元素硫元素,形成的化合物是硫化钠。化合物中各元素化合价代数和为0,钠元素为+1,硫元素为-2,所以化学式为Na2S。
9.(1)AC
(2) 失去 AlCl3
(3)氯原子和溴原子的最外层电子数相同
【详解】(1)元素是质子数相同的一类原子的总称,A、C质子数相同,属于同种元素;
(2)D原子的最外层电子数为3,小于4,在化学反应中,容易失去电子,从而带上3个单位的正电荷;
质子数=原子序数,13号元素是铝元素,17号元素是氯元素,故微粒D与微粒A形成的化合物为氯化铝,氯化铝中铝元素显+3价,氯元素显-1价,化学式为:AlCl3;
(3)由图可知,氯原子和溴原子的最外层电子数相同,均是7,化学性质相似。
10.(1)温度需达到可燃物的着火点
(2) 氧气和水/空气和水 Fe2O3+6HCl=2FeCl3+3H2O
(3) 红 红色逐渐褪去变为无色
【详解】(1)燃烧的条件:物质具有可燃性、与氧气接触、温度达到可燃物的着火点,实验A中滤纸碎片和乒乓球碎片都与氧气接触,在加热过程中,利用铜片的导热性,在中间加热,能够提供均匀的热量,由于乒乓球碎片的着火点较低,首先燃烧起来,说明燃烧需要温度达到可燃物的着火点;
(2)对于实验B,一段时间观察试管①中的铁钉明显锈蚀,①试管中即提供了空气,也提供了水,由此得出:铁生锈的主要条件是铁与水和空气直接接触;氧化铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(3)当烧杯①中液体时浓氨水时,浓氨水具有挥发性,挥发出的氨气溶于水显碱性,所以烧杯②中的酚酞溶液由无色变为红色;当烧杯①中液体换成浓盐酸,浓盐酸具有挥发性,挥发出的氯化氢气体溶于水显酸性,烧杯②中液体换成滴有酚酞NaOH溶液时,一段时间后,溶液颜色的变化是红色逐渐褪去变为无色。
11.(1)对照(或对比)
(2) 红色粉末变为黑色 点燃尾气中剩余的CO,防止污染空气
(3) ①④⑤ 防止液体局部过热导致液滴飞溅 偏小
【详解】(1)③暴露在空气中,不和浓氨水挥发出的氨气接触,不会变红,则作用是对照。排除空气对酚酞溶液变色的影响。
(2)B中硬质玻璃管中发生的反应是氧化铁和一氧化碳高温反应生成铁和二氧化碳,则现象是红色粉末变为黑色。一氧化碳有毒、污染空气,在玻璃管中无法被完全消化,直接排放会污染空气。一氧化碳具有可燃性,一氧化碳与氧气点燃生成二氧化碳,所以装置末端酒精灯的作用是点燃尾气中剩余的CO,防止污染空气。
(3)除去粗盐中难溶性的杂质,操作步骤溶解、过滤、蒸发,则正确操作步骤为①④⑤。
蒸发过程中,玻璃棒的作用是搅拌,防止液体局部过热导致液滴飞溅。
配制50g 16%的氯化钠溶液,需要氯化钠的质量为50g×16%=8g,需要水50g-8g=42g,即42mL。③量取水时仰视度数,读数偏小,实际量取液体体积偏大,溶剂偏多,则溶质质量分数偏小。
同课章节目录
