3.3.1饮食中的有机化合物(教学课件)(共26张PPT)_高中化学鲁科版必修二(2019)
文档属性
| 名称 | 3.3.1饮食中的有机化合物(教学课件)(共26张PPT)_高中化学鲁科版必修二(2019) |  | |
| 格式 | pptx | ||
| 文件大小 | 27.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-06 22:23:35 | ||
图片预览






文档简介
(共26张PPT)
第三章 简单的有机化合物
第三节 饮食中的有机化合物
3.3.1 乙醇
核心素养目标
宏观辨识与微观探析:
能从宏观上描述乙醇的物理性质(如颜色、状态、气味、溶解性等),并通过乙醇的结构(分子式、结构式、结构简式、官能团)从微观层面理解其化学性质。
证据推理与模型认知:
通过对乙醇化学性质实验现象的观察和分析,推理出乙醇的反应原理,构建乙醇反应的化学模型,如乙醇催化氧化的反应过程模型。
科学探究与创新意识:
设计实验探究乙醇的性质,如探究乙醇中羟基氢的活泼性、探究乙醇催化氧化的条件等,在实验探究过程中培养创新思维和实践能力
重点
乙醇的结构(尤其是官能团羟基)、物理性质和化学性质(与钠反应、氧化反应,特别是催化氧化);
乙醇在生产、生活中的重要应用。
难点
乙醇发生化学反应时化学键的断裂与形成,理解乙醇催化氧化的反应机理;
从结构角度解释乙醇与钠反应、催化氧化等反应的本质原因 。
课前导入
课前导入
有这样一种神奇的液体,它伴随着古代人的悲欢离合。欢时,李白说,人生得意须尽欢,莫使金樽空对月。愁时,李白说,抽刀断水水更流,举杯消愁愁更愁。离时,王维说,劝君更尽一杯酒,西出阳关无故人同样,也伴随着现代人的喜怒哀乐,也是表演杂技时的道具。到了现代,它又成了人们居家旅行必备的消毒用品。我们今天学习这种神奇的液体,乙醇。
酒的简史
01
乙醇的物理性质及结构
乙醇的物理性质
颜色 状态 气味 水溶性 密度 挥发性
无色 液体 特殊 香味 任意比例互溶,能溶解多种无机物和有机化合物是优良的有机溶剂 比水轻,20 ℃时的密度为 0.789 g·cm-3 熔点为 -117.3 ℃,沸点为 78.5 ℃,易挥发;
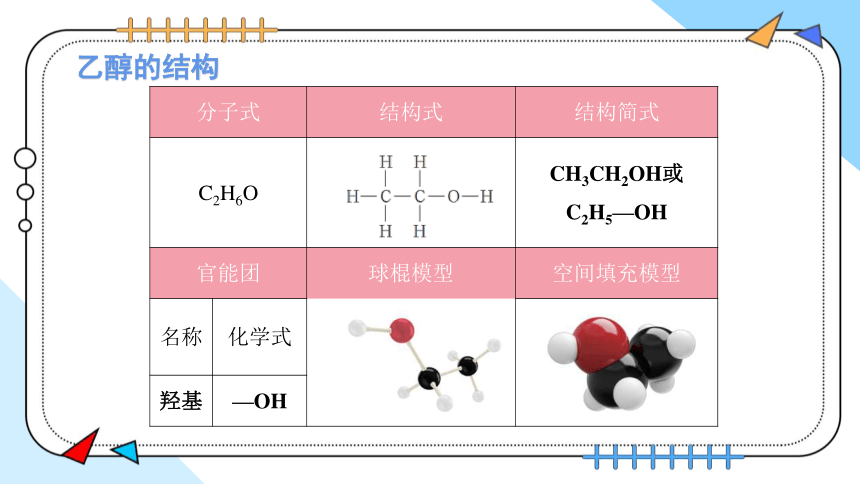
乙醇的结构
分子式 结构式 结构简式
C2H6O CH3CH2OH或
C2H5—OH
官能团 球棍模型 空间填充模型
名称 化学式
羟基 —OH
02
乙醇的化学性质
乙醇的催化氧化
实验操作
实验现象 在空气中灼烧过的铜丝表面由黑变红,试管中的液体有刺激性气味
化学方程式
乙醇的催化氧化
乙醇的催化氧化反应历程
将绕成螺旋状的铜丝在酒精灯外焰上 加热
趁热将灼烧后的铜丝插入无水乙醇中
原理
现象
2Cu+O22CuO
铜丝表面由红变黑
原理
现象
铜丝表面由黑变红
乙醇的与高锰酸钾的反应
乙醇能使酸性 KMnO4 溶液褪色,反应的实质是乙醇被高锰酸钾氧化。
CH3CH2OH
CH3COOH
酒驾的检验原理
交警检验机动车驾驶员是否“酒驾”时,通常使用酒精检测仪。
一种传统的酒精检测仪原理如下:人体呼出的气体与检测仪内的重铬酸钾(K2Cr2O7)接触,如果呼出气体中有乙醇蒸气,乙醇会被重铬酸钾氧化成乙醛,同时橙红色的重铬酸钾被还原成绿色的硫酸铬[Cr2(SO4)3]。根据是否变色及颜色的变化程度,可测出呼出气体中是否有乙醇及乙醇含量的高低。
目前常用的是燃料电池型呼气酒精检测仪。它的原理为:呼出气体中若有乙醇蒸气,则在乙醇被催化氧化成二氧化碳(或乙醛)和水的过程中会释放出化学能,化学能经电化学装置转化为电能,用电压表测量其电压,示数越高,则乙醇浓度越高。
一种酒精检测仪
实验 操作
实验 现象 ①钠开始沉于试管底部,最终慢慢消失,产生无色可燃性气体;
②烧杯内壁有水珠产生;
③向烧杯中加入澄清石灰水,石灰水不变浑浊
实验 结论 乙醇与钠反应生成H2,化学方程式为
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
乙醇的用途
(1)用作有机溶剂:
乙醇能溶解多种无机化合物和有机化合物,是优良的有机溶剂。
(2)用作燃料和化工原料:
乙醇燃烧能产生大量的热,是一种优良的燃料。乙醇可用作造酒原料和化工原理。
(3)用作杀菌、消毒剂:
医疗上常用体积分数为75%的乙醇溶液作消毒剂。
饮酒的利弊
酒中含有一定量的乙醇,乙醇的体积分数称为酒的度数。例如,1% vol 表示 100 mL 酒中含有 1 mL 乙醇。
乙醇进入人体后,一部分被小肠吸收,通过血液循环进入肝脏,在肝脏中被氧化成乙醛、乙酸,最终被氧化成二氧化碳和水,释放出能量。少量饮酒,能增加唾液和胃液的分泌,帮助消化;能扩张血管、消除疲劳。过量饮酒,肝脏一时无法将乙醇、乙醛和乙酸等全部转化,血液中高浓度的乙醇会减缓大脑中信使分子的有效传递,影响判断力。长期过量饮酒,会损伤肝脏;血液中高浓度的乙醛还能致癌,并容易导致心血管疾病急性发作。未成年人不应饮酒,机动车驾驶员严禁酒后驾车。
乙醇在人体内的代谢过程
乙醇反应中键的断裂情况
乙醇的性质 键的断裂
与钠反应 断①键
燃烧 断①②③④⑤键
催化氧化 断①③键
03
课堂小结
04
课堂练习
D
C
C
B
4.饱和一元醇的通式为CnH2n+1OH,4.6 g某饱和一元醇与足量金属钠反应,得到1.12 L(标准状况)的氢气。则该饱和一元醇的分子式为( )。
A.CH3OH B.C2H5OH C.C3H7OH D.C4H9OH
Thanks
好好学习天天向上
第三章 简单的有机化合物
第三节 饮食中的有机化合物
3.3.1 乙醇
核心素养目标
宏观辨识与微观探析:
能从宏观上描述乙醇的物理性质(如颜色、状态、气味、溶解性等),并通过乙醇的结构(分子式、结构式、结构简式、官能团)从微观层面理解其化学性质。
证据推理与模型认知:
通过对乙醇化学性质实验现象的观察和分析,推理出乙醇的反应原理,构建乙醇反应的化学模型,如乙醇催化氧化的反应过程模型。
科学探究与创新意识:
设计实验探究乙醇的性质,如探究乙醇中羟基氢的活泼性、探究乙醇催化氧化的条件等,在实验探究过程中培养创新思维和实践能力
重点
乙醇的结构(尤其是官能团羟基)、物理性质和化学性质(与钠反应、氧化反应,特别是催化氧化);
乙醇在生产、生活中的重要应用。
难点
乙醇发生化学反应时化学键的断裂与形成,理解乙醇催化氧化的反应机理;
从结构角度解释乙醇与钠反应、催化氧化等反应的本质原因 。
课前导入
课前导入
有这样一种神奇的液体,它伴随着古代人的悲欢离合。欢时,李白说,人生得意须尽欢,莫使金樽空对月。愁时,李白说,抽刀断水水更流,举杯消愁愁更愁。离时,王维说,劝君更尽一杯酒,西出阳关无故人同样,也伴随着现代人的喜怒哀乐,也是表演杂技时的道具。到了现代,它又成了人们居家旅行必备的消毒用品。我们今天学习这种神奇的液体,乙醇。
酒的简史
01
乙醇的物理性质及结构
乙醇的物理性质
颜色 状态 气味 水溶性 密度 挥发性
无色 液体 特殊 香味 任意比例互溶,能溶解多种无机物和有机化合物是优良的有机溶剂 比水轻,20 ℃时的密度为 0.789 g·cm-3 熔点为 -117.3 ℃,沸点为 78.5 ℃,易挥发;
乙醇的结构
分子式 结构式 结构简式
C2H6O CH3CH2OH或
C2H5—OH
官能团 球棍模型 空间填充模型
名称 化学式
羟基 —OH
02
乙醇的化学性质
乙醇的催化氧化
实验操作
实验现象 在空气中灼烧过的铜丝表面由黑变红,试管中的液体有刺激性气味
化学方程式
乙醇的催化氧化
乙醇的催化氧化反应历程
将绕成螺旋状的铜丝在酒精灯外焰上 加热
趁热将灼烧后的铜丝插入无水乙醇中
原理
现象
2Cu+O22CuO
铜丝表面由红变黑
原理
现象
铜丝表面由黑变红
乙醇的与高锰酸钾的反应
乙醇能使酸性 KMnO4 溶液褪色,反应的实质是乙醇被高锰酸钾氧化。
CH3CH2OH
CH3COOH
酒驾的检验原理
交警检验机动车驾驶员是否“酒驾”时,通常使用酒精检测仪。
一种传统的酒精检测仪原理如下:人体呼出的气体与检测仪内的重铬酸钾(K2Cr2O7)接触,如果呼出气体中有乙醇蒸气,乙醇会被重铬酸钾氧化成乙醛,同时橙红色的重铬酸钾被还原成绿色的硫酸铬[Cr2(SO4)3]。根据是否变色及颜色的变化程度,可测出呼出气体中是否有乙醇及乙醇含量的高低。
目前常用的是燃料电池型呼气酒精检测仪。它的原理为:呼出气体中若有乙醇蒸气,则在乙醇被催化氧化成二氧化碳(或乙醛)和水的过程中会释放出化学能,化学能经电化学装置转化为电能,用电压表测量其电压,示数越高,则乙醇浓度越高。
一种酒精检测仪
实验 操作
实验 现象 ①钠开始沉于试管底部,最终慢慢消失,产生无色可燃性气体;
②烧杯内壁有水珠产生;
③向烧杯中加入澄清石灰水,石灰水不变浑浊
实验 结论 乙醇与钠反应生成H2,化学方程式为
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
乙醇的用途
(1)用作有机溶剂:
乙醇能溶解多种无机化合物和有机化合物,是优良的有机溶剂。
(2)用作燃料和化工原料:
乙醇燃烧能产生大量的热,是一种优良的燃料。乙醇可用作造酒原料和化工原理。
(3)用作杀菌、消毒剂:
医疗上常用体积分数为75%的乙醇溶液作消毒剂。
饮酒的利弊
酒中含有一定量的乙醇,乙醇的体积分数称为酒的度数。例如,1% vol 表示 100 mL 酒中含有 1 mL 乙醇。
乙醇进入人体后,一部分被小肠吸收,通过血液循环进入肝脏,在肝脏中被氧化成乙醛、乙酸,最终被氧化成二氧化碳和水,释放出能量。少量饮酒,能增加唾液和胃液的分泌,帮助消化;能扩张血管、消除疲劳。过量饮酒,肝脏一时无法将乙醇、乙醛和乙酸等全部转化,血液中高浓度的乙醇会减缓大脑中信使分子的有效传递,影响判断力。长期过量饮酒,会损伤肝脏;血液中高浓度的乙醛还能致癌,并容易导致心血管疾病急性发作。未成年人不应饮酒,机动车驾驶员严禁酒后驾车。
乙醇在人体内的代谢过程
乙醇反应中键的断裂情况
乙醇的性质 键的断裂
与钠反应 断①键
燃烧 断①②③④⑤键
催化氧化 断①③键
03
课堂小结
04
课堂练习
D
C
C
B
4.饱和一元醇的通式为CnH2n+1OH,4.6 g某饱和一元醇与足量金属钠反应,得到1.12 L(标准状况)的氢气。则该饱和一元醇的分子式为( )。
A.CH3OH B.C2H5OH C.C3H7OH D.C4H9OH
Thanks
好好学习天天向上
