3.2.1 醇(教学课件)(共31张PPT)_高中化学人教版(2019)人教版选择性必修三教学课件
文档属性
| 名称 | 3.2.1 醇(教学课件)(共31张PPT)_高中化学人教版(2019)人教版选择性必修三教学课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 39.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-06 22:35:52 | ||
图片预览











文档简介
(共31张PPT)
3.2.1 醇
核心素养目标
宏观辨识与微观探析
能从宏观上认识醇的典型物理性质和化学性质,如乙醇的溶解性、可燃性等;从微观角度理解醇的结构(包括官能团羟基的结构特点)对其性质的影响,能分析醇发生化学反应时的断键位置和方式。
证据推理与模型认知
通过对醇的实验现象、数据等证据的分析,推理得出醇的性质和反应规律;构建醇的结构 - 性质 - 用途的认知模型,能运用该模型解释和预测醇的相关性质和反应。
科学探究与创新意识
了解醇在日常生活、工业生产等方面的应用,认识化学对社会发展的重要贡献;培养严谨、认真的科学态度,以及合理使用化学物质、保护环境的社会责任意识。
学习重难点
重点
醇的结构特点,特别是官能团羟基的结构以及与烃基的相互影响。
醇的化学性质,如与金属钠的反应、消去反应、催化氧化反应、取代反应等,理解反应的原理和断键方式。
乙醇的分子结构和化学性质,以乙醇为典型代表物,深入理解醇类物质的通性。
难点
醇发生消去反应和催化氧化反应的反应机理和反应条件,能够准确判断反应的产物和反应类型。
理解醇的结构与性质之间的内在联系,从微观角度解释醇的各种化学性质,如为什么醇能发生某些反应而烷烃不能。
课前导入
我们都知道,酒中含有大量的酒精,酒精就是乙醇,那么,喝完酒后,乙醇会在我们身体里发生什么样的变化呢?
温馨提示:
未成年不允许饮酒!
醇的定义及分类
PART 01
1.醇的定义
定义 烃分子中的氢原子被羟基取代可衍生出含羟基的化合物,其中羟基与饱和碳原子相连的化合物称为醇。
饱和一元醇及其通式 由链状烷烃衍生的一元醇,叫做饱和一元醇,其通式为CnH2n+1OH(n≥1),可简写为R—OH。
(1)饱和碳原子采取sp3杂化,只与其他原子形成单键,如烷烃中的碳原子都是饱和碳原子。
(2)当羟基与不饱和碳原子相连时,不稳定(共轭体系除外),能发生分子内原子的重新组合,如CH2=CH—OH→CH3CHO。
2.醇的分类
醇
按分子中羟基的数目
按烃基类型
按烃基是否饱和
一元醇:分子中只含有一个羟基的醇,如CH3OH
二元醇:分子中含有两个羟基的醇,如CH2—OH
丨
CH2—OH
多元醇:分子中含有两个羟基的醇,如CH2—OH
丨
CH—OH
丨
CH2—OH
脂肪醇:如CH3CH2OH
脂环醇:如
芳香醇:如
—CH2OH
饱和醇:如CH3CH2OH、
不饱和醇:如CH2=CH—CH2OH、
—CH2OH
不包括同一个碳原子上连有2个或多个羟基的醇,这样的醇不稳定。
醇分子中的烃基是烷基。
3.醇的命名
(1)习惯命名法:
用于结构简单的一元醇的命名。方法是在“醇”字前加上用习惯命名法命名的烃基名称,通常“基”字可省略。如:
CH3OH
(CH3)2CHCH2OH
CH3CH2CH2OH
—CH2OH
甲醇
异丁醇
正丁醇
苯甲醇
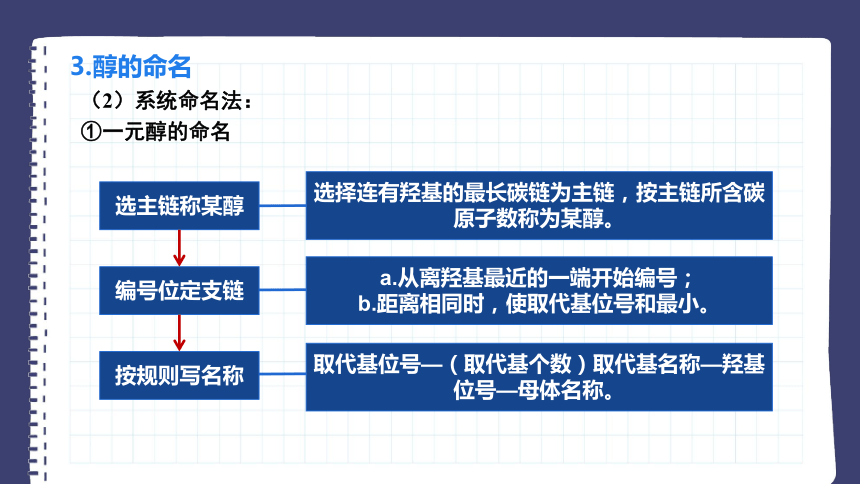
3.醇的命名
(2)系统命名法:
①一元醇的命名
选主链称某醇
选择连有羟基的最长碳链为主链,按主链所含碳原子数称为某醇。
编号位定支链
a.从离羟基最近的一端开始编号;
b.距离相同时,使取代基位号和最小。
按规则写名称
取代基位号—(取代基个数)取代基名称—羟基位号—母体名称。
3.醇的命名
(2)系统命名法:
②多元醇的命名
当醇分子中含多个羟基时,应选择含羟基最多的最长碳链为主链,并从靠近羟基的一端开始编号。羟基的个数用“二”“三”等表示。
如:
如: OH
丨
CH—CH3
丨
CH3—CH2—CH—CH2—CH—CH3
丨
CH3
1
2
3
4
5
6
5—甲基—3—乙基—2—己醇
CH2CH2CHCH3
丨
丨
OH
OH
1,3—丁二醇
4.常见的醇
甲醇
基本有机原料之一。主要用于制造甲醛、乙酸、氯甲烷、甲胺和硫酸二甲酯等多种有机产品。
用于制造醋酸、饮料、香精、染料、燃料等、消毒剂等,在国防工业、医疗卫生、有机合成、食品工业、工农业生产中都有广泛的用途。
乙二醇
醇的性质
PART 02
1.醇的物理性质及其变化规律
醇在水中的溶解度一般随分子中碳原子数的增加而降低,沸点随碳原子数的增加而升高。
几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃ 状态 水中溶解度
甲醇 CH3OH -97 65 液体 能与水以任意比例互溶
乙醇 CH3CH2OH -117 79 正丙醇 CH3CH2CH2OH -126 97 正丁醇 CH3CH2CH2CH2OH -90 118 油状液体 可部分溶于水
正戊醇 CH3CH2CH2CH2CH2OH -79 138 十八醇 CH3(CH2)17OH 59 211 蜡状固体 难溶于水
结论:
2、在水中的溶解度随碳原子数的增加而降低。
1、饱和一元醇的熔、沸点随碳原子数的增加而升高。
1.醇的物理性质及其变化规律
相对分子质量相近的醇与烷烃的沸点比较
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。
1.醇的物理性质及其变化规律
多元醇的沸点、水溶性与氢键的关系:多元醇分子中的羟基较多,一方面增大了醇分子间形成氢键的概率,使多元醇的沸点较高;另一方面增大了醇分子与水分子之间形成氢键的概率,使多元醇易溶于水。
羟基的存在使醇分子间也容易形成氢键,增强了醇分子间的作用力。所以与相对分子质量相近的烷经相比,醇具有较高的沸点。醇溶于水时与水也容易形成氢键,因此低级醇具有良好的水溶性。
R
R
O
O
H
H
R
R
O
O
H
H
R
R
O
O
H
H
氢键
2.醇的化学性质
H H
| |
H—C—C—O—H
| |
H H
电负性大,吸引电子的能力强
极性强,易断裂,发生取代反应或消去反应
极性强,易断裂,发生取代反应
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
(1)与活泼金属反应
2.醇的化学性质
(2)取代反应
①与氢卤酸反应:乙醇与浓氢溴酸混合加热后发生取代反应,生成溴乙烷。
醇与氢卤酸混合加热后发生取代反应,生成卤代烃和水。这是制备卤代烃的方法之一。
C2H5-OH + H-Br C2H5Br+ H2O
△
溴乙烷 乙醇:
对比:
CH3CH2-Br + H-OH
CH3CH2-OH + H-Br
NaOH
△
说明:反应条件不同,反应方向不同。但上述反应不是可逆反应!
(碱性条件)
2.醇的化学性质
(2)取代反应
②醇与含氧酸发生酯化反应:
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
③醇分子间脱水成醚:
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
乙醚是一种无色、易发挥的液体,沸点34.5℃,有特殊气味,具有麻醉作用。乙醚易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机化合物。
2.醇的化学性质
(3)消去反应
【实验3-2】在圆底烧瓶中加入乙醇与浓硫酸按体积比1∶3的混合液20 mL,并加入碎瓷片防止暴沸。加热混合溶液,迅速升温到170 ℃,将生成的气体先通入NaOH溶液除去杂质,再分别通入KMnO4酸性溶液和溴的四氯化碳溶液中,观察现象。
KMnO4酸性溶液、溴的四氯化碳溶液褪色。
乙醇在浓硫酸作用下,加热到170 ℃,发生了消去反应,生成乙烯。
实验现象:
实验结论:
反应原理:
2.醇的化学性质
5.酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水乙醇,酒精与浓硫酸体积比以1∶3为宜。
4.加药品顺序——浓硫酸缓慢加入乙醇中
1.放入几片碎瓷片作用——防止暴沸
2.浓硫酸的作用——催化剂和脱水剂
3.温度计的位置——温度计水银球要置于反应物的液面下,因为需要测量的是反应物的温度。
【实验注意事项】
2.醇的化学性质
6.有何杂质气体?如何除去?
由于无水乙醇和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过NaOH溶液。
7.为何使用NaOH溶液进行洗气?
因乙烯中混有的CH3CH2OH、SO2气体能使酸性KMnO4溶液褪色影响乙烯的检验,故必须用NaOH溶液先将其除去。
8.为何使液体温度迅速升到170℃?
因为无水乙醇和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
2.醇的化学性质
醇的消去反应的规律:
①醇发生消去反应(分子内脱水)的断键位置:
—C—C—
H OH
浓H2SO4
+H2O
—C==C—
α
β
醇发生消去反应:要求与羟基相连碳的邻位碳原子上有氢原子。
若醇分子中α–C原子连接两个或三个β–C,且β–C原子上均有氢原子时,发生消去反应可能生成不同的产物。例如:
发生消去反应产物为CH3CH=CHCH3或CH3CH2CH=CH2
CH3—CH2—CH—CH3
OH
②
2.醇的化学性质
(4)氧化反应
【回顾】
乙醇的氧化反应
燃烧
催化氧化
C2H5OH+3O2 2CO2+3H2O
点燃
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu/Ag
△
现象:铜丝保持红热,说明反应______(放热,吸热)
在试管口可以闻到刺激性气体,说明有 生成.
铜丝的颜色变化:____ → _____ → ______,反应后,铜丝的质量 .
放热
乙醛
红 黑 红
不变
步骤:①用小试管取3~4mL无水乙醇。②加热一端绕成螺旋状的铜丝至红热③将铜丝趁热插到盛有乙醇的试管④反复操作几次,观察铜丝颜色和液体气味的变化。
2.醇的化学性质
(4)氧化反应——醇与强氧化剂反应
2.醇的化学性质
(4)氧化反应——醇与强氧化剂反应
如图所示,在试管中加入酸性重铬酸钾溶液,然后滴加乙醇,充分振荡,观察实验现象。
K2Cr2O7
Cr2(SO4)3
重铬酸钾(橙色) 硫酸铬 (绿色)
CH3CH2OH
酸性重铬酸钾溶液
橙色
绿色
提示:C2H5OH被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色的原理与C2H5OH被酸性K2Cr2O7溶液氧化的原理相同。
2.醇的化学性质
(4)氧化反应
在上述实验中所用到的酸性重铬酸钾(K2Cr2O7)溶液也是一种常用氧化剂。乙醇能被酸性重铬酸钾溶液氧化,其氧化过程可分为两个阶段:
CH3CH2OH CH3CHO CH3COOH
氧化
氧化
乙醇
乙醛
乙酸
生活小常识:不少人缺少乙醛脱氢酶,这使体内的乙醛不易被氧化为乙酸,所以有些人喝酒后会产生脸红等醉酒症状。
2.醇的化学性质
(5)氧化反应与还原反应的概念
概念 举例
氧化反应 在有机化学反应中,通常把有机物被氧化的反应叫做氧化反应,表现为有机化合物分子中失去氢原子或加入氧原子。 乙醇在氧化剂的作用下失去氢原子转化为乙醛
还原反应 在有机化学反应中,通常把有机物被还原的反应叫做还原反应,表现为有机化合物分子中加入氢原子或失去氧原子 乙烯与氢气加成反应
2.醇的化学性质
乙醇发生化学反应时化学键的断裂情况
乙醇的化学性质与结构的关系 反应类型 反应物 断键位置 反应条件
置换反应 乙醇、活泼金属 —
取代 反应 卤代反应 乙醇、浓HX
酯化反应 乙醇、羧酸
(自身)成醚 分子间脱水 乙醇
消去反应 乙醇
氧化 反应 催化氧化 乙醇、氧气
强氧化剂氧化 乙醇、KMnO4/H+
燃烧 乙醇、O2 全部 点燃
①
②
①
一分子断①,
另一分子断②
②⑤
①③
①③
△
浓硫酸,△
浓硫酸,
140 ℃
浓硫酸,
170 ℃
Cu/Ag,△
—
将乙醇分子中的化学键按如图所示标号,乙醇发生化学反应时化学键的断裂情况如表所示:
随堂训练
1.下列有关乙醇的实验操作或实验现象正确的是( )
A.①中酸性KMnO4溶液会褪色,乙醇转化为乙醛
B.②中有气泡产生,上方的火焰为淡蓝色
C.③中灼热的铜丝插入乙醇中,铜丝由红色变为黑色
D.④中X是饱和的NaOH溶液,X液面上有油状液体生成
B
随堂训练
2.下列有机反应属于取代反应的是( )
A.CH3CH2OH以铜作催化剂在空气中加热
B.乙烯与水在一定条件下反应生成乙醇
C.乙醇与浓硫酸加热至170℃制取乙烯
D.乙醇与浓硫酸加热至140℃制取乙醚
D
谢谢观看
3.2.1 醇
核心素养目标
宏观辨识与微观探析
能从宏观上认识醇的典型物理性质和化学性质,如乙醇的溶解性、可燃性等;从微观角度理解醇的结构(包括官能团羟基的结构特点)对其性质的影响,能分析醇发生化学反应时的断键位置和方式。
证据推理与模型认知
通过对醇的实验现象、数据等证据的分析,推理得出醇的性质和反应规律;构建醇的结构 - 性质 - 用途的认知模型,能运用该模型解释和预测醇的相关性质和反应。
科学探究与创新意识
了解醇在日常生活、工业生产等方面的应用,认识化学对社会发展的重要贡献;培养严谨、认真的科学态度,以及合理使用化学物质、保护环境的社会责任意识。
学习重难点
重点
醇的结构特点,特别是官能团羟基的结构以及与烃基的相互影响。
醇的化学性质,如与金属钠的反应、消去反应、催化氧化反应、取代反应等,理解反应的原理和断键方式。
乙醇的分子结构和化学性质,以乙醇为典型代表物,深入理解醇类物质的通性。
难点
醇发生消去反应和催化氧化反应的反应机理和反应条件,能够准确判断反应的产物和反应类型。
理解醇的结构与性质之间的内在联系,从微观角度解释醇的各种化学性质,如为什么醇能发生某些反应而烷烃不能。
课前导入
我们都知道,酒中含有大量的酒精,酒精就是乙醇,那么,喝完酒后,乙醇会在我们身体里发生什么样的变化呢?
温馨提示:
未成年不允许饮酒!
醇的定义及分类
PART 01
1.醇的定义
定义 烃分子中的氢原子被羟基取代可衍生出含羟基的化合物,其中羟基与饱和碳原子相连的化合物称为醇。
饱和一元醇及其通式 由链状烷烃衍生的一元醇,叫做饱和一元醇,其通式为CnH2n+1OH(n≥1),可简写为R—OH。
(1)饱和碳原子采取sp3杂化,只与其他原子形成单键,如烷烃中的碳原子都是饱和碳原子。
(2)当羟基与不饱和碳原子相连时,不稳定(共轭体系除外),能发生分子内原子的重新组合,如CH2=CH—OH→CH3CHO。
2.醇的分类
醇
按分子中羟基的数目
按烃基类型
按烃基是否饱和
一元醇:分子中只含有一个羟基的醇,如CH3OH
二元醇:分子中含有两个羟基的醇,如CH2—OH
丨
CH2—OH
多元醇:分子中含有两个羟基的醇,如CH2—OH
丨
CH—OH
丨
CH2—OH
脂肪醇:如CH3CH2OH
脂环醇:如
芳香醇:如
—CH2OH
饱和醇:如CH3CH2OH、
不饱和醇:如CH2=CH—CH2OH、
—CH2OH
不包括同一个碳原子上连有2个或多个羟基的醇,这样的醇不稳定。
醇分子中的烃基是烷基。
3.醇的命名
(1)习惯命名法:
用于结构简单的一元醇的命名。方法是在“醇”字前加上用习惯命名法命名的烃基名称,通常“基”字可省略。如:
CH3OH
(CH3)2CHCH2OH
CH3CH2CH2OH
—CH2OH
甲醇
异丁醇
正丁醇
苯甲醇
3.醇的命名
(2)系统命名法:
①一元醇的命名
选主链称某醇
选择连有羟基的最长碳链为主链,按主链所含碳原子数称为某醇。
编号位定支链
a.从离羟基最近的一端开始编号;
b.距离相同时,使取代基位号和最小。
按规则写名称
取代基位号—(取代基个数)取代基名称—羟基位号—母体名称。
3.醇的命名
(2)系统命名法:
②多元醇的命名
当醇分子中含多个羟基时,应选择含羟基最多的最长碳链为主链,并从靠近羟基的一端开始编号。羟基的个数用“二”“三”等表示。
如:
如: OH
丨
CH—CH3
丨
CH3—CH2—CH—CH2—CH—CH3
丨
CH3
1
2
3
4
5
6
5—甲基—3—乙基—2—己醇
CH2CH2CHCH3
丨
丨
OH
OH
1,3—丁二醇
4.常见的醇
甲醇
基本有机原料之一。主要用于制造甲醛、乙酸、氯甲烷、甲胺和硫酸二甲酯等多种有机产品。
用于制造醋酸、饮料、香精、染料、燃料等、消毒剂等,在国防工业、医疗卫生、有机合成、食品工业、工农业生产中都有广泛的用途。
乙二醇
醇的性质
PART 02
1.醇的物理性质及其变化规律
醇在水中的溶解度一般随分子中碳原子数的增加而降低,沸点随碳原子数的增加而升高。
几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃ 状态 水中溶解度
甲醇 CH3OH -97 65 液体 能与水以任意比例互溶
乙醇 CH3CH2OH -117 79 正丙醇 CH3CH2CH2OH -126 97 正丁醇 CH3CH2CH2CH2OH -90 118 油状液体 可部分溶于水
正戊醇 CH3CH2CH2CH2CH2OH -79 138 十八醇 CH3(CH2)17OH 59 211 蜡状固体 难溶于水
结论:
2、在水中的溶解度随碳原子数的增加而降低。
1、饱和一元醇的熔、沸点随碳原子数的增加而升高。
1.醇的物理性质及其变化规律
相对分子质量相近的醇与烷烃的沸点比较
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。
1.醇的物理性质及其变化规律
多元醇的沸点、水溶性与氢键的关系:多元醇分子中的羟基较多,一方面增大了醇分子间形成氢键的概率,使多元醇的沸点较高;另一方面增大了醇分子与水分子之间形成氢键的概率,使多元醇易溶于水。
羟基的存在使醇分子间也容易形成氢键,增强了醇分子间的作用力。所以与相对分子质量相近的烷经相比,醇具有较高的沸点。醇溶于水时与水也容易形成氢键,因此低级醇具有良好的水溶性。
R
R
O
O
H
H
R
R
O
O
H
H
R
R
O
O
H
H
氢键
2.醇的化学性质
H H
| |
H—C—C—O—H
| |
H H
电负性大,吸引电子的能力强
极性强,易断裂,发生取代反应或消去反应
极性强,易断裂,发生取代反应
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
(1)与活泼金属反应
2.醇的化学性质
(2)取代反应
①与氢卤酸反应:乙醇与浓氢溴酸混合加热后发生取代反应,生成溴乙烷。
醇与氢卤酸混合加热后发生取代反应,生成卤代烃和水。这是制备卤代烃的方法之一。
C2H5-OH + H-Br C2H5Br+ H2O
△
溴乙烷 乙醇:
对比:
CH3CH2-Br + H-OH
CH3CH2-OH + H-Br
NaOH
△
说明:反应条件不同,反应方向不同。但上述反应不是可逆反应!
(碱性条件)
2.醇的化学性质
(2)取代反应
②醇与含氧酸发生酯化反应:
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
③醇分子间脱水成醚:
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
乙醚是一种无色、易发挥的液体,沸点34.5℃,有特殊气味,具有麻醉作用。乙醚易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机化合物。
2.醇的化学性质
(3)消去反应
【实验3-2】在圆底烧瓶中加入乙醇与浓硫酸按体积比1∶3的混合液20 mL,并加入碎瓷片防止暴沸。加热混合溶液,迅速升温到170 ℃,将生成的气体先通入NaOH溶液除去杂质,再分别通入KMnO4酸性溶液和溴的四氯化碳溶液中,观察现象。
KMnO4酸性溶液、溴的四氯化碳溶液褪色。
乙醇在浓硫酸作用下,加热到170 ℃,发生了消去反应,生成乙烯。
实验现象:
实验结论:
反应原理:
2.醇的化学性质
5.酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水乙醇,酒精与浓硫酸体积比以1∶3为宜。
4.加药品顺序——浓硫酸缓慢加入乙醇中
1.放入几片碎瓷片作用——防止暴沸
2.浓硫酸的作用——催化剂和脱水剂
3.温度计的位置——温度计水银球要置于反应物的液面下,因为需要测量的是反应物的温度。
【实验注意事项】
2.醇的化学性质
6.有何杂质气体?如何除去?
由于无水乙醇和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过NaOH溶液。
7.为何使用NaOH溶液进行洗气?
因乙烯中混有的CH3CH2OH、SO2气体能使酸性KMnO4溶液褪色影响乙烯的检验,故必须用NaOH溶液先将其除去。
8.为何使液体温度迅速升到170℃?
因为无水乙醇和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
2.醇的化学性质
醇的消去反应的规律:
①醇发生消去反应(分子内脱水)的断键位置:
—C—C—
H OH
浓H2SO4
+H2O
—C==C—
α
β
醇发生消去反应:要求与羟基相连碳的邻位碳原子上有氢原子。
若醇分子中α–C原子连接两个或三个β–C,且β–C原子上均有氢原子时,发生消去反应可能生成不同的产物。例如:
发生消去反应产物为CH3CH=CHCH3或CH3CH2CH=CH2
CH3—CH2—CH—CH3
OH
②
2.醇的化学性质
(4)氧化反应
【回顾】
乙醇的氧化反应
燃烧
催化氧化
C2H5OH+3O2 2CO2+3H2O
点燃
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu/Ag
△
现象:铜丝保持红热,说明反应______(放热,吸热)
在试管口可以闻到刺激性气体,说明有 生成.
铜丝的颜色变化:____ → _____ → ______,反应后,铜丝的质量 .
放热
乙醛
红 黑 红
不变
步骤:①用小试管取3~4mL无水乙醇。②加热一端绕成螺旋状的铜丝至红热③将铜丝趁热插到盛有乙醇的试管④反复操作几次,观察铜丝颜色和液体气味的变化。
2.醇的化学性质
(4)氧化反应——醇与强氧化剂反应
2.醇的化学性质
(4)氧化反应——醇与强氧化剂反应
如图所示,在试管中加入酸性重铬酸钾溶液,然后滴加乙醇,充分振荡,观察实验现象。
K2Cr2O7
Cr2(SO4)3
重铬酸钾(橙色) 硫酸铬 (绿色)
CH3CH2OH
酸性重铬酸钾溶液
橙色
绿色
提示:C2H5OH被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色的原理与C2H5OH被酸性K2Cr2O7溶液氧化的原理相同。
2.醇的化学性质
(4)氧化反应
在上述实验中所用到的酸性重铬酸钾(K2Cr2O7)溶液也是一种常用氧化剂。乙醇能被酸性重铬酸钾溶液氧化,其氧化过程可分为两个阶段:
CH3CH2OH CH3CHO CH3COOH
氧化
氧化
乙醇
乙醛
乙酸
生活小常识:不少人缺少乙醛脱氢酶,这使体内的乙醛不易被氧化为乙酸,所以有些人喝酒后会产生脸红等醉酒症状。
2.醇的化学性质
(5)氧化反应与还原反应的概念
概念 举例
氧化反应 在有机化学反应中,通常把有机物被氧化的反应叫做氧化反应,表现为有机化合物分子中失去氢原子或加入氧原子。 乙醇在氧化剂的作用下失去氢原子转化为乙醛
还原反应 在有机化学反应中,通常把有机物被还原的反应叫做还原反应,表现为有机化合物分子中加入氢原子或失去氧原子 乙烯与氢气加成反应
2.醇的化学性质
乙醇发生化学反应时化学键的断裂情况
乙醇的化学性质与结构的关系 反应类型 反应物 断键位置 反应条件
置换反应 乙醇、活泼金属 —
取代 反应 卤代反应 乙醇、浓HX
酯化反应 乙醇、羧酸
(自身)成醚 分子间脱水 乙醇
消去反应 乙醇
氧化 反应 催化氧化 乙醇、氧气
强氧化剂氧化 乙醇、KMnO4/H+
燃烧 乙醇、O2 全部 点燃
①
②
①
一分子断①,
另一分子断②
②⑤
①③
①③
△
浓硫酸,△
浓硫酸,
140 ℃
浓硫酸,
170 ℃
Cu/Ag,△
—
将乙醇分子中的化学键按如图所示标号,乙醇发生化学反应时化学键的断裂情况如表所示:
随堂训练
1.下列有关乙醇的实验操作或实验现象正确的是( )
A.①中酸性KMnO4溶液会褪色,乙醇转化为乙醛
B.②中有气泡产生,上方的火焰为淡蓝色
C.③中灼热的铜丝插入乙醇中,铜丝由红色变为黑色
D.④中X是饱和的NaOH溶液,X液面上有油状液体生成
B
随堂训练
2.下列有机反应属于取代反应的是( )
A.CH3CH2OH以铜作催化剂在空气中加热
B.乙烯与水在一定条件下反应生成乙醇
C.乙醇与浓硫酸加热至170℃制取乙烯
D.乙醇与浓硫酸加热至140℃制取乙醚
D
谢谢观看
