8.1.1 自然资源的开发利用(教学课件)(共30张PPT)_高中化学人教版(2019)必修二
文档属性
| 名称 | 8.1.1 自然资源的开发利用(教学课件)(共30张PPT)_高中化学人教版(2019)必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 60.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-06 22:46:43 | ||
图片预览











文档简介
(共30张PPT)
8.1.1 自然资源的开发利用
金属矿物的开发利用
核心素养目标
1. 宏观辨识与微观探析
能从宏观上认识金属矿物资源的开发利用,理解不同金属冶炼方法的宏
观现象;从微观角度分析金属冶炼过程中氧化还原反应的本质,建立宏观 - 微观
之间的联系。
2. 科学探究与创新意识
通过对金属冶炼方法的探究,培养科学探究能力;鼓励学生对现有金属冶
炼方法进行创新思考,探索环保高效的新冶炼方法,以提高金属矿物的利用率。
3. 科学态度与社会责任
认识到地球上金属矿物资源的有限性和分布不均,树立资源保护意识;理
解金属冶炼过程中的能耗和环境污染问题,培养学生关注社会可持续发展的责
任感,积极倡导回收和再利用废旧金属等资源节约行为。
学习重难点
重点:
1. 不同金属的冶炼方法,如加热分解法、电解法、热还原法等,以及对应的
原理和典型反应。
2. 金属矿物资源的综合利用途径。
3. 以金属矿物为例,理解自然资源开发利用中的环境与发展问题。
难点:
1. 从氧化还原反应的本质理解不同金属冶炼方法的选择依据。
2. 如何引导学生建立资源有限和可持续发展的观念,将科学知识转化为社会
责任感,落实到实际行动中。
1. 金属元素在自然界的存在形式
游离态的银
磁铁矿(Fe3O4)
黄铁矿(FeS2)
黄铜矿(CuFeS2)
铝土矿(Al2O3)
游离态的金
游离态的铂
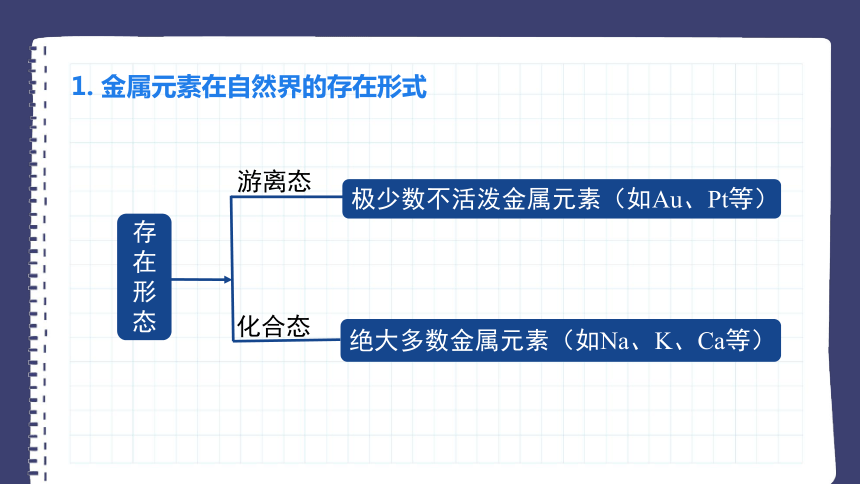
1. 金属元素在自然界的存在形式
存在形态
绝大多数金属元素(如Na、K、Ca等)
极少数不活泼金属元素(如Au、Pt等)
游离态
化合态
2. 金属冶炼原理
实质:将金属元素从化合态还原为游离态:
概念:将金属矿物中的金属从其化合物中还原出来,用于生产
各种金属材料的过程。
思考讨论
1. 为什么不同历史时期人类使用的器具材质不同呢?受到哪些因素的影响?
思考讨论
2. 金属活动性不同,还原方法一样吗?金属活动顺序与金属冶炼有关系吗?
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
3. 金属冶炼的方法
(1)金属冶炼方法与金属活动性的关系
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
金属阳离子得电子能力逐渐增强
电解法
电解法
热分
解法
物理方法
3. 金属冶炼的方法
(2)金属冶炼的方法——热分解法
适用对象:不活泼金属Hg、Ag
3. 金属冶炼的方法
(2)金属冶炼的方法——热还原法
适用对象:较活泼金属
(金属活动性排在Al之后和Hg之前的大多数金属)
铝热反应
[现象]
镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。
[原理]
铝热反应
(1)概念:铝与某些难熔金属氧化物(如Fe2O3、Cr2O3、MnO2等)在高温下发生的置换反应称为铝热反应。
(2)铝热剂:铝粉和某些难熔金属氧化物(如Fe2O3、Cr2O3、MnO2等)以一定比例形成的混合物。
(3)反应特点:在高温下进行,反应迅速并剧烈放热,新生成的金属单质呈熔融态且易于Al2O3(固态)分离。
(4)应用:冶炼金属、焊接钢轨等。
3. 金属冶炼的方法
(2)金属冶炼的方法——电解法
适用对象:非常活泼的金属K、Ca、Na、Mg、Al
Na3AlF6
作用:降低熔融
时的温度
思考讨论
1. 制取金属钾、钠、镁时,为何电解熔融的KCl、NaCl、MgCl2 而不电解熔融的 K2O、 Na2O、 MgO?
物质 MgO Al2O3 MgCl2 AlCl3
熔点/℃ 2852 2054 714 190(以分子形式存在)
沸点/℃ 3600 2980 1412 180
K2O、Na2O、MgO的熔点高,熔融时消耗大量热能,增加生产成本
思考讨论
2. 制取金属铝时,为什么电解熔融Al2O3而不电解熔融AlCl3?
物质 MgO Al2O3 MgCl2 AlCl3
熔点/℃ 2852 2054 714 190(以分子形式存在)
沸点/℃ 3600 2980 1412 180
氯化铝是共价化合物,熔融态氯化铝不导电,不能电离出Al3+
拓展延伸
同一种金属可能有不同的冶炼方法,可根据原料、生产设备、
金属的用途等来确定,如Cu可采用热还原法、湿法冶炼、火法炼铜。
湿法炼铜:
Fe+CuSO4===FeSO4+Cu
火法炼铜:
Cu2S+O2===2Cu+SO2
高温
信州铅山县有苦泉,流以为涧。其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之异化为铜。
——沈括《梦溪笔谈》
用矿(硫化矿,主要成分为Cu2S)二百五十箩……入大旋风炉,连烹(灼烧) 三日三夜,方见成铜。
——明·陆容《菽园杂记》
易错提醒
根据金属的活动性采用相应的冶炼方法。在金属活动性顺序
中,金属的位置越靠前越难被还原,金属的位置越靠后越容易被还
原。工业上冶炼金属要综合考虑反应原理、生产条件、经济效益
、安全性、环境污染等众多因素。
电解法炼钾
电解生成的钾会分散在钾的熔融盐中,导
致无法把钾分离出来。
×
√
4. 金属矿物的合理开发和利用
(1)原因
①金属资源有限且分布不均匀
②金属的冶炼消耗许多能量
③金属冶炼造成环境污染
④金属腐蚀造成大量损失
4. 金属矿物的合理开发和利用
计算表明,生产1 mol铝消耗的电能至少为1.8×106 J,回收
铝制饮料罐得到铝与从铝土矿得到铝相比,前者的能耗仅为后者的
3%~5%。通过对上述数据的分析和比较,你想到了什么?
4. 金属矿物的合理开发和利用
(2)措施
①提高金属矿物的利用率
②使用其他材料代替金属材料
③加强废旧金属的回收和再利用
④开发环保高效的金属冶炼冶炼方法
⑤防止金属的腐蚀
课堂小结
1. 下列说法正确的是( )
A.金属的冶炼原理就是利用氧化还原反应,在一定条件下将金
属从其化合物中还原出来
B.冶炼金属时,必须加入一种物质作为还原剂
C.金属由化合态变为游离态,可能被还原,也可能被氧化D.金属被发现和应用得越早,其在地壳中的含量越高
随堂练习
A
2. 下列有关金属冶炼的叙述中正确的是 ( )
A.铜作为人类应用最早的金属,其冶炼方法也较为简单,多用热
分解法炼铜
B.高炉炼铁采用的是热还原法
C.电解熔融氯化铝可以制得高纯度的铝
D.工业上常使用电解熔融氧化镁的方法制金属镁
随堂练习
B
3. 金属锂是密度最小的金属,等质量的金属锂能释放出更多的电子,故常用来制造高能量电池。已知锂的金属性介于钠和镁之间,则下列方法能冶炼出金属锂的是( )
A.电解法 B.热还原法
C.热分解法 D.铝热法
随堂练习
A
4. 北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是( )
A. 胆矾的化学式为CuSO4
B. 胆矾可作为湿法冶铜的原料
C. “熬之则成胆矾”是浓缩结晶过程
D. “熬胆矾铁釜,久之亦化为铜”是发生了置换反应
随堂练习
A
5. 关于废旧金属处理的下列说法中不正确的是( )
A.对废旧金属的最好处理方法是回收、再利用
B.重金属对人体有害,对废旧重金属材料的处理方法是填埋C.废旧钢铁可用于炼钢,废铁屑可用于制铁盐
D.照相业、科研单位和医院X光室回收的定影液中,可以提取
金属银
随堂练习
B
6. 下列金属冶炼的反应原理不正确的是( )
A.
B.
C.
D.
随堂练习
B
谢谢观看
8.1.1 自然资源的开发利用
金属矿物的开发利用
核心素养目标
1. 宏观辨识与微观探析
能从宏观上认识金属矿物资源的开发利用,理解不同金属冶炼方法的宏
观现象;从微观角度分析金属冶炼过程中氧化还原反应的本质,建立宏观 - 微观
之间的联系。
2. 科学探究与创新意识
通过对金属冶炼方法的探究,培养科学探究能力;鼓励学生对现有金属冶
炼方法进行创新思考,探索环保高效的新冶炼方法,以提高金属矿物的利用率。
3. 科学态度与社会责任
认识到地球上金属矿物资源的有限性和分布不均,树立资源保护意识;理
解金属冶炼过程中的能耗和环境污染问题,培养学生关注社会可持续发展的责
任感,积极倡导回收和再利用废旧金属等资源节约行为。
学习重难点
重点:
1. 不同金属的冶炼方法,如加热分解法、电解法、热还原法等,以及对应的
原理和典型反应。
2. 金属矿物资源的综合利用途径。
3. 以金属矿物为例,理解自然资源开发利用中的环境与发展问题。
难点:
1. 从氧化还原反应的本质理解不同金属冶炼方法的选择依据。
2. 如何引导学生建立资源有限和可持续发展的观念,将科学知识转化为社会
责任感,落实到实际行动中。
1. 金属元素在自然界的存在形式
游离态的银
磁铁矿(Fe3O4)
黄铁矿(FeS2)
黄铜矿(CuFeS2)
铝土矿(Al2O3)
游离态的金
游离态的铂
1. 金属元素在自然界的存在形式
存在形态
绝大多数金属元素(如Na、K、Ca等)
极少数不活泼金属元素(如Au、Pt等)
游离态
化合态
2. 金属冶炼原理
实质:将金属元素从化合态还原为游离态:
概念:将金属矿物中的金属从其化合物中还原出来,用于生产
各种金属材料的过程。
思考讨论
1. 为什么不同历史时期人类使用的器具材质不同呢?受到哪些因素的影响?
思考讨论
2. 金属活动性不同,还原方法一样吗?金属活动顺序与金属冶炼有关系吗?
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
3. 金属冶炼的方法
(1)金属冶炼方法与金属活动性的关系
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
金属阳离子得电子能力逐渐增强
电解法
电解法
热分
解法
物理方法
3. 金属冶炼的方法
(2)金属冶炼的方法——热分解法
适用对象:不活泼金属Hg、Ag
3. 金属冶炼的方法
(2)金属冶炼的方法——热还原法
适用对象:较活泼金属
(金属活动性排在Al之后和Hg之前的大多数金属)
铝热反应
[现象]
镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。
[原理]
铝热反应
(1)概念:铝与某些难熔金属氧化物(如Fe2O3、Cr2O3、MnO2等)在高温下发生的置换反应称为铝热反应。
(2)铝热剂:铝粉和某些难熔金属氧化物(如Fe2O3、Cr2O3、MnO2等)以一定比例形成的混合物。
(3)反应特点:在高温下进行,反应迅速并剧烈放热,新生成的金属单质呈熔融态且易于Al2O3(固态)分离。
(4)应用:冶炼金属、焊接钢轨等。
3. 金属冶炼的方法
(2)金属冶炼的方法——电解法
适用对象:非常活泼的金属K、Ca、Na、Mg、Al
Na3AlF6
作用:降低熔融
时的温度
思考讨论
1. 制取金属钾、钠、镁时,为何电解熔融的KCl、NaCl、MgCl2 而不电解熔融的 K2O、 Na2O、 MgO?
物质 MgO Al2O3 MgCl2 AlCl3
熔点/℃ 2852 2054 714 190(以分子形式存在)
沸点/℃ 3600 2980 1412 180
K2O、Na2O、MgO的熔点高,熔融时消耗大量热能,增加生产成本
思考讨论
2. 制取金属铝时,为什么电解熔融Al2O3而不电解熔融AlCl3?
物质 MgO Al2O3 MgCl2 AlCl3
熔点/℃ 2852 2054 714 190(以分子形式存在)
沸点/℃ 3600 2980 1412 180
氯化铝是共价化合物,熔融态氯化铝不导电,不能电离出Al3+
拓展延伸
同一种金属可能有不同的冶炼方法,可根据原料、生产设备、
金属的用途等来确定,如Cu可采用热还原法、湿法冶炼、火法炼铜。
湿法炼铜:
Fe+CuSO4===FeSO4+Cu
火法炼铜:
Cu2S+O2===2Cu+SO2
高温
信州铅山县有苦泉,流以为涧。其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之异化为铜。
——沈括《梦溪笔谈》
用矿(硫化矿,主要成分为Cu2S)二百五十箩……入大旋风炉,连烹(灼烧) 三日三夜,方见成铜。
——明·陆容《菽园杂记》
易错提醒
根据金属的活动性采用相应的冶炼方法。在金属活动性顺序
中,金属的位置越靠前越难被还原,金属的位置越靠后越容易被还
原。工业上冶炼金属要综合考虑反应原理、生产条件、经济效益
、安全性、环境污染等众多因素。
电解法炼钾
电解生成的钾会分散在钾的熔融盐中,导
致无法把钾分离出来。
×
√
4. 金属矿物的合理开发和利用
(1)原因
①金属资源有限且分布不均匀
②金属的冶炼消耗许多能量
③金属冶炼造成环境污染
④金属腐蚀造成大量损失
4. 金属矿物的合理开发和利用
计算表明,生产1 mol铝消耗的电能至少为1.8×106 J,回收
铝制饮料罐得到铝与从铝土矿得到铝相比,前者的能耗仅为后者的
3%~5%。通过对上述数据的分析和比较,你想到了什么?
4. 金属矿物的合理开发和利用
(2)措施
①提高金属矿物的利用率
②使用其他材料代替金属材料
③加强废旧金属的回收和再利用
④开发环保高效的金属冶炼冶炼方法
⑤防止金属的腐蚀
课堂小结
1. 下列说法正确的是( )
A.金属的冶炼原理就是利用氧化还原反应,在一定条件下将金
属从其化合物中还原出来
B.冶炼金属时,必须加入一种物质作为还原剂
C.金属由化合态变为游离态,可能被还原,也可能被氧化D.金属被发现和应用得越早,其在地壳中的含量越高
随堂练习
A
2. 下列有关金属冶炼的叙述中正确的是 ( )
A.铜作为人类应用最早的金属,其冶炼方法也较为简单,多用热
分解法炼铜
B.高炉炼铁采用的是热还原法
C.电解熔融氯化铝可以制得高纯度的铝
D.工业上常使用电解熔融氧化镁的方法制金属镁
随堂练习
B
3. 金属锂是密度最小的金属,等质量的金属锂能释放出更多的电子,故常用来制造高能量电池。已知锂的金属性介于钠和镁之间,则下列方法能冶炼出金属锂的是( )
A.电解法 B.热还原法
C.热分解法 D.铝热法
随堂练习
A
4. 北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是( )
A. 胆矾的化学式为CuSO4
B. 胆矾可作为湿法冶铜的原料
C. “熬之则成胆矾”是浓缩结晶过程
D. “熬胆矾铁釜,久之亦化为铜”是发生了置换反应
随堂练习
A
5. 关于废旧金属处理的下列说法中不正确的是( )
A.对废旧金属的最好处理方法是回收、再利用
B.重金属对人体有害,对废旧重金属材料的处理方法是填埋C.废旧钢铁可用于炼钢,废铁屑可用于制铁盐
D.照相业、科研单位和医院X光室回收的定影液中,可以提取
金属银
随堂练习
B
6. 下列金属冶炼的反应原理不正确的是( )
A.
B.
C.
D.
随堂练习
B
谢谢观看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
