8.1.2 自然资源的开发利用(教学课件)(共30张PPT)_高中化学人教版(2019)必修二
文档属性
| 名称 | 8.1.2 自然资源的开发利用(教学课件)(共30张PPT)_高中化学人教版(2019)必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 39.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-06 22:47:46 | ||
图片预览








文档简介
(共30张PPT)
8.1.2 自然资源的开发利用
海水资源的开发利用
核心素养目标
1. 宏观辨识与微观探析
能从宏观上认识海洋是巨大的化学资源宝库,知晓海水资源开发利用的
主要方向;从微观角度理解海水中各种元素的存在形态及相互作用。
2. 科学探究与创新意识
通过对海水提溴工艺流程的分析与讨论,培养学生设计实验方案、分析
实验步骤、书写离子方程式等科学探究能力。
3. 科学态度与社会责任
培养学生严谨、认真的科学态度,在分析海水资源利用的过程中,尊重
科学事实和数据;使学生认识到海水资源开发利用对保障国家资源安全、促
进可持续发展的重要意义,增强社会责任感。
学习重难点
重点:
1. 海水资源开发利用的主要方式,包括海水淡化、海水制盐及以食盐为
原料的化工生产。
2. 海水提溴的工艺流程及涉及的化学反应。
3. 海水中化学元素的种类、含量特点及资源价值。
难点:
1. 理解海水提溴过程中各步骤的原理和作用,以及如何利用氧化—还原
反应实现溴元素的富集和提取。
2. 从资源综合利用和可持续发展的角度,思考海水资源开发利用的新策
略和面临的挑战。
新课导入
同学们,地球被称为 “蓝色星球”,因为海洋约占地球表面积的 71% 。海洋就像一个巨大的宝藏库,蕴含着丰富的资源。想象一下,在广阔的海洋中,不仅有各种各样的生物,还有我们生活中不可或缺的食盐,以及在工业、医药等领域有着重要作用的溴等物质。
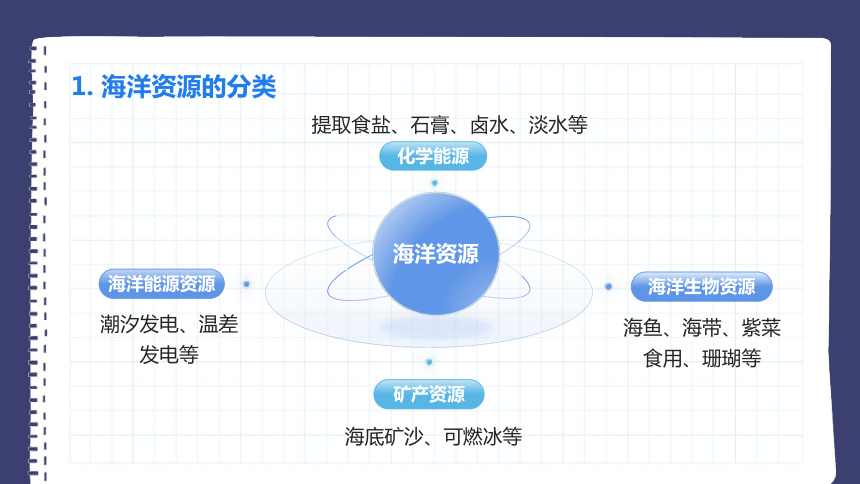
1. 海洋资源的分类
海洋能源资源
潮汐发电、温差发电等
海洋生物资源
海鱼、海带、紫菜食用、珊瑚等
矿产资源
海底矿沙、可燃冰等
海洋资源
化学能源
提取食盐、石膏、卤水、淡水等
2. 海水资源的特点
广阔性
海洋约占地球表面积的71%,其中水的储量约为1.3×1018t,约占地球总水量的97%。
多样性
海水中溶解和悬浮着大量的无机物和有机物,其中含量最多的O、H两种元素,加上Cl、Na、Mg、S、Ca等11种元素,其总含量超过99%。其他元素为微量。
分散性
许多元素的富集程度很低,例如,海水中金元素的总储量约为5×106 t,而 1 t海水中金元素的含量仅为4×10-6g
1
2
3
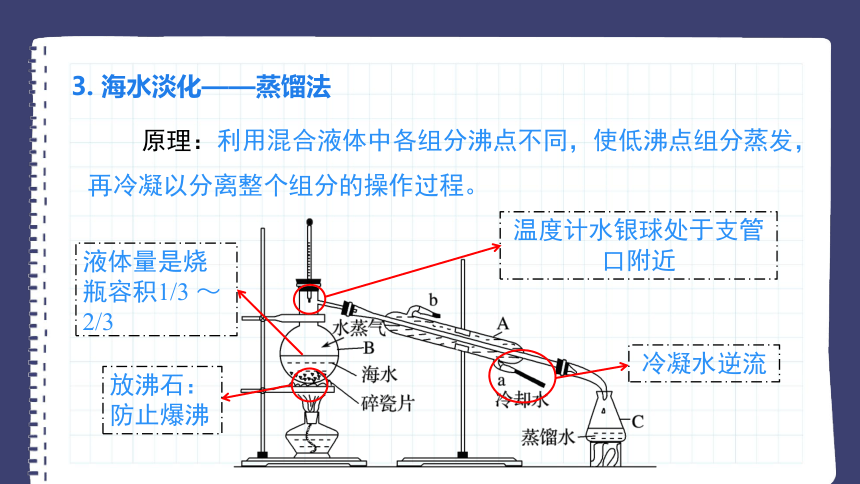
3. 海水淡化——蒸馏法
原理:利用混合液体中各组分沸点不同,使低沸点组分蒸发,再冷凝以分离整个组分的操作过程。
放沸石:防止爆沸
液体量是烧瓶容积1/3 ~ 2/3
温度计水银球处于支管口附近
冷凝水逆流
易错提醒
1、蒸馏烧瓶须垫石棉网加热或水浴加热(防止温度过高且能
使溶液受热均匀)。
2、蒸馏烧瓶所盛液体不能超过烧瓶容量的三分之二,不能
少于三分之一。
3、须向蒸馏烧瓶中加几粒沸石或几片碎瓷片,以防液体爆沸。
4、温度计的量程应高于馏分的最高沸点,要使温度计的水
银球与蒸馏烧瓶支管口持平。
5、冷凝管内冷却水走向:下口进,上口出。与蒸汽流向相反,
更有利于蒸汽的冷却。
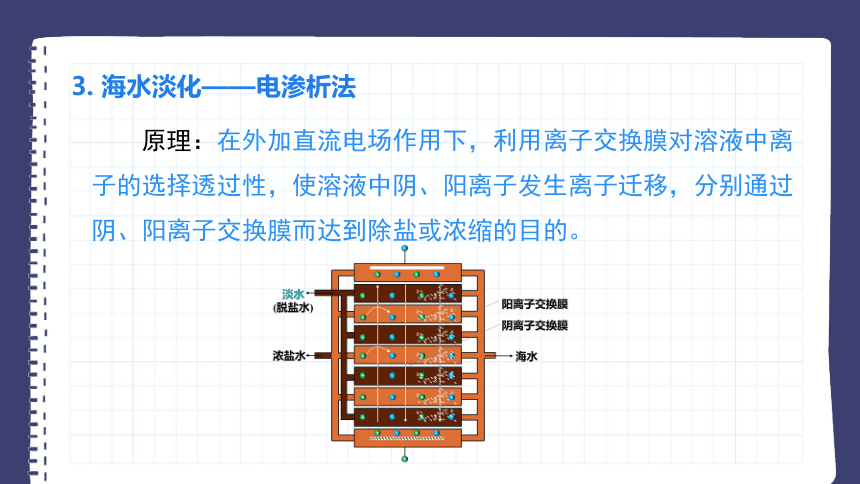
3. 海水淡化——电渗析法
原理:在外加直流电场作用下,利用离子交换膜对溶液中离子的选择透过性,使溶液中阴、阳离子发生离子迁移,分别通过阴、阳离子交换膜而达到除盐或浓缩的目的。
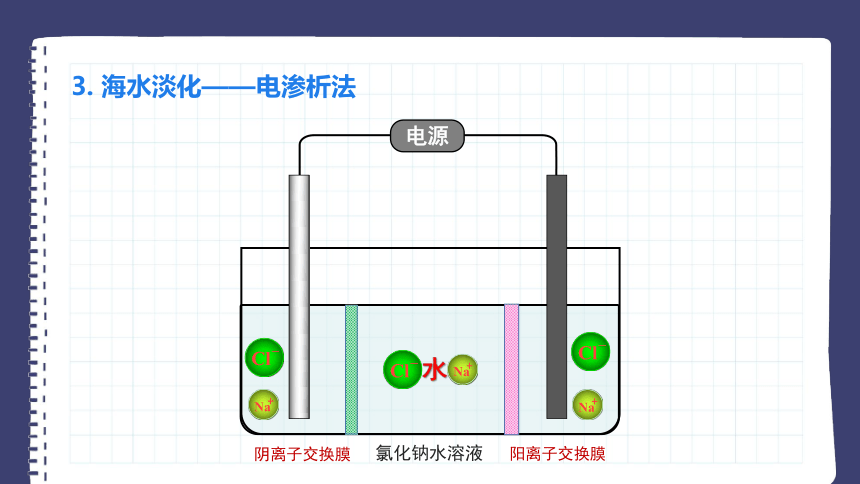
3. 海水淡化——电渗析法
电源
氯化钠水溶液
水
阴离子交换膜
阳离子交换膜
4. 海水制盐
原理:蒸发、结晶。
过程:
海水
引入
盐田
日晒风吹
水蒸发
饱和食盐水
日晒风吹
水蒸发
析出粗盐
提纯
精盐
4. 海水制盐——制盐的应用
(1)制钠:
(2)制纯碱:
(3)氯碱工业:
5. 海水提溴——吹出法
世界上99%的溴以Br -的形式存在于海水中,因此溴也被称为“海洋元素”。
5. 海水提溴——吹出法
浓缩
海水晒盐和海水淡化后的母液中Br- 得到浓缩
1
氧化
氧化海水中的Br- Cl2 + 2Br- = Br2 + 2Cl-
2
吹出
Br2易挥发,利用溴的挥发性,通入热空气将溴从海水中吹出,进入吸收塔
3
吸收
用SO2作还原剂富集溴 Br2 + SO2 + 2H2O = 2HBr + H2SO4
4
蒸馏
用Cl2将氢溴酸氧化为Br2,蒸馏分离出溴蒸气
Cl2 + 2Br- = Br2 + 2Cl-
5
思考讨论
1. 上述转化过程中,两次用到氯气,均发生反应:
Cl2 + 2Br- = Br2 + 2Cl-,设计这两步操作的目的是什么?
将Br-转变为Br2是海水中提取溴的关键反应,但第一次氧化后海水中的Br2含量仍很低,需要将溴富集。
《富集:从大量母体物质中搜集欲测定的痕量元素至一较小体积,从而提高其含量至测定下限以上的这一操作步骤。(即提高目标物质的浓度)》
思考讨论
2. 有人说第一步通入氯气氧化后直接用有机溶剂萃取出溴即可,你认为其建议是否合理?
不合理,直接萃取单质溴不仅需要大量的萃取剂,还会造成一部分溴流失,使成本增加。
3. 为什么要用硫酸酸化后,再通氯气?
酸化可抑制Cl2、Br2与水反应,提高Cl2的利用率。
6. 海水制镁
海水
石灰乳
盐酸
CaO
贝壳
水
煅烧
Mg(OH)2
MgCl2溶液
蒸发结晶
MgCl2·6H2O
脱水
MgCl2晶体
电解
Mg
Cl2
H2
HCl
思考讨论
1. 海水中本来就有氯化镁,为什么不直接通电?而是要经过上述过程来获取MgCl2呢?
除去其它杂质,将MgCl2富集起来。
2. 所加盐酸是否要过量?目的是什么?如果过量,如何除去?
盐酸要过量,保证Mg(OH)2完全反应;过量的稀盐酸加热蒸发即可除去。
7. 海水提碘
海水
海带
海带灰
悬浊液
含I-滤液
碘水
碘的CCl4溶液
单质碘
生物
富集
灼烧
浸泡
过滤
稀硫酸
H2O2或Cl2
CCl4
萃取
分液
蒸馏
萃取
又称溶剂萃取或液液萃取,亦称抽提,是利用系统中组分在溶剂中有不同的溶解度来分离混合物的单元操作。即,是利用物质在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使溶质物质从一种溶剂内转移到另外一种溶剂中的方法。
分液
利用两种液体互不相溶的性质将两种液体分离的方法。
萃取剂的选择
(1)溶质在萃取剂中的溶解度比在原溶剂中大;
(2)萃取剂与原溶剂不反应、不相溶;
(3)萃取剂与溶质不反应。
仪器——分液漏斗
分液漏斗分为球型、梨型等多种样式,梨型分液漏斗的颈比较短,常用做萃取操作的仪器;球型分液漏斗的颈比较长,多用于制气装置中滴加液体的仪器。
课堂小结
1. 许多国家十分重视海水资源的综合利用,不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘
B.钠、镁、铝
C.烧碱、氢气
D.食盐、淡水
随堂练习
D
2. 从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )
随堂练习
D
3. 海水开发利用的部分过程如图所示。下列说法错误的是( )
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还
原吸收
随堂练习
C
4. 下列关于海水资源综合利用的说法正确的是( )
A.可用海水晒盐的方法提取海水中的淡水资源
B.只通过物理变化即可提取海水中的溴
C.从海水中可以提取NaCl,可电解NaCl溶液制备Na
D.利用海水、铝、空气发电是将化学能转化为电能
随堂练习
D
5. 溴及其衍生物是制药业和制取阻燃剂、钻井液等的重要原料,空气吹出法是海水提溴的常用方法,其工艺流程如图所示,回答下列问题:
随堂练习
(1)在实验室若想达到步骤①的目的,需要的仪器有:酒精灯、三脚架、 。
(2)步骤②为工业上电解饱和食盐水制Cl2,该过程还同时生产
(填化学式)。
(3)步骤④通入热空气吹出Br2,利用了溴的 (填标号,下同);步骤⑤中SO2为吸收剂,利用了SO2的 。
A. 氧化性 B.还原性 C.挥发性 D.漂白性
随堂练习
蒸发皿、玻璃棒
NaOH、H2
C
B
(4)步骤⑥中反应的离子方程式为 。
(5)步骤⑦蒸馏过程中,蒸气冷凝后得到下层为液溴、上层为溴水的混合物,继续分离它们的操作名称是 。
(6)提取溴单质,采用蒸馏“溴水混合物 II”而不是蒸馏“溴水混合物 Ⅰ”,请说明原因 。
。
随堂练习
2Br- + Cl2 = Br2 + 2Cl-
分液
将“溴水混合物l"转变为“溴水混合物II”
是Br2的浓缩过程,可提高效率减少能耗、降低成本。
谢谢观看
8.1.2 自然资源的开发利用
海水资源的开发利用
核心素养目标
1. 宏观辨识与微观探析
能从宏观上认识海洋是巨大的化学资源宝库,知晓海水资源开发利用的
主要方向;从微观角度理解海水中各种元素的存在形态及相互作用。
2. 科学探究与创新意识
通过对海水提溴工艺流程的分析与讨论,培养学生设计实验方案、分析
实验步骤、书写离子方程式等科学探究能力。
3. 科学态度与社会责任
培养学生严谨、认真的科学态度,在分析海水资源利用的过程中,尊重
科学事实和数据;使学生认识到海水资源开发利用对保障国家资源安全、促
进可持续发展的重要意义,增强社会责任感。
学习重难点
重点:
1. 海水资源开发利用的主要方式,包括海水淡化、海水制盐及以食盐为
原料的化工生产。
2. 海水提溴的工艺流程及涉及的化学反应。
3. 海水中化学元素的种类、含量特点及资源价值。
难点:
1. 理解海水提溴过程中各步骤的原理和作用,以及如何利用氧化—还原
反应实现溴元素的富集和提取。
2. 从资源综合利用和可持续发展的角度,思考海水资源开发利用的新策
略和面临的挑战。
新课导入
同学们,地球被称为 “蓝色星球”,因为海洋约占地球表面积的 71% 。海洋就像一个巨大的宝藏库,蕴含着丰富的资源。想象一下,在广阔的海洋中,不仅有各种各样的生物,还有我们生活中不可或缺的食盐,以及在工业、医药等领域有着重要作用的溴等物质。
1. 海洋资源的分类
海洋能源资源
潮汐发电、温差发电等
海洋生物资源
海鱼、海带、紫菜食用、珊瑚等
矿产资源
海底矿沙、可燃冰等
海洋资源
化学能源
提取食盐、石膏、卤水、淡水等
2. 海水资源的特点
广阔性
海洋约占地球表面积的71%,其中水的储量约为1.3×1018t,约占地球总水量的97%。
多样性
海水中溶解和悬浮着大量的无机物和有机物,其中含量最多的O、H两种元素,加上Cl、Na、Mg、S、Ca等11种元素,其总含量超过99%。其他元素为微量。
分散性
许多元素的富集程度很低,例如,海水中金元素的总储量约为5×106 t,而 1 t海水中金元素的含量仅为4×10-6g
1
2
3
3. 海水淡化——蒸馏法
原理:利用混合液体中各组分沸点不同,使低沸点组分蒸发,再冷凝以分离整个组分的操作过程。
放沸石:防止爆沸
液体量是烧瓶容积1/3 ~ 2/3
温度计水银球处于支管口附近
冷凝水逆流
易错提醒
1、蒸馏烧瓶须垫石棉网加热或水浴加热(防止温度过高且能
使溶液受热均匀)。
2、蒸馏烧瓶所盛液体不能超过烧瓶容量的三分之二,不能
少于三分之一。
3、须向蒸馏烧瓶中加几粒沸石或几片碎瓷片,以防液体爆沸。
4、温度计的量程应高于馏分的最高沸点,要使温度计的水
银球与蒸馏烧瓶支管口持平。
5、冷凝管内冷却水走向:下口进,上口出。与蒸汽流向相反,
更有利于蒸汽的冷却。
3. 海水淡化——电渗析法
原理:在外加直流电场作用下,利用离子交换膜对溶液中离子的选择透过性,使溶液中阴、阳离子发生离子迁移,分别通过阴、阳离子交换膜而达到除盐或浓缩的目的。
3. 海水淡化——电渗析法
电源
氯化钠水溶液
水
阴离子交换膜
阳离子交换膜
4. 海水制盐
原理:蒸发、结晶。
过程:
海水
引入
盐田
日晒风吹
水蒸发
饱和食盐水
日晒风吹
水蒸发
析出粗盐
提纯
精盐
4. 海水制盐——制盐的应用
(1)制钠:
(2)制纯碱:
(3)氯碱工业:
5. 海水提溴——吹出法
世界上99%的溴以Br -的形式存在于海水中,因此溴也被称为“海洋元素”。
5. 海水提溴——吹出法
浓缩
海水晒盐和海水淡化后的母液中Br- 得到浓缩
1
氧化
氧化海水中的Br- Cl2 + 2Br- = Br2 + 2Cl-
2
吹出
Br2易挥发,利用溴的挥发性,通入热空气将溴从海水中吹出,进入吸收塔
3
吸收
用SO2作还原剂富集溴 Br2 + SO2 + 2H2O = 2HBr + H2SO4
4
蒸馏
用Cl2将氢溴酸氧化为Br2,蒸馏分离出溴蒸气
Cl2 + 2Br- = Br2 + 2Cl-
5
思考讨论
1. 上述转化过程中,两次用到氯气,均发生反应:
Cl2 + 2Br- = Br2 + 2Cl-,设计这两步操作的目的是什么?
将Br-转变为Br2是海水中提取溴的关键反应,但第一次氧化后海水中的Br2含量仍很低,需要将溴富集。
《富集:从大量母体物质中搜集欲测定的痕量元素至一较小体积,从而提高其含量至测定下限以上的这一操作步骤。(即提高目标物质的浓度)》
思考讨论
2. 有人说第一步通入氯气氧化后直接用有机溶剂萃取出溴即可,你认为其建议是否合理?
不合理,直接萃取单质溴不仅需要大量的萃取剂,还会造成一部分溴流失,使成本增加。
3. 为什么要用硫酸酸化后,再通氯气?
酸化可抑制Cl2、Br2与水反应,提高Cl2的利用率。
6. 海水制镁
海水
石灰乳
盐酸
CaO
贝壳
水
煅烧
Mg(OH)2
MgCl2溶液
蒸发结晶
MgCl2·6H2O
脱水
MgCl2晶体
电解
Mg
Cl2
H2
HCl
思考讨论
1. 海水中本来就有氯化镁,为什么不直接通电?而是要经过上述过程来获取MgCl2呢?
除去其它杂质,将MgCl2富集起来。
2. 所加盐酸是否要过量?目的是什么?如果过量,如何除去?
盐酸要过量,保证Mg(OH)2完全反应;过量的稀盐酸加热蒸发即可除去。
7. 海水提碘
海水
海带
海带灰
悬浊液
含I-滤液
碘水
碘的CCl4溶液
单质碘
生物
富集
灼烧
浸泡
过滤
稀硫酸
H2O2或Cl2
CCl4
萃取
分液
蒸馏
萃取
又称溶剂萃取或液液萃取,亦称抽提,是利用系统中组分在溶剂中有不同的溶解度来分离混合物的单元操作。即,是利用物质在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使溶质物质从一种溶剂内转移到另外一种溶剂中的方法。
分液
利用两种液体互不相溶的性质将两种液体分离的方法。
萃取剂的选择
(1)溶质在萃取剂中的溶解度比在原溶剂中大;
(2)萃取剂与原溶剂不反应、不相溶;
(3)萃取剂与溶质不反应。
仪器——分液漏斗
分液漏斗分为球型、梨型等多种样式,梨型分液漏斗的颈比较短,常用做萃取操作的仪器;球型分液漏斗的颈比较长,多用于制气装置中滴加液体的仪器。
课堂小结
1. 许多国家十分重视海水资源的综合利用,不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘
B.钠、镁、铝
C.烧碱、氢气
D.食盐、淡水
随堂练习
D
2. 从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )
随堂练习
D
3. 海水开发利用的部分过程如图所示。下列说法错误的是( )
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还
原吸收
随堂练习
C
4. 下列关于海水资源综合利用的说法正确的是( )
A.可用海水晒盐的方法提取海水中的淡水资源
B.只通过物理变化即可提取海水中的溴
C.从海水中可以提取NaCl,可电解NaCl溶液制备Na
D.利用海水、铝、空气发电是将化学能转化为电能
随堂练习
D
5. 溴及其衍生物是制药业和制取阻燃剂、钻井液等的重要原料,空气吹出法是海水提溴的常用方法,其工艺流程如图所示,回答下列问题:
随堂练习
(1)在实验室若想达到步骤①的目的,需要的仪器有:酒精灯、三脚架、 。
(2)步骤②为工业上电解饱和食盐水制Cl2,该过程还同时生产
(填化学式)。
(3)步骤④通入热空气吹出Br2,利用了溴的 (填标号,下同);步骤⑤中SO2为吸收剂,利用了SO2的 。
A. 氧化性 B.还原性 C.挥发性 D.漂白性
随堂练习
蒸发皿、玻璃棒
NaOH、H2
C
B
(4)步骤⑥中反应的离子方程式为 。
(5)步骤⑦蒸馏过程中,蒸气冷凝后得到下层为液溴、上层为溴水的混合物,继续分离它们的操作名称是 。
(6)提取溴单质,采用蒸馏“溴水混合物 II”而不是蒸馏“溴水混合物 Ⅰ”,请说明原因 。
。
随堂练习
2Br- + Cl2 = Br2 + 2Cl-
分液
将“溴水混合物l"转变为“溴水混合物II”
是Br2的浓缩过程,可提高效率减少能耗、降低成本。
谢谢观看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
