2025年中考化学一轮专题复习 第八单元 金属和金属材料 课堂练习(二)(含答案)
文档属性
| 名称 | 2025年中考化学一轮专题复习 第八单元 金属和金属材料 课堂练习(二)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 112.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-07 15:18:54 | ||
图片预览


文档简介
第八单元 金属和金属材料 课堂练习(二)
一、选择题
1.2024年11月11日,三名航天员平安回家。合金舱体和酚醛树脂的新材料外层为返回舱安全返回保驾护航。对于相关材料说法不正确的是( )
A.舱体和外层均属于合成材料 B.外层材料能保温隔热
C.合金拓宽了金属材料的应用范围 D.外层材料可防止辐射
2.将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,能迅速比较出铁、铜金属活动性强弱的是( )
A.蒸馏水 B.稀硫酸 C.硫酸钠溶液 D.氢氧化钠溶液
3.用如图所示装置进行实验,倾斜Y形管,锌粒与硫酸铜溶液接触,表面有气泡产生并析出红色物质,溶液颜色变浅,经检测产生的气体为氢气。下列说法正确的是( )
A.锌粒参加的反应均为置换反应 B.硫酸铜溶液所含阳离子只有Cu2+
C.可推知金属活动性顺序:铜>锌 D.若用银片代替锌粒,可观察到相似实验现象
4.利用铁粉、炭粉、氯化钠进行铁的锈蚀实验(装置如下图所示,装置气密性良好)。实验1 min后温度计读数上升,8 min后打开止水夹,水倒吸入锥形瓶。实验数据如下表:
实验前的体积 实验后的体积
锥形瓶内空气(含导管内空气) 烧杯内水 烧杯内剩余水
246.0 mL 100.0 mL 51.5 mL
下列说法不合理的是 ( )
A.铁的锈蚀是放热反应 B.使用氯化钠溶液的目的是加快铁的锈蚀
C.此实验能推断出铁的锈蚀需要水的参与 D.计算得出空气中氧气的含量约为19.7%
5.据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,可替代黄金做精密电子元器件。下列对该铜纳米颗粒的判断,正确的是( )
A.能与盐酸反应产生氢气 B.在空气中容易锈蚀
C.能与硫酸镁发生置换反应 D.具有良好的导电性
6.某化学兴趣小组利用如下装置进行创新实验。向烧杯中加入约30 mL稀硫酸,5~7 s后将燃着的木条置于玻璃管口,观察到有火焰产生,一段时间后,观察到铜片由右向左逐渐变红,同时火焰明显变小。下列说法错误的是( )
A.玻璃管口产生的火焰为淡蓝色 B.该实验利用了铜的导热性
C.该实验中共发生了2个化学反应 D.火焰变小的原因可能是稀硫酸的浓度减小
7.推理是化学学习中常见的思维方法,下列推理正确的是( )
A.金属单质都能导电,所以能导电的物质一定是金属单质
B.酸和金属氧化物的反应属于复分解反应,所以碱和非金属氧化物的反应也属于复分解反应
C.化合物是由不同种元素组成的纯净物,所以由同种元素组成的物质一定不是化合物
D.镁和稀硫酸反应能产生氢气,所以能和稀硫酸反应产生气体的物质一定是金属单质
二、非选择题
8.请回答下列问题。
(1)铜暴露在潮湿的空气中会生锈,即生成铜绿[Cu2(OH)2CO3],这是铜与O2、H2O、________(填化学式)反应的产物。
(2)废旧的铁锅、铝锅不要随意丢弃,应回收利用,这样做的意义是________。
(3)铸铁管容易生锈。工业上常用稀盐酸来除铁锈(Fe2O3),该反应的化学方程式是________。请你提出一种防止铁制品锈蚀的方法________。
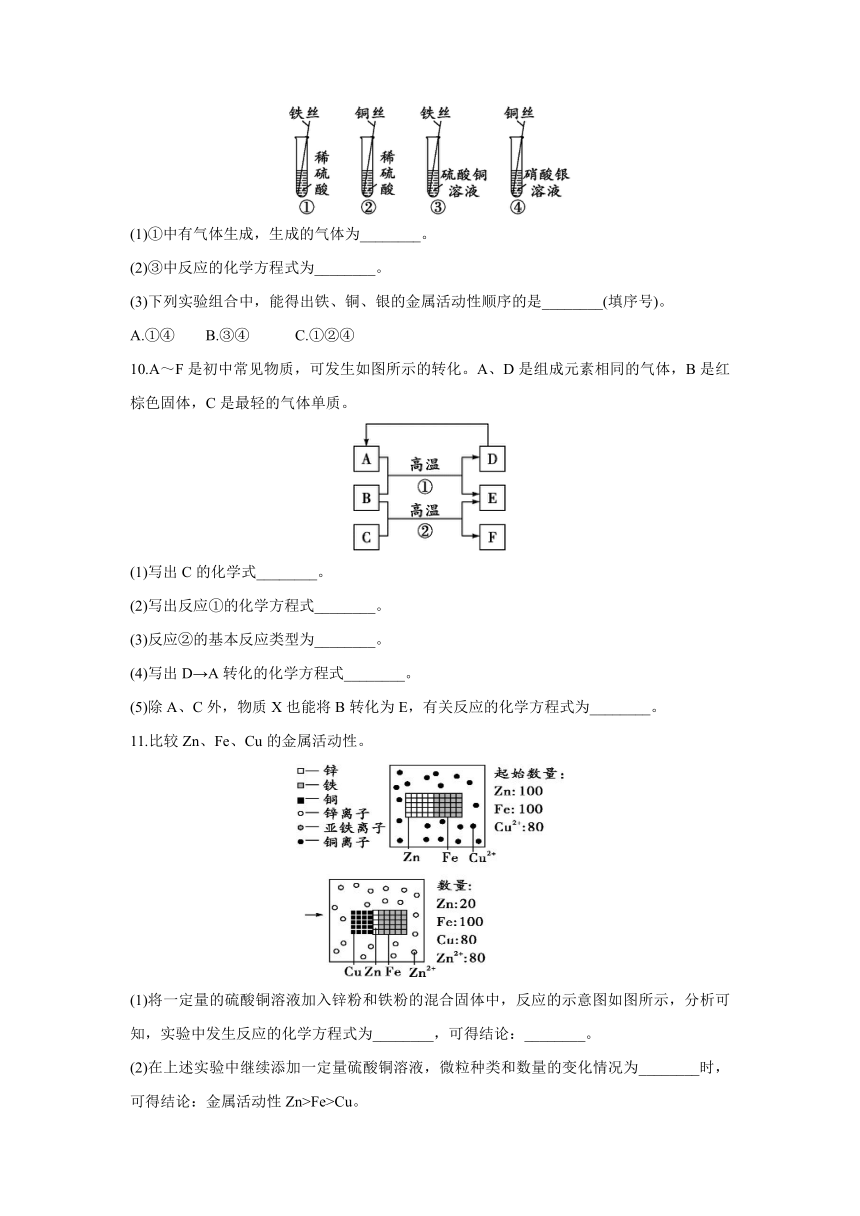
9.用下图所示实验研究金属的性质。
(1)①中有气体生成,生成的气体为________。
(2)③中反应的化学方程式为________。
(3)下列实验组合中,能得出铁、铜、银的金属活动性顺序的是________(填序号)。
A.①④ B.③④ C.①②④
10.A~F是初中常见物质,可发生如图所示的转化。A、D是组成元素相同的气体,B是红棕色固体,C是最轻的气体单质。
(1)写出C的化学式________。
(2)写出反应①的化学方程式________。
(3)反应②的基本反应类型为________。
(4)写出D→A转化的化学方程式________。
(5)除A、C外,物质X也能将B转化为E,有关反应的化学方程式为________。
11.比较Zn、Fe、Cu的金属活动性。
(1)将一定量的硫酸铜溶液加入锌粉和铁粉的混合固体中,反应的示意图如图所示,分析可知,实验中发生反应的化学方程式为________,可得结论:________。
(2)在上述实验中继续添加一定量硫酸铜溶液,微粒种类和数量的变化情况为________时,可得结论:金属活动性Zn>Fe>Cu。
12.某兴趣小组的同学们利用如图所示的装置对CO还原Fe2O3粉末的实验进行探究(固定装置略)。
【查阅资料】CO能溶于铜液[醋酸二氨合铜(Ⅰ)和氨水的混合液]
(1)按如图连接装置A~E,在装入试剂前,先________。
(2)写出装置B中反应的化学方程式________。
(3)通入CO2一段时间后,先点燃________处酒精喷灯(填“A”或“D”)。
(4)装置C中玻璃管的作用:________。
(5)反应一段时间后,能证明CO与 Fe2O3反应的实验现象:________、_________。写出装置D中反应的化学方程式________。
(6)某同学认为该装置有缺陷,需在装置E后再连接装置F,其目的是________。装置E、F的接口连接顺序:a连接________(填“b”或“c”)。
13.在探究金属与酸反应时,同学们将镁片、锌片打磨后分别投入到盛有等体积、等质量分数稀硫酸的试管中,观察到镁片与稀硫酸反应较锌片与稀硫酸反应剧烈。
【知识回顾】镁与稀硫酸反应的化学方程式为________。
【提出问题】金属与稀硫酸反应的快慢除与金属的活动性有关外,还受哪些因素的影响呢?
【猜想假设】a.可能与酸的浓度有关;b.可能与反应时的温度有关。
【设计并实验】小明用等质量(均取1 g)、形状和大小均相同的锌片和稀硫酸进行实验:
实验编号 温度/℃ 硫酸体积/mL 稀硫酸浓度 收集30 mL氢气所用的时间/s
① 20 20 10% 170
② 20 20 20% 88
③ 30 20 10% 134
④ 40 20 10% 107
【解释与结论】
(1)实验前需打磨锌片的目的是________。
(2)欲得出“其他条件相同时,硫酸的浓度越大,锌与硫酸反应的速率越快”,需要对比的是实验________(填序号)。
(3)通过对比实验①③④,可得出的结论是________。
【实验反思】
(4)该实验中能否用铜片替换锌片,并说明理由。
14.磁铁矿石(含Fe3O4)是常用的炼铁原料,工业上可通过如下反应:
4CO+Fe3O4=== (高温)3Fe+4CO2,将其中的Fe3O4转化为Fe。
(1)Fe3O4中铁元素和氧元素的质量比为________。
(2)假设冶炼过程中铁没有损耗,用含有 464吨Fe3O4的磁铁矿石可提炼出含铁质量分数为96%的生铁多少吨?
参考答案
1.A2.B3.A4.C5.D6.C7.C
8.(1)CO2 (2)防止污染环境,节约金属资源(合理即可) (3) Fe2O3+6HCl=2FeCl3+3H2O 在铁制品表面涂漆(合理即可)
9.(1)氢气(或H2) (2)Fe+CuSO4=FeSO4+Cu (3)BC
10.(1)H2 (2)Fe2O3+3CO=== (高温)2Fe+3CO2 (3)置换反应 (4)CO2+C=== (高温)2CO (5)3C+2Fe2O3=== (高温)4Fe+3CO2↑
11.(1)Zn+CuSO4=Cu+ZnSO4 金属活动性Zn>Cu、Zn>Fe (2)铁原子数目减少,铜原子数目增多(合理即可)
12.(1)检查装置气密性 (2)CO2+2NaOH=Na2CO3+H2O (3)A (4)平衡气压,防止倒吸 (5)D处红棕色固体变黑色 E处澄清石灰水变浑浊 Fe2O3+3CO=== (高温)2Fe+3CO2 (6)吸收尾气中的CO气体,防止其污染空气 c
13.【知识回顾】Mg+H2SO4=MgSO4+H2↑ 【解释与结论】(1)除去锌片表面的氧化物和污物 (2)①② (3)其他条件相同时,温度越高,锌与硫酸反应速率越快 【实验反思】(4)不能,铜的金属活动性排在氢之后,不能与稀硫酸发生反应
14.(1)21∶8 (2)350 t
一、选择题
1.2024年11月11日,三名航天员平安回家。合金舱体和酚醛树脂的新材料外层为返回舱安全返回保驾护航。对于相关材料说法不正确的是( )
A.舱体和外层均属于合成材料 B.外层材料能保温隔热
C.合金拓宽了金属材料的应用范围 D.外层材料可防止辐射
2.将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,能迅速比较出铁、铜金属活动性强弱的是( )
A.蒸馏水 B.稀硫酸 C.硫酸钠溶液 D.氢氧化钠溶液
3.用如图所示装置进行实验,倾斜Y形管,锌粒与硫酸铜溶液接触,表面有气泡产生并析出红色物质,溶液颜色变浅,经检测产生的气体为氢气。下列说法正确的是( )
A.锌粒参加的反应均为置换反应 B.硫酸铜溶液所含阳离子只有Cu2+
C.可推知金属活动性顺序:铜>锌 D.若用银片代替锌粒,可观察到相似实验现象
4.利用铁粉、炭粉、氯化钠进行铁的锈蚀实验(装置如下图所示,装置气密性良好)。实验1 min后温度计读数上升,8 min后打开止水夹,水倒吸入锥形瓶。实验数据如下表:
实验前的体积 实验后的体积
锥形瓶内空气(含导管内空气) 烧杯内水 烧杯内剩余水
246.0 mL 100.0 mL 51.5 mL
下列说法不合理的是 ( )
A.铁的锈蚀是放热反应 B.使用氯化钠溶液的目的是加快铁的锈蚀
C.此实验能推断出铁的锈蚀需要水的参与 D.计算得出空气中氧气的含量约为19.7%
5.据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,可替代黄金做精密电子元器件。下列对该铜纳米颗粒的判断,正确的是( )
A.能与盐酸反应产生氢气 B.在空气中容易锈蚀
C.能与硫酸镁发生置换反应 D.具有良好的导电性
6.某化学兴趣小组利用如下装置进行创新实验。向烧杯中加入约30 mL稀硫酸,5~7 s后将燃着的木条置于玻璃管口,观察到有火焰产生,一段时间后,观察到铜片由右向左逐渐变红,同时火焰明显变小。下列说法错误的是( )
A.玻璃管口产生的火焰为淡蓝色 B.该实验利用了铜的导热性
C.该实验中共发生了2个化学反应 D.火焰变小的原因可能是稀硫酸的浓度减小
7.推理是化学学习中常见的思维方法,下列推理正确的是( )
A.金属单质都能导电,所以能导电的物质一定是金属单质
B.酸和金属氧化物的反应属于复分解反应,所以碱和非金属氧化物的反应也属于复分解反应
C.化合物是由不同种元素组成的纯净物,所以由同种元素组成的物质一定不是化合物
D.镁和稀硫酸反应能产生氢气,所以能和稀硫酸反应产生气体的物质一定是金属单质
二、非选择题
8.请回答下列问题。
(1)铜暴露在潮湿的空气中会生锈,即生成铜绿[Cu2(OH)2CO3],这是铜与O2、H2O、________(填化学式)反应的产物。
(2)废旧的铁锅、铝锅不要随意丢弃,应回收利用,这样做的意义是________。
(3)铸铁管容易生锈。工业上常用稀盐酸来除铁锈(Fe2O3),该反应的化学方程式是________。请你提出一种防止铁制品锈蚀的方法________。
9.用下图所示实验研究金属的性质。
(1)①中有气体生成,生成的气体为________。
(2)③中反应的化学方程式为________。
(3)下列实验组合中,能得出铁、铜、银的金属活动性顺序的是________(填序号)。
A.①④ B.③④ C.①②④
10.A~F是初中常见物质,可发生如图所示的转化。A、D是组成元素相同的气体,B是红棕色固体,C是最轻的气体单质。
(1)写出C的化学式________。
(2)写出反应①的化学方程式________。
(3)反应②的基本反应类型为________。
(4)写出D→A转化的化学方程式________。
(5)除A、C外,物质X也能将B转化为E,有关反应的化学方程式为________。
11.比较Zn、Fe、Cu的金属活动性。
(1)将一定量的硫酸铜溶液加入锌粉和铁粉的混合固体中,反应的示意图如图所示,分析可知,实验中发生反应的化学方程式为________,可得结论:________。
(2)在上述实验中继续添加一定量硫酸铜溶液,微粒种类和数量的变化情况为________时,可得结论:金属活动性Zn>Fe>Cu。
12.某兴趣小组的同学们利用如图所示的装置对CO还原Fe2O3粉末的实验进行探究(固定装置略)。
【查阅资料】CO能溶于铜液[醋酸二氨合铜(Ⅰ)和氨水的混合液]
(1)按如图连接装置A~E,在装入试剂前,先________。
(2)写出装置B中反应的化学方程式________。
(3)通入CO2一段时间后,先点燃________处酒精喷灯(填“A”或“D”)。
(4)装置C中玻璃管的作用:________。
(5)反应一段时间后,能证明CO与 Fe2O3反应的实验现象:________、_________。写出装置D中反应的化学方程式________。
(6)某同学认为该装置有缺陷,需在装置E后再连接装置F,其目的是________。装置E、F的接口连接顺序:a连接________(填“b”或“c”)。
13.在探究金属与酸反应时,同学们将镁片、锌片打磨后分别投入到盛有等体积、等质量分数稀硫酸的试管中,观察到镁片与稀硫酸反应较锌片与稀硫酸反应剧烈。
【知识回顾】镁与稀硫酸反应的化学方程式为________。
【提出问题】金属与稀硫酸反应的快慢除与金属的活动性有关外,还受哪些因素的影响呢?
【猜想假设】a.可能与酸的浓度有关;b.可能与反应时的温度有关。
【设计并实验】小明用等质量(均取1 g)、形状和大小均相同的锌片和稀硫酸进行实验:
实验编号 温度/℃ 硫酸体积/mL 稀硫酸浓度 收集30 mL氢气所用的时间/s
① 20 20 10% 170
② 20 20 20% 88
③ 30 20 10% 134
④ 40 20 10% 107
【解释与结论】
(1)实验前需打磨锌片的目的是________。
(2)欲得出“其他条件相同时,硫酸的浓度越大,锌与硫酸反应的速率越快”,需要对比的是实验________(填序号)。
(3)通过对比实验①③④,可得出的结论是________。
【实验反思】
(4)该实验中能否用铜片替换锌片,并说明理由。
14.磁铁矿石(含Fe3O4)是常用的炼铁原料,工业上可通过如下反应:
4CO+Fe3O4=== (高温)3Fe+4CO2,将其中的Fe3O4转化为Fe。
(1)Fe3O4中铁元素和氧元素的质量比为________。
(2)假设冶炼过程中铁没有损耗,用含有 464吨Fe3O4的磁铁矿石可提炼出含铁质量分数为96%的生铁多少吨?
参考答案
1.A2.B3.A4.C5.D6.C7.C
8.(1)CO2 (2)防止污染环境,节约金属资源(合理即可) (3) Fe2O3+6HCl=2FeCl3+3H2O 在铁制品表面涂漆(合理即可)
9.(1)氢气(或H2) (2)Fe+CuSO4=FeSO4+Cu (3)BC
10.(1)H2 (2)Fe2O3+3CO=== (高温)2Fe+3CO2 (3)置换反应 (4)CO2+C=== (高温)2CO (5)3C+2Fe2O3=== (高温)4Fe+3CO2↑
11.(1)Zn+CuSO4=Cu+ZnSO4 金属活动性Zn>Cu、Zn>Fe (2)铁原子数目减少,铜原子数目增多(合理即可)
12.(1)检查装置气密性 (2)CO2+2NaOH=Na2CO3+H2O (3)A (4)平衡气压,防止倒吸 (5)D处红棕色固体变黑色 E处澄清石灰水变浑浊 Fe2O3+3CO=== (高温)2Fe+3CO2 (6)吸收尾气中的CO气体,防止其污染空气 c
13.【知识回顾】Mg+H2SO4=MgSO4+H2↑ 【解释与结论】(1)除去锌片表面的氧化物和污物 (2)①② (3)其他条件相同时,温度越高,锌与硫酸反应速率越快 【实验反思】(4)不能,铜的金属活动性排在氢之后,不能与稀硫酸发生反应
14.(1)21∶8 (2)350 t
同课章节目录
