8 金属和金属材料 专题训练(含答案) 2025年中考化学一轮专题复习(陕西)
文档属性
| 名称 | 8 金属和金属材料 专题训练(含答案) 2025年中考化学一轮专题复习(陕西) |  | |
| 格式 | docx | ||
| 文件大小 | 229.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-07 16:23:49 | ||
图片预览




文档简介
8 金属和金属材料
题号 一 二 三 四 总分 累分人
得分
注意事项:1.本试卷分为第一部分(选择题)和第二部分(非选择题)。总分60分。考试时间60分钟。
2.可能用到的相对原子质量:H-1 O-16 Al-27 Fe-56 Zn-65
试卷好题分析 中华优秀传统文化T5、T11、T12,最新科技T10、T11、T12
中考押题点分析 化学在实际生产、生活中的应用T2,新题型新考法T16
第一部分(选择题 共18分)
一、选择题(共9小题,每小题2分,计18分。每小题只有一个选项是符合题意的)
1.宇宙万物都是由元素组成的,其中地壳中含量最多的金属元素是 ( )
A.O B.Si C.Al D.Fe
2.为防止钢制船闸门被腐蚀,常在其表面连接比铁更活泼的金属块,这种金属可以是 ( )
A.银 B.铜 C.铅 D.锌
3.下列是小明一天中的生活经历和相关解释,其中错误的是 ( )
A.早上用不锈钢水壶在燃气灶上烧水,利用的是金属的导电性
B.下午体育课后喝了葡萄糖溶液,补充的糖类能为人体提供能量
C.傍晚将塑料矿泉水瓶放入带有可回收物标志的垃圾桶内,该塑料属于可回收的合成材料
D.晚饭后将洗净的铁锅擦干,是为了防止铁锅生锈
4.下列各组试剂中不能验证铁、铜、银三种金属活动性强弱顺序的是 ( )
A.CuSO4溶液、Fe、Ag B.FeSO4溶液、稀硫酸、Cu、Ag
C.AgNO3溶液、稀硫酸、Fe、Cu D.AgNO3溶液、FeSO4溶液、Cu
5.中华传统文化中包含很多化学知识。下列对文献内容解释错误的是 ( )
A.《梦溪笔谈》描述石油:“燃之如麻,但烟甚浓”——石油的不完全燃烧
B.《天工开物》:“每金七厘,造方寸金一千片”——金的延展性强
C.《梅花》:“遥知不是雪,为有暗香来”——分子在不断地运动
D.《吕氏春秋》:“金(指铜)柔锡柔,合两柔则刚”——铜锡合金的硬度比铜、锡的小
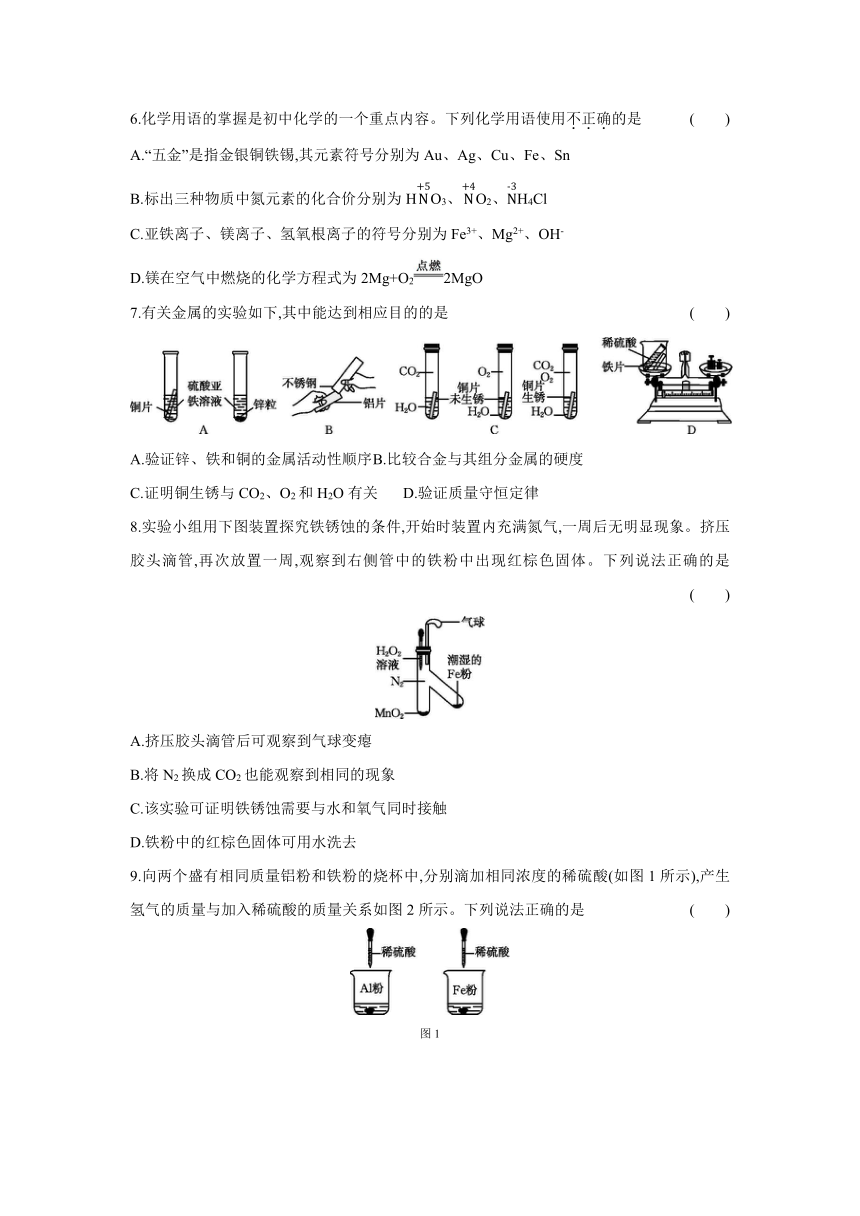
6.化学用语的掌握是初中化学的一个重点内容。下列化学用语使用不正确的是 ( )
A.“五金”是指金银铜铁锡,其元素符号分别为Au、Ag、Cu、Fe、Sn
B.标出三种物质中氮元素的化合价分别为HO3、O2、H4Cl
C.亚铁离子、镁离子、氢氧根离子的符号分别为Fe3+、Mg2+、OH-
D.镁在空气中燃烧的化学方程式为2Mg+O22MgO
7.有关金属的实验如下,其中能达到相应目的的是 ( )
A.验证锌、铁和铜的金属活动性顺序 B.比较合金与其组分金属的硬度
C.证明铜生锈与CO2、O2和H2O有关 D.验证质量守恒定律
8.实验小组用下图装置探究铁锈蚀的条件,开始时装置内充满氮气,一周后无明显现象。挤压胶头滴管,再次放置一周,观察到右侧管中的铁粉中出现红棕色固体。下列说法正确的是 ( )
A.挤压胶头滴管后可观察到气球变瘪
B.将N2换成CO2也能观察到相同的现象
C.该实验可证明铁锈蚀需要与水和氧气同时接触
D.铁粉中的红棕色固体可用水洗去
9.向两个盛有相同质量铝粉和铁粉的烧杯中,分别滴加相同浓度的稀硫酸(如图1所示),产生氢气的质量与加入稀硫酸的质量关系如图2所示。下列说法正确的是 ( )
图1
图2
A.a点时,两个烧杯中的酸都恰好完全反应 B.b点时,两个烧杯中产生氢气的质量相同
C.c点时,两个烧杯中剩余金属的质量相等 D.图中曲线不能反映铁和铝的金属活动性强弱
第二部分(非选择题 共42分)
二、填空及简答题(共6小题,计24分)
10.(3分)时空交织的诗篇与现代科技交响,西安分会场的《山河诗长安》闪耀2024龙年春晚。
(1)星河轮转,时光千载,“李白”佩戴青铜剑入长安。青铜属于 (选填“合成”或“金属”)材料。
(2)众人齐诵《将进酒》的场面,更是将气氛烘托到极致。酒精度为52%(体积分数)的白酒中溶质是 。
(3)利用VR(虚拟现实)等技术实现了真人与动画人物李白的互动视觉。生产VR设备的材料之一是硅,工业制取高纯硅的部分反应的微观示意图如图所示。下列说法不正确的是 (填字母)。
A.硅的原子结构示意图为 B.该反应前后原子数目不变
C.参加反应的甲、乙的分子个数比为1∶1 D.该反应属于置换反应
11.(4分)金属材料在人类文明的发展中起着重要作用。
(1)战国《韩非子·内储说上》提到,早期采金技术均是“沙里淘金”。金在自然界中主要以 (选填“单质”或“化合物”)的形式存在。
(2)我国在西汉初期就掌握了炼铁技术,领先西方国家1 000多年。工业上常用一氧化碳还原赤铁矿(主要成分为氧化铁)冶炼生铁,写出该反应的化学方程式: 。
(3)明代《天工开物》中提到“点铅勾锡”是炼锡的关键一步,即加铅能使锡较易熔化流出,原因是 。
12.(3分)从古至今,金属材料在人类文明的发展中起着重要作用。
(1)北宋沈括所著的《梦溪笔谈》中记载了“湿法炼铜”的方法:“熬胆矾铁釜,久之亦化为铜”。即在硫酸铜溶液中加入铁,则可得到铜。该反应的化学方程式是 。
(2)某化学兴趣小组的同学探究锌、铜、铁三种金属的有关性质(如下图),实验结束后将①②试管内的物质倒入烧杯中,发现烧杯中的红色固体物质明显增多,一段时间后过滤,同学们向滤渣中滴加稀盐酸,发现没有气泡产生,那么滤液中可能含有的溶质是 。
13.(5分)铁红(Fe2O3)可用于油漆、油墨、橡胶、玻璃、宝石、金属的抛光剂等。以废铁(主要成分为Fe、Fe2O3)为原料制备氧化铁的工艺流程如图所示:
(1)“酸浸”过程中观察到的明显现象是 。
(2)“氧化”过程发生反应的化学方程式为4FeCl2+4HCl+X4FeCl3+2H2O,X的化学式为 。
(3)“沉铁”流程得到氢氧化铁沉淀,该反应的化学方程式是 。
(4)“煅烧”得到的另一种氧化物的化学式为 。
14.(4分)老师在课上演示了两个趣味实验。
(1)“火焰分割”。先将加热至红热的铁丝网a平伸到火焰上部,如图甲所示;再将常温的铁丝网b平伸到火焰下部,两张铁丝网中间的火焰熄灭,如图乙所示。
①铁块能拉成铁丝是利用了铁的 性。
②“两张铁丝网中间的火焰熄灭”的主要原因是铁丝网b吸收热量, (填字母)。
A.使酒精的着火点降低
B.使温度降低到酒精的着火点以下
(2)“铁花飞溅”。将铁粉抖撒到酒精灯火焰上方,铁粉剧烈燃烧,火星四射,宛如美丽的“铁花”。铁燃烧生成四氧化三铁的化学方程式为 。
15.(5分)A~F是初中化学常见的物质,其中A是红棕色固体,B是金属单质,C溶液是黄色溶液,D溶液是浅绿色溶液,E是红褐色沉淀,它们之间有如下转化关系。查阅资料可知:反应③是物质F与氧气、水发生的化合反应,生成物质E。
(1)写出A的化学式: 。
(2)反应②的实验现象是 。
(3)试剂X可以是 ,写出反应①的化学方程式: 。
三、实验及探究题(共2小题,计13分)
16.(6分)铁制品经常会出现锈蚀现象,某兴趣小组围绕“锈”进行下列一系列实验。
(1)现有洁净无锈的铁钉、经煮沸并迅速冷却的蒸馏水、植物油、棉花和干燥剂氯化钙,还可以选用其他物品。为探究铁制品锈蚀的条件,某兴趣小组的同学设计如下实验:
①将铁钉放入试管中需要用到的仪器的名称是 。
②一周后,观察A、B、C中的铁钉,只有A中的铁钉出现了明显锈蚀现象,由此得出铁钉锈蚀需要与 接触的结论。
(2)取出生锈的铁钉,将其放置在稀盐酸中,一段时间后发现溶液变黄,铁钉表面有少量气泡产生。产生气泡的原因是 (用化学方程式表示)。据此可知,稀盐酸可用于除锈,但应注意 。
(3)防止铁制品锈蚀,可以破坏其锈蚀的条件,常用的防锈方法有 (写一种)。
17.(7分)为探究酸的化学性质,某化学小组利用稀盐酸进行了如下实验操作:
(1)A中的实验现象是 。
(2)C中反应的化学方程式是 。
(3)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。
同学们对滤液中溶质的成分进行如下探究:
【提出问题】滤液中溶质的成分是什么
【作出猜想】
猜想一:NaCl
猜想二:NaCl和CaCl2
猜想三:NaCl、HCl和CaCl2
猜想四:NaCl和Na2CO3
【查阅资料】NaCl溶液、CaCl2溶液均呈中性。
【进行讨论】经过讨论,同学们一致认为猜想 是错误的。
【设计实验】请完成实验报告。
实验步骤 实验现象 实验结论
取少量滤液于试管中,滴加适量的碳酸钠溶液 猜想二不成立
取少量滤液于试管中,滴加 产生白色沉淀 猜想四成立
【反思拓展】该小组同学根据猜想中涉及物质的化学性质,还设计了如下的方案验证猜想四正确,其中不合理的是 (填字母)。
A.测定滤液的pH B.向滤液中滴加足量稀盐酸
C.向滤液中滴加KOH溶液 D.向滤液中滴加AgNO3溶液
四、计算与分析题(5分)
18.(5分)某化学兴趣小组的同学为检测黄铜(铜锌合金)的成分,进行了下图所示的实验。
请完成下列分析及计算:
(1)生成氢气的质量为 g。
(2)黄铜与黄金在外观上非常相似,请用一种方法对二者进行区分: 。
(3)该黄铜中铜的质量分数是多少
参考答案
1.C 2.D 3.A 4.B 5.D 6.C
7.A 【解析】A.将铜片和锌粒分别放入硫酸亚铁溶液中,Zn与硫酸亚铁溶液反应置换出铁,说明金属活动性:Zn>Fe;铜片与硫酸亚铁溶液不反应,说明金属活动性:Fe>Cu;由此可得出三种金属的活动性:Zn>Fe>Cu,故选项能达到相应目的。B.不锈钢的组成中不含铝,图中实验不能用于比较合金与其组分金属的硬度,故选项不能达到相应目的。C.第一支试管中的铜片能与二氧化碳、水充分接触,第二支试管中的铜片能与氧气、水充分接触,第三支试管中的铜片能与二氧化碳、氧气、水接触;一段时间后,前两支试管中的铜片没有生锈,第三支试管中的铜片生锈,可用于探究铜生锈与二氧化碳、氧气有关,无法证明是否与水有关,故选项不能达到相应目的。D.铁和稀硫酸反应生成硫酸亚铁和氢气,反应过程中氢气逸出,反应后烧杯中的物质质量减小,不能直接用于验证质量守恒定律,故选项不能达到相应目的。
8.B
9.D 【解析】A.a点时,左边烧杯中的酸恰好完全反应,右边烧杯中的酸过量,该选项说法不正确;B.b点时,两个烧杯中产生氢气的质量不相等,左边烧杯中产生的氢气较多,该选项说法不正确;C.c点时,两个烧杯中都有金属剩余,但由于生成相等的氢气所消耗的金属质量不相等,因此剩余金属的质量也不相等,该选项说法错误;D.图中曲线不能反映铁和铝的金属活动性强弱,该选项说法正确。
10.(3分)(1)金属
(2)酒精
(3)C
11.(4分)(1)单质
(2)Fe2O3+3CO2Fe+3CO2(2分)
(3)形成合金,使熔点降低
12.(3分)(1)Fe+CuSO4Cu+FeSO4(2分)
(2)硫酸铜(或CuSO4)
13.(5分)(1)有气泡产生
(2)O2
(3)3NaOH+FeCl3Fe(OH)3↓+3NaCl(2分)
(4)H2O
【解析】(1)“酸浸”中稀盐酸与铁、氧化铁反应,铁与稀盐酸反应生成氢气,观察到的明显现象是有气泡产生。
(2)在反应4FeCl2+4HCl+X4FeCl3+2H2O中,反应前有4个铁原子、12个氯原子、4个氢原子,反应后有4个铁原子、12个氯原子、4个氢原子、2个氧原子,故X中含有2个氧原子,X的化学式为O2。
(3)“沉铁”过程中氢氧化钠与氯化铁反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式是3NaOH+FeCl3Fe(OH)3↓+3NaCl。
(4)“煅烧”过程中氢氧化铁分解生成氧化铁和水,故“煅烧”得到的另一种氧化物的化学式为H2O。
14.(4分)(1)延展 B
(2)3Fe+2O2Fe3O4(2分)
15.(5分)(1)Fe2O3
(2)有气泡产生,溶液由无色逐渐变成浅绿色
(3)NaOH溶液(合理即可) FeCl3+3NaOHFe(OH)3↓+3NaCl(合理即可)(2分)
【解析】A是红棕色固体,则A是氧化铁;氧化铁能转化成B,B是金属单质,则B是铁;氧化铁和稀盐酸反应生成C,C溶液是黄色溶液,则C是氯化铁;铁和稀盐酸反应生成D,D溶液是浅绿色溶液,则D是氯化亚铁;氯化铁和试剂X反应生成沉淀E,E是红褐色沉淀,氯化亚铁和试剂X反应生成沉淀F,则试剂X可以是氢氧化钠溶液。
(1)由分析可知,A是氧化铁,化学式为Fe2O3。
(2)反应②是铁和稀盐酸反应生成氯化亚铁和氢气,实验现象是有气泡产生,溶液由无色逐渐变成浅绿色。
(3)反应①可以是氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式为FeCl3+3NaOHFe(OH)3↓+3NaCl。
16.(6分)(1)①镊子 ②氧气和水
(2)Fe+2HClFeCl2+H2↑(2分) 铁制品不可长时间浸泡在其中
(3)表面刷漆、涂油等(合理即可)
17.(7分)(1)紫色石蕊溶液变红
(2)Fe2O3+6HCl2FeCl3+3H2O(2分)
(3)【进行讨论】三
【设计实验】无明显现象 氯化钡溶液(或BaCl2溶液,合理即可)
【反思拓展】CD
【解析】(1)盐酸显酸性,能使紫色石蕊溶液变红,则A中的实验现象是紫色石蕊溶液变红。
(2)C中氧化铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为Fe2O3+6HCl2FeCl3+3H2O。
(3)【进行讨论】将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现,将烧杯中的混合物过滤,得到白色沉淀和无色滤液,白色沉淀是碳酸钙,因为碳酸钙能与盐酸反应生成氯化钙、二氧化碳和水,所以无色滤液中一定不含HCl,故猜想三不正确。
【设计实验】碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,猜想二不成立,则取少量滤液于试管中,滴加适量的碳酸钠溶液,观察到无明显现象。猜想四成立,说明滤液中溶质的成分是NaCl和Na2CO3,碳酸钠和氯化钡溶液反应生成碳酸钡沉淀,实验现象是产生白色沉淀,则取少量滤液于试管中,滴加氯化钡溶液。
【反思拓展】验证猜想四正确,就是要验证碳酸钠的存在。A.氯化钠溶液呈中性,而碳酸钠溶液呈碱性,则可测定滤液的pH,若pH>7,则有碳酸钠,方案合理,故不符合题意;B.碳酸钠能与稀盐酸反应生成二氧化碳,向滤液中滴加足量稀盐酸,若有气泡产生,则有碳酸钠,方案合理,故不符合题意;C.碳酸钠不与KOH溶液反应,无法证明碳酸钠的存在,方案不合理,故符合题意;D.氯化钠和碳酸钠均能与AgNO3溶液反应生成白色沉淀,无法证明碳酸钠的存在,方案不合理,故符合题意。
18.(5分)(1)0.2(1分)
(2)取样,加盐酸(或取样,灼烧)(1分)
(3)解:设20 g黄铜中锌的质量为x。
Zn+H2SO4ZnSO4+H2↑(1分)
65 2
x 0.2 g
=
x=6.5 g(1分)
该黄铜中铜的质量分数为×100%=67.5%(1分)
答:该黄铜中铜的质量分数为67.5%。
题号 一 二 三 四 总分 累分人
得分
注意事项:1.本试卷分为第一部分(选择题)和第二部分(非选择题)。总分60分。考试时间60分钟。
2.可能用到的相对原子质量:H-1 O-16 Al-27 Fe-56 Zn-65
试卷好题分析 中华优秀传统文化T5、T11、T12,最新科技T10、T11、T12
中考押题点分析 化学在实际生产、生活中的应用T2,新题型新考法T16
第一部分(选择题 共18分)
一、选择题(共9小题,每小题2分,计18分。每小题只有一个选项是符合题意的)
1.宇宙万物都是由元素组成的,其中地壳中含量最多的金属元素是 ( )
A.O B.Si C.Al D.Fe
2.为防止钢制船闸门被腐蚀,常在其表面连接比铁更活泼的金属块,这种金属可以是 ( )
A.银 B.铜 C.铅 D.锌
3.下列是小明一天中的生活经历和相关解释,其中错误的是 ( )
A.早上用不锈钢水壶在燃气灶上烧水,利用的是金属的导电性
B.下午体育课后喝了葡萄糖溶液,补充的糖类能为人体提供能量
C.傍晚将塑料矿泉水瓶放入带有可回收物标志的垃圾桶内,该塑料属于可回收的合成材料
D.晚饭后将洗净的铁锅擦干,是为了防止铁锅生锈
4.下列各组试剂中不能验证铁、铜、银三种金属活动性强弱顺序的是 ( )
A.CuSO4溶液、Fe、Ag B.FeSO4溶液、稀硫酸、Cu、Ag
C.AgNO3溶液、稀硫酸、Fe、Cu D.AgNO3溶液、FeSO4溶液、Cu
5.中华传统文化中包含很多化学知识。下列对文献内容解释错误的是 ( )
A.《梦溪笔谈》描述石油:“燃之如麻,但烟甚浓”——石油的不完全燃烧
B.《天工开物》:“每金七厘,造方寸金一千片”——金的延展性强
C.《梅花》:“遥知不是雪,为有暗香来”——分子在不断地运动
D.《吕氏春秋》:“金(指铜)柔锡柔,合两柔则刚”——铜锡合金的硬度比铜、锡的小
6.化学用语的掌握是初中化学的一个重点内容。下列化学用语使用不正确的是 ( )
A.“五金”是指金银铜铁锡,其元素符号分别为Au、Ag、Cu、Fe、Sn
B.标出三种物质中氮元素的化合价分别为HO3、O2、H4Cl
C.亚铁离子、镁离子、氢氧根离子的符号分别为Fe3+、Mg2+、OH-
D.镁在空气中燃烧的化学方程式为2Mg+O22MgO
7.有关金属的实验如下,其中能达到相应目的的是 ( )
A.验证锌、铁和铜的金属活动性顺序 B.比较合金与其组分金属的硬度
C.证明铜生锈与CO2、O2和H2O有关 D.验证质量守恒定律
8.实验小组用下图装置探究铁锈蚀的条件,开始时装置内充满氮气,一周后无明显现象。挤压胶头滴管,再次放置一周,观察到右侧管中的铁粉中出现红棕色固体。下列说法正确的是 ( )
A.挤压胶头滴管后可观察到气球变瘪
B.将N2换成CO2也能观察到相同的现象
C.该实验可证明铁锈蚀需要与水和氧气同时接触
D.铁粉中的红棕色固体可用水洗去
9.向两个盛有相同质量铝粉和铁粉的烧杯中,分别滴加相同浓度的稀硫酸(如图1所示),产生氢气的质量与加入稀硫酸的质量关系如图2所示。下列说法正确的是 ( )
图1
图2
A.a点时,两个烧杯中的酸都恰好完全反应 B.b点时,两个烧杯中产生氢气的质量相同
C.c点时,两个烧杯中剩余金属的质量相等 D.图中曲线不能反映铁和铝的金属活动性强弱
第二部分(非选择题 共42分)
二、填空及简答题(共6小题,计24分)
10.(3分)时空交织的诗篇与现代科技交响,西安分会场的《山河诗长安》闪耀2024龙年春晚。
(1)星河轮转,时光千载,“李白”佩戴青铜剑入长安。青铜属于 (选填“合成”或“金属”)材料。
(2)众人齐诵《将进酒》的场面,更是将气氛烘托到极致。酒精度为52%(体积分数)的白酒中溶质是 。
(3)利用VR(虚拟现实)等技术实现了真人与动画人物李白的互动视觉。生产VR设备的材料之一是硅,工业制取高纯硅的部分反应的微观示意图如图所示。下列说法不正确的是 (填字母)。
A.硅的原子结构示意图为 B.该反应前后原子数目不变
C.参加反应的甲、乙的分子个数比为1∶1 D.该反应属于置换反应
11.(4分)金属材料在人类文明的发展中起着重要作用。
(1)战国《韩非子·内储说上》提到,早期采金技术均是“沙里淘金”。金在自然界中主要以 (选填“单质”或“化合物”)的形式存在。
(2)我国在西汉初期就掌握了炼铁技术,领先西方国家1 000多年。工业上常用一氧化碳还原赤铁矿(主要成分为氧化铁)冶炼生铁,写出该反应的化学方程式: 。
(3)明代《天工开物》中提到“点铅勾锡”是炼锡的关键一步,即加铅能使锡较易熔化流出,原因是 。
12.(3分)从古至今,金属材料在人类文明的发展中起着重要作用。
(1)北宋沈括所著的《梦溪笔谈》中记载了“湿法炼铜”的方法:“熬胆矾铁釜,久之亦化为铜”。即在硫酸铜溶液中加入铁,则可得到铜。该反应的化学方程式是 。
(2)某化学兴趣小组的同学探究锌、铜、铁三种金属的有关性质(如下图),实验结束后将①②试管内的物质倒入烧杯中,发现烧杯中的红色固体物质明显增多,一段时间后过滤,同学们向滤渣中滴加稀盐酸,发现没有气泡产生,那么滤液中可能含有的溶质是 。
13.(5分)铁红(Fe2O3)可用于油漆、油墨、橡胶、玻璃、宝石、金属的抛光剂等。以废铁(主要成分为Fe、Fe2O3)为原料制备氧化铁的工艺流程如图所示:
(1)“酸浸”过程中观察到的明显现象是 。
(2)“氧化”过程发生反应的化学方程式为4FeCl2+4HCl+X4FeCl3+2H2O,X的化学式为 。
(3)“沉铁”流程得到氢氧化铁沉淀,该反应的化学方程式是 。
(4)“煅烧”得到的另一种氧化物的化学式为 。
14.(4分)老师在课上演示了两个趣味实验。
(1)“火焰分割”。先将加热至红热的铁丝网a平伸到火焰上部,如图甲所示;再将常温的铁丝网b平伸到火焰下部,两张铁丝网中间的火焰熄灭,如图乙所示。
①铁块能拉成铁丝是利用了铁的 性。
②“两张铁丝网中间的火焰熄灭”的主要原因是铁丝网b吸收热量, (填字母)。
A.使酒精的着火点降低
B.使温度降低到酒精的着火点以下
(2)“铁花飞溅”。将铁粉抖撒到酒精灯火焰上方,铁粉剧烈燃烧,火星四射,宛如美丽的“铁花”。铁燃烧生成四氧化三铁的化学方程式为 。
15.(5分)A~F是初中化学常见的物质,其中A是红棕色固体,B是金属单质,C溶液是黄色溶液,D溶液是浅绿色溶液,E是红褐色沉淀,它们之间有如下转化关系。查阅资料可知:反应③是物质F与氧气、水发生的化合反应,生成物质E。
(1)写出A的化学式: 。
(2)反应②的实验现象是 。
(3)试剂X可以是 ,写出反应①的化学方程式: 。
三、实验及探究题(共2小题,计13分)
16.(6分)铁制品经常会出现锈蚀现象,某兴趣小组围绕“锈”进行下列一系列实验。
(1)现有洁净无锈的铁钉、经煮沸并迅速冷却的蒸馏水、植物油、棉花和干燥剂氯化钙,还可以选用其他物品。为探究铁制品锈蚀的条件,某兴趣小组的同学设计如下实验:
①将铁钉放入试管中需要用到的仪器的名称是 。
②一周后,观察A、B、C中的铁钉,只有A中的铁钉出现了明显锈蚀现象,由此得出铁钉锈蚀需要与 接触的结论。
(2)取出生锈的铁钉,将其放置在稀盐酸中,一段时间后发现溶液变黄,铁钉表面有少量气泡产生。产生气泡的原因是 (用化学方程式表示)。据此可知,稀盐酸可用于除锈,但应注意 。
(3)防止铁制品锈蚀,可以破坏其锈蚀的条件,常用的防锈方法有 (写一种)。
17.(7分)为探究酸的化学性质,某化学小组利用稀盐酸进行了如下实验操作:
(1)A中的实验现象是 。
(2)C中反应的化学方程式是 。
(3)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。
同学们对滤液中溶质的成分进行如下探究:
【提出问题】滤液中溶质的成分是什么
【作出猜想】
猜想一:NaCl
猜想二:NaCl和CaCl2
猜想三:NaCl、HCl和CaCl2
猜想四:NaCl和Na2CO3
【查阅资料】NaCl溶液、CaCl2溶液均呈中性。
【进行讨论】经过讨论,同学们一致认为猜想 是错误的。
【设计实验】请完成实验报告。
实验步骤 实验现象 实验结论
取少量滤液于试管中,滴加适量的碳酸钠溶液 猜想二不成立
取少量滤液于试管中,滴加 产生白色沉淀 猜想四成立
【反思拓展】该小组同学根据猜想中涉及物质的化学性质,还设计了如下的方案验证猜想四正确,其中不合理的是 (填字母)。
A.测定滤液的pH B.向滤液中滴加足量稀盐酸
C.向滤液中滴加KOH溶液 D.向滤液中滴加AgNO3溶液
四、计算与分析题(5分)
18.(5分)某化学兴趣小组的同学为检测黄铜(铜锌合金)的成分,进行了下图所示的实验。
请完成下列分析及计算:
(1)生成氢气的质量为 g。
(2)黄铜与黄金在外观上非常相似,请用一种方法对二者进行区分: 。
(3)该黄铜中铜的质量分数是多少
参考答案
1.C 2.D 3.A 4.B 5.D 6.C
7.A 【解析】A.将铜片和锌粒分别放入硫酸亚铁溶液中,Zn与硫酸亚铁溶液反应置换出铁,说明金属活动性:Zn>Fe;铜片与硫酸亚铁溶液不反应,说明金属活动性:Fe>Cu;由此可得出三种金属的活动性:Zn>Fe>Cu,故选项能达到相应目的。B.不锈钢的组成中不含铝,图中实验不能用于比较合金与其组分金属的硬度,故选项不能达到相应目的。C.第一支试管中的铜片能与二氧化碳、水充分接触,第二支试管中的铜片能与氧气、水充分接触,第三支试管中的铜片能与二氧化碳、氧气、水接触;一段时间后,前两支试管中的铜片没有生锈,第三支试管中的铜片生锈,可用于探究铜生锈与二氧化碳、氧气有关,无法证明是否与水有关,故选项不能达到相应目的。D.铁和稀硫酸反应生成硫酸亚铁和氢气,反应过程中氢气逸出,反应后烧杯中的物质质量减小,不能直接用于验证质量守恒定律,故选项不能达到相应目的。
8.B
9.D 【解析】A.a点时,左边烧杯中的酸恰好完全反应,右边烧杯中的酸过量,该选项说法不正确;B.b点时,两个烧杯中产生氢气的质量不相等,左边烧杯中产生的氢气较多,该选项说法不正确;C.c点时,两个烧杯中都有金属剩余,但由于生成相等的氢气所消耗的金属质量不相等,因此剩余金属的质量也不相等,该选项说法错误;D.图中曲线不能反映铁和铝的金属活动性强弱,该选项说法正确。
10.(3分)(1)金属
(2)酒精
(3)C
11.(4分)(1)单质
(2)Fe2O3+3CO2Fe+3CO2(2分)
(3)形成合金,使熔点降低
12.(3分)(1)Fe+CuSO4Cu+FeSO4(2分)
(2)硫酸铜(或CuSO4)
13.(5分)(1)有气泡产生
(2)O2
(3)3NaOH+FeCl3Fe(OH)3↓+3NaCl(2分)
(4)H2O
【解析】(1)“酸浸”中稀盐酸与铁、氧化铁反应,铁与稀盐酸反应生成氢气,观察到的明显现象是有气泡产生。
(2)在反应4FeCl2+4HCl+X4FeCl3+2H2O中,反应前有4个铁原子、12个氯原子、4个氢原子,反应后有4个铁原子、12个氯原子、4个氢原子、2个氧原子,故X中含有2个氧原子,X的化学式为O2。
(3)“沉铁”过程中氢氧化钠与氯化铁反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式是3NaOH+FeCl3Fe(OH)3↓+3NaCl。
(4)“煅烧”过程中氢氧化铁分解生成氧化铁和水,故“煅烧”得到的另一种氧化物的化学式为H2O。
14.(4分)(1)延展 B
(2)3Fe+2O2Fe3O4(2分)
15.(5分)(1)Fe2O3
(2)有气泡产生,溶液由无色逐渐变成浅绿色
(3)NaOH溶液(合理即可) FeCl3+3NaOHFe(OH)3↓+3NaCl(合理即可)(2分)
【解析】A是红棕色固体,则A是氧化铁;氧化铁能转化成B,B是金属单质,则B是铁;氧化铁和稀盐酸反应生成C,C溶液是黄色溶液,则C是氯化铁;铁和稀盐酸反应生成D,D溶液是浅绿色溶液,则D是氯化亚铁;氯化铁和试剂X反应生成沉淀E,E是红褐色沉淀,氯化亚铁和试剂X反应生成沉淀F,则试剂X可以是氢氧化钠溶液。
(1)由分析可知,A是氧化铁,化学式为Fe2O3。
(2)反应②是铁和稀盐酸反应生成氯化亚铁和氢气,实验现象是有气泡产生,溶液由无色逐渐变成浅绿色。
(3)反应①可以是氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式为FeCl3+3NaOHFe(OH)3↓+3NaCl。
16.(6分)(1)①镊子 ②氧气和水
(2)Fe+2HClFeCl2+H2↑(2分) 铁制品不可长时间浸泡在其中
(3)表面刷漆、涂油等(合理即可)
17.(7分)(1)紫色石蕊溶液变红
(2)Fe2O3+6HCl2FeCl3+3H2O(2分)
(3)【进行讨论】三
【设计实验】无明显现象 氯化钡溶液(或BaCl2溶液,合理即可)
【反思拓展】CD
【解析】(1)盐酸显酸性,能使紫色石蕊溶液变红,则A中的实验现象是紫色石蕊溶液变红。
(2)C中氧化铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为Fe2O3+6HCl2FeCl3+3H2O。
(3)【进行讨论】将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现,将烧杯中的混合物过滤,得到白色沉淀和无色滤液,白色沉淀是碳酸钙,因为碳酸钙能与盐酸反应生成氯化钙、二氧化碳和水,所以无色滤液中一定不含HCl,故猜想三不正确。
【设计实验】碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,猜想二不成立,则取少量滤液于试管中,滴加适量的碳酸钠溶液,观察到无明显现象。猜想四成立,说明滤液中溶质的成分是NaCl和Na2CO3,碳酸钠和氯化钡溶液反应生成碳酸钡沉淀,实验现象是产生白色沉淀,则取少量滤液于试管中,滴加氯化钡溶液。
【反思拓展】验证猜想四正确,就是要验证碳酸钠的存在。A.氯化钠溶液呈中性,而碳酸钠溶液呈碱性,则可测定滤液的pH,若pH>7,则有碳酸钠,方案合理,故不符合题意;B.碳酸钠能与稀盐酸反应生成二氧化碳,向滤液中滴加足量稀盐酸,若有气泡产生,则有碳酸钠,方案合理,故不符合题意;C.碳酸钠不与KOH溶液反应,无法证明碳酸钠的存在,方案不合理,故符合题意;D.氯化钠和碳酸钠均能与AgNO3溶液反应生成白色沉淀,无法证明碳酸钠的存在,方案不合理,故符合题意。
18.(5分)(1)0.2(1分)
(2)取样,加盐酸(或取样,灼烧)(1分)
(3)解:设20 g黄铜中锌的质量为x。
Zn+H2SO4ZnSO4+H2↑(1分)
65 2
x 0.2 g
=
x=6.5 g(1分)
该黄铜中铜的质量分数为×100%=67.5%(1分)
答:该黄铜中铜的质量分数为67.5%。
同课章节目录
