1.1.1原子结构与元素性质(教学课件)(共31张PPT)_高中化学鲁科版必修二(2019)
文档属性
| 名称 | 1.1.1原子结构与元素性质(教学课件)(共31张PPT)_高中化学鲁科版必修二(2019) |

|
|
| 格式 | pptx | ||
| 文件大小 | 13.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-07 21:43:05 | ||
图片预览








文档简介
(共31张PPT)
第一章 原子结构元素周期律
第一节 原子结构与元素性质
1.1.1 原子核 核素
核心素养目标
宏观辨识与微观探析:
学生能从宏观上认识元素的种类,从微观角度理解原子的构成、核素和同位素的差异,建立起宏观元素与微观原子、核素之间的联系,能运用微观知识解释宏观元素的多样性和相关性质,形成 “结构决定性质” 的观念。
证据推理与模型认知:
通过对原子结构、核素、同位素等知识的学习,依据实验数据和科学理论进行推理,理解质量数、质子数、中子数等概念之间的逻辑关系,构建原子结构模型、元素相对原子质量计算模型等,提升运用模型解决实际化学问题的能力
重点
理解原子符号 中各字母含义,掌握质子、中子、电子、质量数之间的关系;
核素、同位素的概念理解,能准确判断不同原子是否为核素、是否互为同位素;
元素相对原子质量的计算方法,能根据核素相对原子质量和丰度计算元素相对原子质量
难点
对核素和同位素概念的深入理解及区分,特别是同位素化学性质几乎相同但物理性质不同的原因;复杂离子(阳离子、阴离子)中质子数、中子数、电子数之间关系的计算和应用;理解元素相对原子质量与核素相对原子质量、丰度之间的内在联系,以及近似相对原子质量的概念和计算
课前导入
课前导入
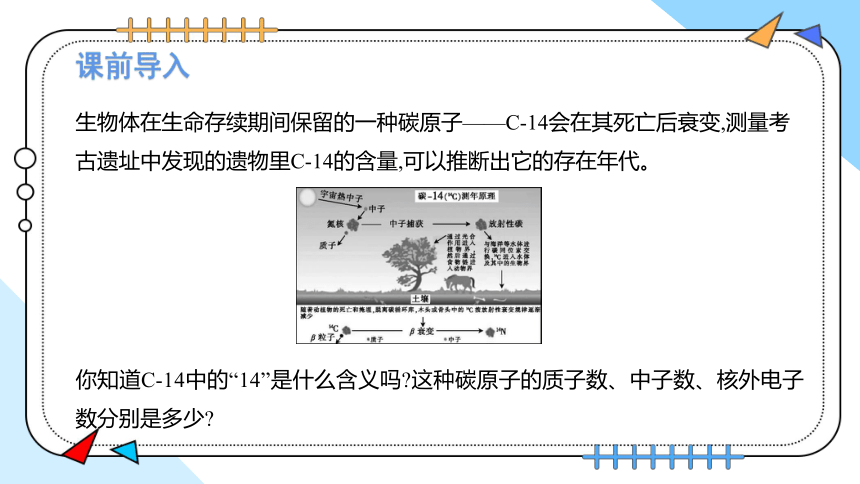
生物体在生命存续期间保留的一种碳原子——C-14会在其死亡后衰变,测量考古遗址中发现的遗物里C-14的含量,可以推断出它的存在年代。
你知道C-14中的“14”是什么含义吗 这种碳原子的质子数、中子数、核外电子数分别是多少
01
原子结构及各微粒数间的定量关系
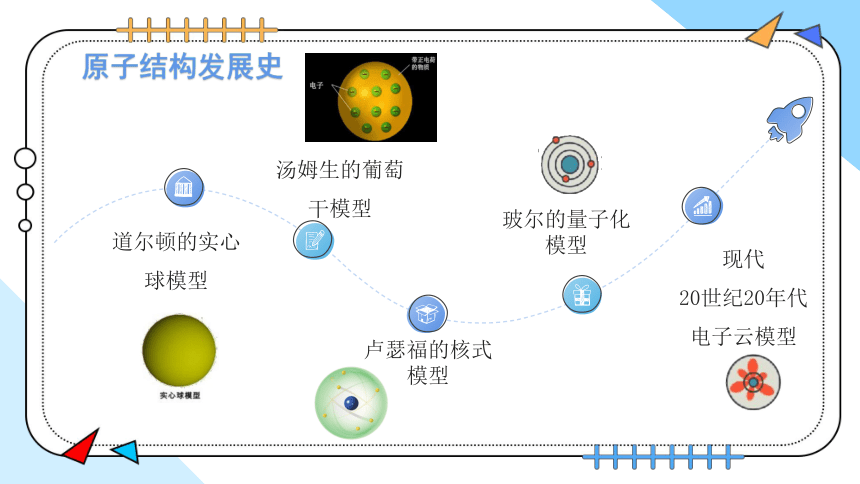
原子结构发展史
玻尔的量子化模型
汤姆生的葡萄干模型
道尔顿的实心球模型
卢瑟福的核式模型
现代
20世纪20年代
电子云模型
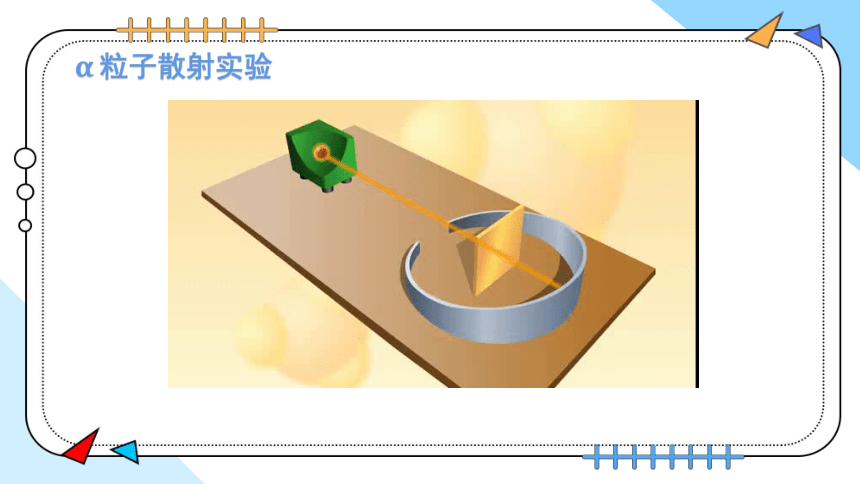
α 粒子散射实验
英国物理学家卢瑟福在 α 粒子散射实验的基础上,经过理论分析和计算,提出了核式原子模型:原子由原子核和核外电子构成,原子核带正电荷,位于原子的中心;电子带负电荷,在原子核周围空间做高速运动。
实验前,根据“葡萄干布丁”原子模型进行的预测
实验结果:绝大多数 α 粒子通过,少数 α 粒子偏转,个别 α 粒子被反弹
α 粒子散射实验
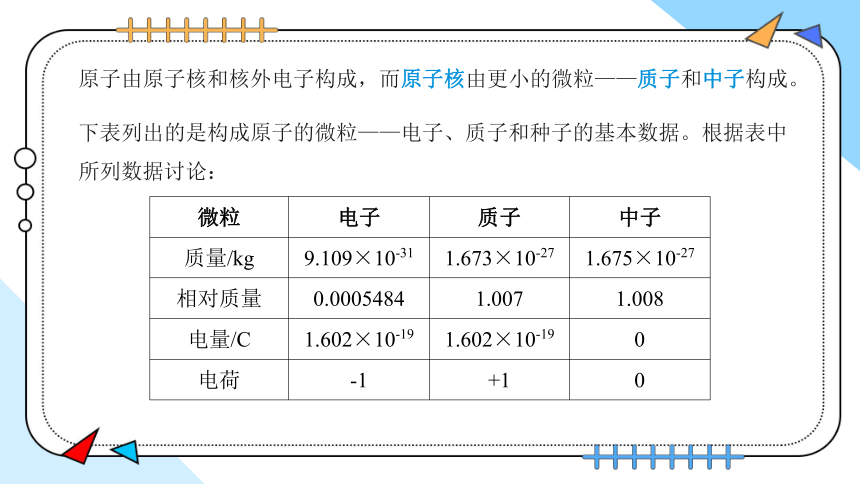
原子由原子核和核外电子构成,而原子核由更小的微粒——质子和中子构成。
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
下表列出的是构成原子的微粒——电子、质子和种子的基本数据。根据表中所列数据讨论:
1. 在原子中,质子数、核电荷数和核外电子数之间存在着怎样的关系?为什么?
在原子中,核电荷数=质子数=核外电子数。因为质子带一个单位正电荷,核外电子带一个单位负电荷,中子不带电,所以只有质子数等于核外电子书,原子才是电中性
2. 原子的质量主要由哪些微粒决定?
电子的质量很小,相对于质子和中子的质量,可以忽略不计,所以原子的质量主要由原子核内质子和种子的质量决定
3. 如果忽略电子的质量,质子、中子的相对质量分别取其近似整数值,那么,原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
忽略电子的质量,原子的质量主要由原子核内质子、中子的质量决定。质子、中子的相对原子质量均取近似整数值1,则原子的相对质量在数值上等于原子核内质子数与中子数之和
原子构成的表示方法
质量数
质子数
元素符号
原子核中质子数和中子数之和称为质量数
质子数(Z) + 中子数(N)= 质量数(A)
例如表示质量数为14,质子数为6的碳原子
构成原子的有关微粒之间的关系可表示为
注意事项
关于原子构成的几个易错点
★原子中一定含有质子,但不一定含有中子,如
★原子的质量数和相对原子质量的含义不同,但是原子的质量数一般等于该原子相对原子质量数值的整数部分。
★对离子进行电子数与质子数换算时应该注意阳离子和阴离子的区别。
构成原子或离子的微粒间的关系
★质量关系:质量数(A)=质子数(Z)+中子数(N)。
★等量关系:核电荷数=质子数,对原子而言,核电荷数=质子数=核外电子数。
★大小关系
阳离子(Rm+) 质子数>电子数 质子数=电子数+m
阴离子(Rm-) 质子数<电子数 质子数=电子数-m
◆X原子的相对原子质量=≈质量数(A)=质子数(Z)+中子数(N)=m(X)·NA=原子的摩尔质量(数值上)。
02
核素 同位素
元素
概念:具有相同质子数的同一类原子的总称
→同种元素的质子数一定相同,中子数不一定相同
→同一类原子指质子数相同的各种不同原子,以及各种状态下的原子或离子,是广义的原子,如H2中的H与HCl中的H虽然存在形式不同,但都属于氢元素
→元素只分种类,不能称个数,只能说某物质由几种元素组成,不能说由几个元素组成
→质子数相等的微粒不一定是同种元素,因为微粒可能是原子团
核素
科学家发现有三种氢原子:氕、氘、氚。这三种氢原子中质子、中子和电子的数量关系如图所示。
氕(H)
氘(D)
氚(T)
核素
名称 氕 氘 氚
符号 H D T
质子数 1 1 1
中子数 0 1 2
由表可知,氕、氘、氚三种原子的质子数与核外电子书均相同,中子数不同。三种均属于氢元素
核素的概念:具有相同数目的质子和相同数目的中子的一类原子称为核素。
在天然元素中,许多元素都有多种核素,有些元素则只有一种核素
同位素
◆定义:质子数相同而中子数不同的同一种元素的不同核素互为同位素。
◆分类:同位素分为稳定同位素和放射性同位素。
◆位置:因质子数相同,故元素符号相同,在元素周期表中占据同一位置(即同位)
◆结构:质子数相同,中子数不同
◆性质:化学性质几乎完全相同,物理性质略有差距
◆存在:天然存在的同位素在自然里的丰都是固定不变的
几种重要的核素的应用
2H、3H→制造氢弹
235U→核反应堆的原料
12C→计算其他原子的相对原子质量的标准
14C→测定文物的存在年代
放射性同位素→放射性同位素最常见的应用是进行同位素示踪和用作放射源。例如,追踪植物中放射性32P发出的射线,能够确定磷在植物中的作用部位;应用放射性同位素发出的射线,可以进行金属制品探伤、人体疾病诊断和肿瘤治疗等
元素、核素、同位素的区别
项目 元素 核素 同位素
概念 质子数相同的同一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的同一种元素的不同核素
范围 原子 原子 原子
特性 只有种类,没有个数 化学反应中的最小 微粒 由同位素组成的单质,化学性质几乎相同,物理性质不同
决定因素 质子数 质子数、中子数 质子数、中子数
举例 H、C、N 三种元素 、 三种核素 、 、 互为同位素
元素、核素、同位素的联系
同一种元素
核素1
核素2
核素3
……
核素n
单质1
单质2
单质3
……
单质n
构成
互称
互称
同位素
同素异形体
属于
一种单质可能由不同的核素构成
一种核素也可以构成不同的单质
元素的相对原子质量
◆定义:
各种核素的相对原子质量分别与各种核素在自然界里的丰度(某种核素在这种元素的所有天然核素中所占的比例)的乘积之和。
◆计算式:
M=M1×n1 %+M2×n2 %+M3×n3 %+……如氯元素有两种核素:和 ,其中 的相对原子质量为34.97,其丰度为75.77%,的相对原子质量为36.97,其丰度为24.23%,则氯元素的相对原子质量为34.97×75.77%+36.97×24.23%≈35.45。
03
课堂小结
04
课堂练习
1.嫦娥五号带回的月壤中含有大量安全无污染的核聚变原料He-3(如图所示),下列关于He-3的说法正确的是
A.He-3是一种新元素
B.He-3原子中含有1个质子,2个电子
C.He-3原子中含有3个质子,没有中子
D.He-3原子中含有2个质子,1个中子,2个电子
D
2.下列叙述错误的是( )
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
D
3.重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子
B.1H与D互称同位素
C.H2O与D2O互称同素异形体
D.1H218O与D216O的相对分子质量相同
C
4.金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关48Ti和50Ti的说法正确的是( )。
A.48Ti和50Ti的质子数相同,互为同位素
B.48Ti和50Ti的质量数不同,属于两种元素
C.48Ti和50Ti的质子数相同,是同一种核素
D.48Ti和50Ti的质子数相同,中子数不同,互为同素异形体
A
Thanks
好好学习天天向上
第一章 原子结构元素周期律
第一节 原子结构与元素性质
1.1.1 原子核 核素
核心素养目标
宏观辨识与微观探析:
学生能从宏观上认识元素的种类,从微观角度理解原子的构成、核素和同位素的差异,建立起宏观元素与微观原子、核素之间的联系,能运用微观知识解释宏观元素的多样性和相关性质,形成 “结构决定性质” 的观念。
证据推理与模型认知:
通过对原子结构、核素、同位素等知识的学习,依据实验数据和科学理论进行推理,理解质量数、质子数、中子数等概念之间的逻辑关系,构建原子结构模型、元素相对原子质量计算模型等,提升运用模型解决实际化学问题的能力
重点
理解原子符号 中各字母含义,掌握质子、中子、电子、质量数之间的关系;
核素、同位素的概念理解,能准确判断不同原子是否为核素、是否互为同位素;
元素相对原子质量的计算方法,能根据核素相对原子质量和丰度计算元素相对原子质量
难点
对核素和同位素概念的深入理解及区分,特别是同位素化学性质几乎相同但物理性质不同的原因;复杂离子(阳离子、阴离子)中质子数、中子数、电子数之间关系的计算和应用;理解元素相对原子质量与核素相对原子质量、丰度之间的内在联系,以及近似相对原子质量的概念和计算
课前导入
课前导入
生物体在生命存续期间保留的一种碳原子——C-14会在其死亡后衰变,测量考古遗址中发现的遗物里C-14的含量,可以推断出它的存在年代。
你知道C-14中的“14”是什么含义吗 这种碳原子的质子数、中子数、核外电子数分别是多少
01
原子结构及各微粒数间的定量关系
原子结构发展史
玻尔的量子化模型
汤姆生的葡萄干模型
道尔顿的实心球模型
卢瑟福的核式模型
现代
20世纪20年代
电子云模型
α 粒子散射实验
英国物理学家卢瑟福在 α 粒子散射实验的基础上,经过理论分析和计算,提出了核式原子模型:原子由原子核和核外电子构成,原子核带正电荷,位于原子的中心;电子带负电荷,在原子核周围空间做高速运动。
实验前,根据“葡萄干布丁”原子模型进行的预测
实验结果:绝大多数 α 粒子通过,少数 α 粒子偏转,个别 α 粒子被反弹
α 粒子散射实验
原子由原子核和核外电子构成,而原子核由更小的微粒——质子和中子构成。
微粒 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
下表列出的是构成原子的微粒——电子、质子和种子的基本数据。根据表中所列数据讨论:
1. 在原子中,质子数、核电荷数和核外电子数之间存在着怎样的关系?为什么?
在原子中,核电荷数=质子数=核外电子数。因为质子带一个单位正电荷,核外电子带一个单位负电荷,中子不带电,所以只有质子数等于核外电子书,原子才是电中性
2. 原子的质量主要由哪些微粒决定?
电子的质量很小,相对于质子和中子的质量,可以忽略不计,所以原子的质量主要由原子核内质子和种子的质量决定
3. 如果忽略电子的质量,质子、中子的相对质量分别取其近似整数值,那么,原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
忽略电子的质量,原子的质量主要由原子核内质子、中子的质量决定。质子、中子的相对原子质量均取近似整数值1,则原子的相对质量在数值上等于原子核内质子数与中子数之和
原子构成的表示方法
质量数
质子数
元素符号
原子核中质子数和中子数之和称为质量数
质子数(Z) + 中子数(N)= 质量数(A)
例如表示质量数为14,质子数为6的碳原子
构成原子的有关微粒之间的关系可表示为
注意事项
关于原子构成的几个易错点
★原子中一定含有质子,但不一定含有中子,如
★原子的质量数和相对原子质量的含义不同,但是原子的质量数一般等于该原子相对原子质量数值的整数部分。
★对离子进行电子数与质子数换算时应该注意阳离子和阴离子的区别。
构成原子或离子的微粒间的关系
★质量关系:质量数(A)=质子数(Z)+中子数(N)。
★等量关系:核电荷数=质子数,对原子而言,核电荷数=质子数=核外电子数。
★大小关系
阳离子(Rm+) 质子数>电子数 质子数=电子数+m
阴离子(Rm-) 质子数<电子数 质子数=电子数-m
◆X原子的相对原子质量=≈质量数(A)=质子数(Z)+中子数(N)=m(X)·NA=原子的摩尔质量(数值上)。
02
核素 同位素
元素
概念:具有相同质子数的同一类原子的总称
→同种元素的质子数一定相同,中子数不一定相同
→同一类原子指质子数相同的各种不同原子,以及各种状态下的原子或离子,是广义的原子,如H2中的H与HCl中的H虽然存在形式不同,但都属于氢元素
→元素只分种类,不能称个数,只能说某物质由几种元素组成,不能说由几个元素组成
→质子数相等的微粒不一定是同种元素,因为微粒可能是原子团
核素
科学家发现有三种氢原子:氕、氘、氚。这三种氢原子中质子、中子和电子的数量关系如图所示。
氕(H)
氘(D)
氚(T)
核素
名称 氕 氘 氚
符号 H D T
质子数 1 1 1
中子数 0 1 2
由表可知,氕、氘、氚三种原子的质子数与核外电子书均相同,中子数不同。三种均属于氢元素
核素的概念:具有相同数目的质子和相同数目的中子的一类原子称为核素。
在天然元素中,许多元素都有多种核素,有些元素则只有一种核素
同位素
◆定义:质子数相同而中子数不同的同一种元素的不同核素互为同位素。
◆分类:同位素分为稳定同位素和放射性同位素。
◆位置:因质子数相同,故元素符号相同,在元素周期表中占据同一位置(即同位)
◆结构:质子数相同,中子数不同
◆性质:化学性质几乎完全相同,物理性质略有差距
◆存在:天然存在的同位素在自然里的丰都是固定不变的
几种重要的核素的应用
2H、3H→制造氢弹
235U→核反应堆的原料
12C→计算其他原子的相对原子质量的标准
14C→测定文物的存在年代
放射性同位素→放射性同位素最常见的应用是进行同位素示踪和用作放射源。例如,追踪植物中放射性32P发出的射线,能够确定磷在植物中的作用部位;应用放射性同位素发出的射线,可以进行金属制品探伤、人体疾病诊断和肿瘤治疗等
元素、核素、同位素的区别
项目 元素 核素 同位素
概念 质子数相同的同一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的同一种元素的不同核素
范围 原子 原子 原子
特性 只有种类,没有个数 化学反应中的最小 微粒 由同位素组成的单质,化学性质几乎相同,物理性质不同
决定因素 质子数 质子数、中子数 质子数、中子数
举例 H、C、N 三种元素 、 三种核素 、 、 互为同位素
元素、核素、同位素的联系
同一种元素
核素1
核素2
核素3
……
核素n
单质1
单质2
单质3
……
单质n
构成
互称
互称
同位素
同素异形体
属于
一种单质可能由不同的核素构成
一种核素也可以构成不同的单质
元素的相对原子质量
◆定义:
各种核素的相对原子质量分别与各种核素在自然界里的丰度(某种核素在这种元素的所有天然核素中所占的比例)的乘积之和。
◆计算式:
M=M1×n1 %+M2×n2 %+M3×n3 %+……如氯元素有两种核素:和 ,其中 的相对原子质量为34.97,其丰度为75.77%,的相对原子质量为36.97,其丰度为24.23%,则氯元素的相对原子质量为34.97×75.77%+36.97×24.23%≈35.45。
03
课堂小结
04
课堂练习
1.嫦娥五号带回的月壤中含有大量安全无污染的核聚变原料He-3(如图所示),下列关于He-3的说法正确的是
A.He-3是一种新元素
B.He-3原子中含有1个质子,2个电子
C.He-3原子中含有3个质子,没有中子
D.He-3原子中含有2个质子,1个中子,2个电子
D
2.下列叙述错误的是( )
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
D
3.重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子
B.1H与D互称同位素
C.H2O与D2O互称同素异形体
D.1H218O与D216O的相对分子质量相同
C
4.金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关48Ti和50Ti的说法正确的是( )。
A.48Ti和50Ti的质子数相同,互为同位素
B.48Ti和50Ti的质量数不同,属于两种元素
C.48Ti和50Ti的质子数相同,是同一种核素
D.48Ti和50Ti的质子数相同,中子数不同,互为同素异形体
A
Thanks
好好学习天天向上
