3.4.2 分子间作用力 分子晶体(教学课件)(共29张PPT)_高中化学苏教版选择性必修二(2019)
文档属性
| 名称 | 3.4.2 分子间作用力 分子晶体(教学课件)(共29张PPT)_高中化学苏教版选择性必修二(2019) |  | |
| 格式 | pptx | ||
| 文件大小 | 17.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-07 21:56:20 | ||
图片预览







文档简介
(共29张PPT)
专题3 微粒间作用力与物质性质
第三单元 共价键 共价晶体
3.4.2 分子晶体
核心素养目标
宏观辨识与微观探析:
通过对分子晶体外观、物理性质(如熔点、硬度、导电性等)的观察与分析,引导学生从宏观现象深入探究其微观结构,理解分子晶体由分子通过分子间作用力构成的本质。
证据推理与模型认知:
以各类分子晶体(如常见非金属氢化物、单质、氧化物、酸、有机物等)的实例为证据,引导学生归纳总结分子晶体的判断方法和结构特征规律,构建分子晶体结构与性质关联的思维模型。
教学重难点
重点
详细讲解分子晶体的构成微粒及微粒间作用力,结合实例深入分析分子晶体的结构特征对其物理性质的影响机制。
系统归纳常见的分子晶体类型,并通过实例分析和对比,帮助学生掌握依据物质类别、组成微粒及作用力、性质特点等判断分子晶体的方法。
难点
氢键作为一种特殊的分子间作用力,其形成条件、存在形式(分子内氢键和分子间氢键)及对分子晶体结构和性质的影响较为复杂。
石墨晶体作为混合型晶体,其层内共价键和层间分子间作用力的协同作用机制,以及由此产生的特殊物理性质(如导电性、润滑性、高熔点等)是教学的难点。
同学们,在我们的生活中,有许多奇妙的晶体物质。比如,冬天美丽的雪花,它是水的晶体形态;还有晶莹剔透的冰糖,给食物增添了甜蜜的味道。大家有没有想过,这些晶体为什么会有这样的形态和性质呢?今天,我们就一起来探索一类特殊的晶体 —— 分子晶体。分子晶体在我们周围无处不在,像二氧化碳形成的干冰,能用于舞台特效和食品保鲜;还有我们常见的冰,它们都属于分子晶体。那分子晶体究竟是由什么构成的,又为什么会表现出独特的物理性质呢?让我们一起揭开分子晶体的神秘面纱。
课前导入
分子晶体
PART 01
(1)概念:分子通过分子间作用力构成的固态物质,称为分子晶体。
(2)构成分子晶体的微粒是分子,微粒间的作用力是分子间作用力。
【典型的分子晶体】
(1)所有非金属氢化物,如水、硫化氢、氨、甲烷等。
(2)多数非金属单质,如卤素单质(X2)、O2、S8、N2、白磷(P4)、C60等。
(3)部分非金属氧化物,如CO2、SO2、SO3、P4O6、P4O10等。
(4)几乎所有的酸,如H2SO4、HNO3、H3PO4、H2SiO3、H2SO3等。
(5)大多数有机化合物,如苯、乙醇、乙酸、葡萄糖等(不包括有机盐)。
(6)稀有气体。
分子晶体
分子晶体的物理性质
(1)分子晶体由于以比较弱的分子间作用力相结合,因此一般熔点较低,硬度较小。
(2)对组成和结构相似,晶体中又不含氢键的物质来说,随着相对分子质量的增大,分子间作用力增强,熔、沸点升高。但分子间存在氢键的晶体熔、沸点较高。
(3)熔融状态不能导电,如果共价化合物分子是电解质,溶于水时能导电,如HCl、H2SO4等;如果能与水反应生成电解质,其水溶液能导电,如NH3、CO2等。
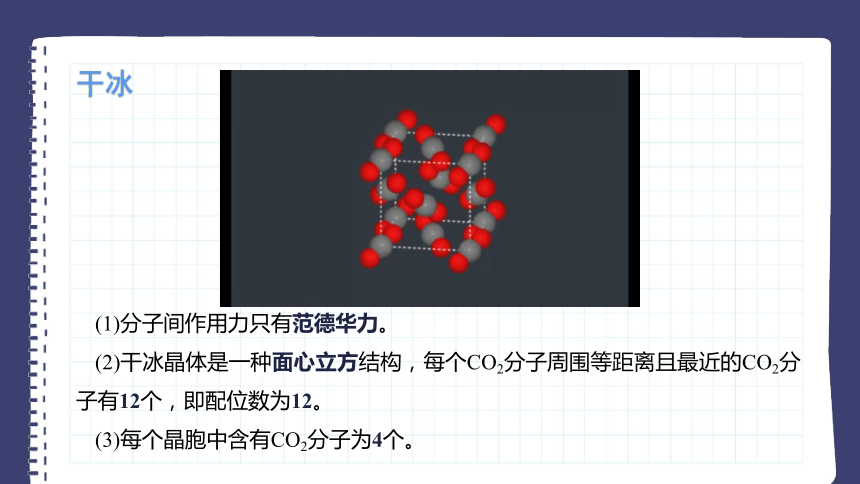
干冰
(1)分子间作用力只有范德华力。
(2)干冰晶体是一种面心立方结构,每个CO2分子周围等距离且最近的CO2分子有12个,即配位数为12。
(3)每个晶胞中含有CO2分子为4个。
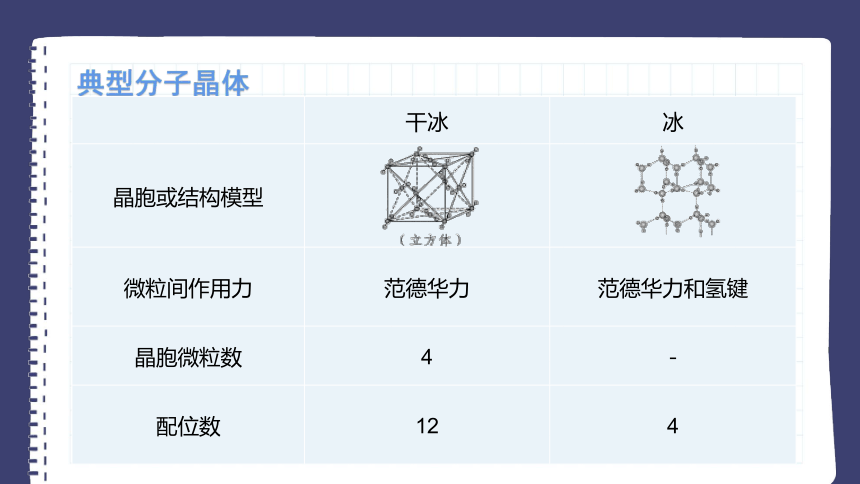
典型分子晶体
干冰 冰
晶胞或结构模型
微粒间作用力 范德华力 范德华力和氢键
晶胞微粒数 4 -
配位数 12 4
分子晶体的判断方法
(1)依据物质的类别判断
多数非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、大多数有机物都是分子晶体。
(2)依据组成晶体的微粒及微粒间作用力判断
组成分子晶体的微粒是分子,微粒间的作用力是分子间作用力。
(3)依据物质的性质判断
分子晶体的硬度小,熔、沸点低,在熔融状态或固态时均不导电。
分子晶体熔、沸点高低的判断
(1)组成和结构相似,不含氢键的分子晶体,相对分子质量越大,范德华力越强,熔、沸点越高,如I2>Br2>Cl2>F2,HI>HBr>HCl。
(2)组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,熔、沸点越高,如CH3OH>CH3CH3。
(3)含有分子间氢键的分子晶体的熔、沸点反常升高,如H2O>H2Te>H2Se>H2S。
(4)对于有机物中的同分异构体,支链越多,熔、沸点越低,如正戊烷>异戊烷>新戊烷
(5)烃、卤代烃、醇、醛、羧酸等有机物一般随分子中碳原子数的增加,熔、沸点升高,如C2H6>CH4,C2H5Cl>CH3Cl,CH3COOH>HCOOH。
典例解析
下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、HD、C10H18 B.PCl3、CO2、H2SO4
C.SO2、C60、P2O5 D.CCl4、Na2S、H2O2
【解析】分子晶体的构成微粒为分子,分子内部以共价键结合。HD属于分子晶体,但为单质,故A错误;PCl3、CO2、H2SO4均属于分子晶体,且均为化合物,故B正确;C60属于分子晶体,但为单质,故C错误;Na2S中含有离子键,不属于分子晶体,故D错误。
B
混合型晶体
石墨晶体
PART 02
石墨晶体
石墨和金刚石是碳的两种同素异形体。金刚石属于共价晶体,金刚石中每个碳原子以共价键与紧邻的四个碳原子形成三维网状结构;石墨晶体形成二维网状结构,层内每个碳原子以共价键与周围的三个碳原子结合,层间为分子间作用力,因此石墨晶体是一种混合型晶体。
金刚石和石墨的结构模型
在石墨的二维结构平面内,每个碳原子以C—C键与3个碳原子结合,形成六元环层。碳原子有4个价电子,而每个碳原子仅用了3个价电子形成共价键,还有1个电子处于碳原子的2p轨道上。层内碳原子的这些p轨道相互平行,相邻碳原子的p轨道相互重叠,形成大π键。而这些p轨道中的电子可在整个层内运动,当施加电场时,可以沿电场方向运动,因而石墨具有导电性。但由于相邻碳原子层之间相隔较远,电子不能从一层跳跃到另一层,因此石墨的导电性具有一定的方向性。由于石墨晶体层间是以分子间作用力相结合的,在外力的作用下,石墨晶体中层与层之间发生相对滑动而具有良好的润滑性。
石墨晶体
石墨晶体中层内
的π键
晶体的共性
金属晶体、离子晶体、共价晶体和分子晶体是最常见的晶体类型。但不论上述晶体颗粒的大小如何,晶体内部结构均是由原子、离子或分子按周期性规律重复排列组成的。因此,在研究这些晶体类型时,我们均可通过研究能够反映晶体结构特征的基本重复单位——晶胞来进行。
晶体的共性:
(1)晶体物质各个部分的宏观性质总是相同的,例如具有相同的密度、相同的化学组成等。
(2)晶体总能自发地形成多面体外形。
(3)晶体都具有确定的熔点。
晶体的个性:
(1)绝大多数金属晶体是电和热的良导体,延展性好。
(2)食盐为离子晶体,质脆,熔融状态下能导电。
(3)金刚石为共价晶体,无色透明、坚硬、质脆,常温下不导电。
(4)干冰属于分子晶体,只能在低温下存在。
四种类型的晶体的结构与性质
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
结构 构成微粒 金属离子和电子 阴离子、阳离子 原子 分子
微粒间作用力 金属键 离子键 共价键 分子间作用力
性质 熔、沸点 有的很高、有的低 较高 很高 较低
硬度 大小不一 较大 较高 较低
导电性 导电 固态不导电、熔化或在水溶液中导电 不导电 熔化态(液态)不导电,溶于水有的导电
举例 Cu、Hg、Na NaCl、NH4Cl 金刚石、SiO2 干冰、碘
晶体的类型判定
(1)依据组成晶体的微观粒子和粒子间的相互作用判断
分子间通过分子间作用力形成的晶体属于分子晶体;
由原子通过共价键形成的晶体属于共价晶体;
由阴、阳离子通过离子键形成的晶体属于离子晶体;
由金属阳离子和自由电子通过金属键形成的晶体属于金属晶体。
晶体的类型判定——
根据物质的分类判定
①活泼金属的氧化物(如Na2O、MgO等)、强碱[如KOH、Ba(OH)2等]和绝大多数的盐类是离子晶体。
②多数非金属单质(除金刚石、石墨、晶体硼、晶体硅等外)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、大多数有机物(除有机盐外)是分子晶体。
③常见的共价晶体单质有金刚石、晶体硼、晶体硅等;常见的共价晶体化合物有碳化硅、SiO2等。
④常温下金属单质(除汞外)与合金均属于金属晶体。
依据硬度和机械性能判断
离子晶体硬度较大或略硬而脆;共价晶体硬度大;分子晶体硬度小且较脆;金属晶体多数硬度大,但也有硬度较小的,且具有延展性。
依据导电性判断
离子晶体在水溶液中和熔融状态下都导电;共价晶体一般为非导体,但晶体硅能导电;分子晶体为非导体,而分子晶体中的电解质(主要是酸)溶于水,使分子内的化学键断裂形成自由离子,也能导电;金属晶体是电的良导体。
依据晶体熔点判断
离子晶体的熔点较高,常在数百至几千摄氏度;共价晶体的熔点很高,常在一千至几千摄氏度;分子晶体的熔点较低,常在数百摄氏度以下或很低温度;金属晶体多数熔点高,但也有熔点相当低的。
晶体的类型判定
课堂小结
PART 03
混合型晶体——石墨
分子晶体
2
1
分子晶体混合
晶体晶体的共
性与个性
晶体的共性与个性
3
结构特点
物理性质
结构特点
性质
晶体的共性
晶体的个性
4类晶体的比较
常见的分子晶体及判断方法
典型分子晶体的结构--干冰和冰
晶体类型的判断方法
课堂练习
PART 04
1.下列有关分子晶体的叙述正确的是( )
A.分子内均存在共价键
B.非金属氧化物呈固态时,一定属于分子晶体
C.分子晶体中一定存在氢键
D.分子晶体熔化时一定破坏了范德华力
D
2.下列性质符合分子晶体的是( )
A.熔点是1 070 ℃,易溶于水,水溶液能导电
B.熔点是10.31 ℃,液态不导电,水溶液能导电
C.不能溶于水,熔点是1 723 ℃,沸点是2 230 ℃
D.熔点是97.81 ℃,质软、导电,密度是0.97 g·cm-3
B
D
4.下列说法中正确的是( )
A.C60汽化和I2升华克服的作用力相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.NaCl和HCl溶于水时,破坏的化学键都是离子键
D.常温下TiCl4是无色透明液体,熔点-23.2 ℃,沸点136.2 ℃,所以TiCl4属于离子晶体
A
Thanks
好好学习天天向上
专题3 微粒间作用力与物质性质
第三单元 共价键 共价晶体
3.4.2 分子晶体
核心素养目标
宏观辨识与微观探析:
通过对分子晶体外观、物理性质(如熔点、硬度、导电性等)的观察与分析,引导学生从宏观现象深入探究其微观结构,理解分子晶体由分子通过分子间作用力构成的本质。
证据推理与模型认知:
以各类分子晶体(如常见非金属氢化物、单质、氧化物、酸、有机物等)的实例为证据,引导学生归纳总结分子晶体的判断方法和结构特征规律,构建分子晶体结构与性质关联的思维模型。
教学重难点
重点
详细讲解分子晶体的构成微粒及微粒间作用力,结合实例深入分析分子晶体的结构特征对其物理性质的影响机制。
系统归纳常见的分子晶体类型,并通过实例分析和对比,帮助学生掌握依据物质类别、组成微粒及作用力、性质特点等判断分子晶体的方法。
难点
氢键作为一种特殊的分子间作用力,其形成条件、存在形式(分子内氢键和分子间氢键)及对分子晶体结构和性质的影响较为复杂。
石墨晶体作为混合型晶体,其层内共价键和层间分子间作用力的协同作用机制,以及由此产生的特殊物理性质(如导电性、润滑性、高熔点等)是教学的难点。
同学们,在我们的生活中,有许多奇妙的晶体物质。比如,冬天美丽的雪花,它是水的晶体形态;还有晶莹剔透的冰糖,给食物增添了甜蜜的味道。大家有没有想过,这些晶体为什么会有这样的形态和性质呢?今天,我们就一起来探索一类特殊的晶体 —— 分子晶体。分子晶体在我们周围无处不在,像二氧化碳形成的干冰,能用于舞台特效和食品保鲜;还有我们常见的冰,它们都属于分子晶体。那分子晶体究竟是由什么构成的,又为什么会表现出独特的物理性质呢?让我们一起揭开分子晶体的神秘面纱。
课前导入
分子晶体
PART 01
(1)概念:分子通过分子间作用力构成的固态物质,称为分子晶体。
(2)构成分子晶体的微粒是分子,微粒间的作用力是分子间作用力。
【典型的分子晶体】
(1)所有非金属氢化物,如水、硫化氢、氨、甲烷等。
(2)多数非金属单质,如卤素单质(X2)、O2、S8、N2、白磷(P4)、C60等。
(3)部分非金属氧化物,如CO2、SO2、SO3、P4O6、P4O10等。
(4)几乎所有的酸,如H2SO4、HNO3、H3PO4、H2SiO3、H2SO3等。
(5)大多数有机化合物,如苯、乙醇、乙酸、葡萄糖等(不包括有机盐)。
(6)稀有气体。
分子晶体
分子晶体的物理性质
(1)分子晶体由于以比较弱的分子间作用力相结合,因此一般熔点较低,硬度较小。
(2)对组成和结构相似,晶体中又不含氢键的物质来说,随着相对分子质量的增大,分子间作用力增强,熔、沸点升高。但分子间存在氢键的晶体熔、沸点较高。
(3)熔融状态不能导电,如果共价化合物分子是电解质,溶于水时能导电,如HCl、H2SO4等;如果能与水反应生成电解质,其水溶液能导电,如NH3、CO2等。
干冰
(1)分子间作用力只有范德华力。
(2)干冰晶体是一种面心立方结构,每个CO2分子周围等距离且最近的CO2分子有12个,即配位数为12。
(3)每个晶胞中含有CO2分子为4个。
典型分子晶体
干冰 冰
晶胞或结构模型
微粒间作用力 范德华力 范德华力和氢键
晶胞微粒数 4 -
配位数 12 4
分子晶体的判断方法
(1)依据物质的类别判断
多数非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、大多数有机物都是分子晶体。
(2)依据组成晶体的微粒及微粒间作用力判断
组成分子晶体的微粒是分子,微粒间的作用力是分子间作用力。
(3)依据物质的性质判断
分子晶体的硬度小,熔、沸点低,在熔融状态或固态时均不导电。
分子晶体熔、沸点高低的判断
(1)组成和结构相似,不含氢键的分子晶体,相对分子质量越大,范德华力越强,熔、沸点越高,如I2>Br2>Cl2>F2,HI>HBr>HCl。
(2)组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,熔、沸点越高,如CH3OH>CH3CH3。
(3)含有分子间氢键的分子晶体的熔、沸点反常升高,如H2O>H2Te>H2Se>H2S。
(4)对于有机物中的同分异构体,支链越多,熔、沸点越低,如正戊烷>异戊烷>新戊烷
(5)烃、卤代烃、醇、醛、羧酸等有机物一般随分子中碳原子数的增加,熔、沸点升高,如C2H6>CH4,C2H5Cl>CH3Cl,CH3COOH>HCOOH。
典例解析
下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、HD、C10H18 B.PCl3、CO2、H2SO4
C.SO2、C60、P2O5 D.CCl4、Na2S、H2O2
【解析】分子晶体的构成微粒为分子,分子内部以共价键结合。HD属于分子晶体,但为单质,故A错误;PCl3、CO2、H2SO4均属于分子晶体,且均为化合物,故B正确;C60属于分子晶体,但为单质,故C错误;Na2S中含有离子键,不属于分子晶体,故D错误。
B
混合型晶体
石墨晶体
PART 02
石墨晶体
石墨和金刚石是碳的两种同素异形体。金刚石属于共价晶体,金刚石中每个碳原子以共价键与紧邻的四个碳原子形成三维网状结构;石墨晶体形成二维网状结构,层内每个碳原子以共价键与周围的三个碳原子结合,层间为分子间作用力,因此石墨晶体是一种混合型晶体。
金刚石和石墨的结构模型
在石墨的二维结构平面内,每个碳原子以C—C键与3个碳原子结合,形成六元环层。碳原子有4个价电子,而每个碳原子仅用了3个价电子形成共价键,还有1个电子处于碳原子的2p轨道上。层内碳原子的这些p轨道相互平行,相邻碳原子的p轨道相互重叠,形成大π键。而这些p轨道中的电子可在整个层内运动,当施加电场时,可以沿电场方向运动,因而石墨具有导电性。但由于相邻碳原子层之间相隔较远,电子不能从一层跳跃到另一层,因此石墨的导电性具有一定的方向性。由于石墨晶体层间是以分子间作用力相结合的,在外力的作用下,石墨晶体中层与层之间发生相对滑动而具有良好的润滑性。
石墨晶体
石墨晶体中层内
的π键
晶体的共性
金属晶体、离子晶体、共价晶体和分子晶体是最常见的晶体类型。但不论上述晶体颗粒的大小如何,晶体内部结构均是由原子、离子或分子按周期性规律重复排列组成的。因此,在研究这些晶体类型时,我们均可通过研究能够反映晶体结构特征的基本重复单位——晶胞来进行。
晶体的共性:
(1)晶体物质各个部分的宏观性质总是相同的,例如具有相同的密度、相同的化学组成等。
(2)晶体总能自发地形成多面体外形。
(3)晶体都具有确定的熔点。
晶体的个性:
(1)绝大多数金属晶体是电和热的良导体,延展性好。
(2)食盐为离子晶体,质脆,熔融状态下能导电。
(3)金刚石为共价晶体,无色透明、坚硬、质脆,常温下不导电。
(4)干冰属于分子晶体,只能在低温下存在。
四种类型的晶体的结构与性质
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
结构 构成微粒 金属离子和电子 阴离子、阳离子 原子 分子
微粒间作用力 金属键 离子键 共价键 分子间作用力
性质 熔、沸点 有的很高、有的低 较高 很高 较低
硬度 大小不一 较大 较高 较低
导电性 导电 固态不导电、熔化或在水溶液中导电 不导电 熔化态(液态)不导电,溶于水有的导电
举例 Cu、Hg、Na NaCl、NH4Cl 金刚石、SiO2 干冰、碘
晶体的类型判定
(1)依据组成晶体的微观粒子和粒子间的相互作用判断
分子间通过分子间作用力形成的晶体属于分子晶体;
由原子通过共价键形成的晶体属于共价晶体;
由阴、阳离子通过离子键形成的晶体属于离子晶体;
由金属阳离子和自由电子通过金属键形成的晶体属于金属晶体。
晶体的类型判定——
根据物质的分类判定
①活泼金属的氧化物(如Na2O、MgO等)、强碱[如KOH、Ba(OH)2等]和绝大多数的盐类是离子晶体。
②多数非金属单质(除金刚石、石墨、晶体硼、晶体硅等外)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、大多数有机物(除有机盐外)是分子晶体。
③常见的共价晶体单质有金刚石、晶体硼、晶体硅等;常见的共价晶体化合物有碳化硅、SiO2等。
④常温下金属单质(除汞外)与合金均属于金属晶体。
依据硬度和机械性能判断
离子晶体硬度较大或略硬而脆;共价晶体硬度大;分子晶体硬度小且较脆;金属晶体多数硬度大,但也有硬度较小的,且具有延展性。
依据导电性判断
离子晶体在水溶液中和熔融状态下都导电;共价晶体一般为非导体,但晶体硅能导电;分子晶体为非导体,而分子晶体中的电解质(主要是酸)溶于水,使分子内的化学键断裂形成自由离子,也能导电;金属晶体是电的良导体。
依据晶体熔点判断
离子晶体的熔点较高,常在数百至几千摄氏度;共价晶体的熔点很高,常在一千至几千摄氏度;分子晶体的熔点较低,常在数百摄氏度以下或很低温度;金属晶体多数熔点高,但也有熔点相当低的。
晶体的类型判定
课堂小结
PART 03
混合型晶体——石墨
分子晶体
2
1
分子晶体混合
晶体晶体的共
性与个性
晶体的共性与个性
3
结构特点
物理性质
结构特点
性质
晶体的共性
晶体的个性
4类晶体的比较
常见的分子晶体及判断方法
典型分子晶体的结构--干冰和冰
晶体类型的判断方法
课堂练习
PART 04
1.下列有关分子晶体的叙述正确的是( )
A.分子内均存在共价键
B.非金属氧化物呈固态时,一定属于分子晶体
C.分子晶体中一定存在氢键
D.分子晶体熔化时一定破坏了范德华力
D
2.下列性质符合分子晶体的是( )
A.熔点是1 070 ℃,易溶于水,水溶液能导电
B.熔点是10.31 ℃,液态不导电,水溶液能导电
C.不能溶于水,熔点是1 723 ℃,沸点是2 230 ℃
D.熔点是97.81 ℃,质软、导电,密度是0.97 g·cm-3
B
D
4.下列说法中正确的是( )
A.C60汽化和I2升华克服的作用力相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.NaCl和HCl溶于水时,破坏的化学键都是离子键
D.常温下TiCl4是无色透明液体,熔点-23.2 ℃,沸点136.2 ℃,所以TiCl4属于离子晶体
A
Thanks
好好学习天天向上
