4.1.1 分子的空间结构(教学课件)(共31张PPT)_高中化学苏教版选择性必修二(2019)_
文档属性
| 名称 | 4.1.1 分子的空间结构(教学课件)(共31张PPT)_高中化学苏教版选择性必修二(2019)_ |  | |
| 格式 | pptx | ||
| 文件大小 | 8.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-07 21:58:27 | ||
图片预览









文档简介
(共31张PPT)
专题4 分子空间结构与物质性质
第一单元 分子的空间结构
4.1.1 杂化轨道理论
核心素养目标
宏观辨识与微观探析:
能从宏观上描述常见分子的空间构型,如 CH 的正四面体结构、BF 的平面三角形结构等;从微观层面理解杂化轨道理论,认识原子轨道杂化过程,以及杂化轨道与分子空间构型、共价键形成之间的内在联系,建立 “结构决定性质” 的观念。
证据推理与模型认知:
依据杂化轨道理论,结合实验数据、分子结构信息等证据,推断分子的空间构型、中心原子杂化方式;构建不同杂化类型与分子空间构型关系的模型,并运用模型解释和预测相关分子的结构。
教学重难点
重点
杂化轨道理论的基本要点(杂化类型、轨道数目、能量关系)。
运用杂化轨道理论解释典型分子(CH 、BF 、BeCl )的空间构型。
难点
孤电子对与成键电子对的排斥作用对分子键角的影响(如H O的V形结构、NH 的三角锥形)。
杂化轨道理论与分子空间构型的动态关联(如sp 杂化与平面三角形结构的对应关系)。
我们都知道甲烷(CH )是天然气的主要成分,它的分子结构非常稳定。可是,按照我们之前学的原子轨道知识,碳原子的 2s 和 2p 轨道能量、形状都不一样,那它怎么能和 4 个氢原子形成完全相同的共价键,还构成完美的正四面体结构呢?这是不是很奇怪?(稍作停顿,观察学生反应 )其实,这个谜题的答案就藏在一种神奇的理论里 —— 杂化轨道理论。接下来,让我们一起探索这个理论,去解开甲烷分子结构的谜团,说不定还能发现更多化学世界的秘密 。
课前导入
杂化轨道理论
PART 01
杂化轨道的定义
在外界条件影响下,原子内部能量相近的原子轨道重新组合成新的原子轨道的过程叫做原子轨道的杂化(双原子分子的形成不存在杂化过程),组合后形成一组新的原子轨道叫做杂化原子轨道,简称杂化轨道。
杂化轨道的要点
原子在成键时,同一原子中能量相近的原子轨道重新组合成新的、能量相同的原子轨道(如2s和2p)
01 能量相近
杂化前后原子轨道数目不变(参加杂化的轨道数目等于形成的杂化轨道数目),且杂化轨道的能量相同。
02 数目不变
杂化轨道的要点
杂化改变了原有原子轨道的能量、形状和伸展方向。杂化轨道在与其他原子的原子轨道成键时重叠程度更大。从而形成更稳定的化学键。
03 成键能力增强
杂化轨道成键时要满足化学键间最小排斥原理,使轨道在空间取得最大夹角分布。故杂化后轨道的伸展方向、形状发生改变,但杂化轨道的形状完全相同。
04 排斥力最小
sp3杂化与CH4分子的空间构型
杂化轨道的形成
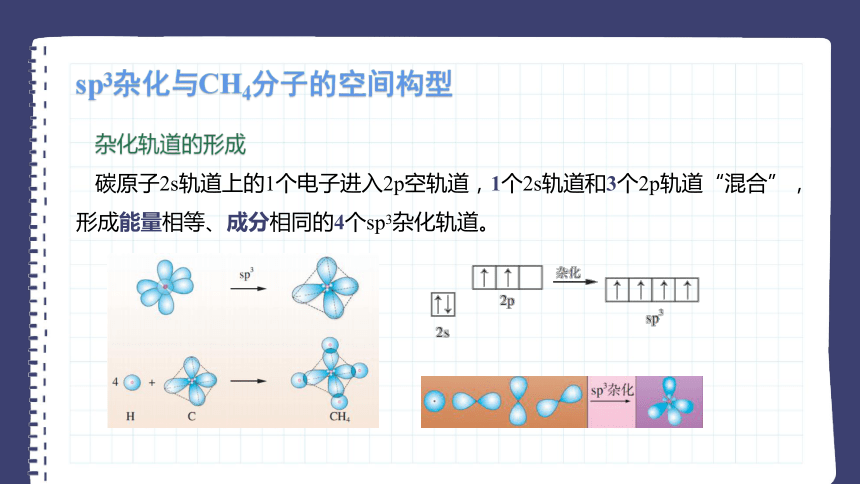
碳原子2s轨道上的1个电子进入2p空轨道,1个2s轨道和3个2p轨道“混合”,形成能量相等、成分相同的4个sp3杂化轨道。
sp3杂化与CH4分子的空间构型
碳原子的4个sp3杂化轨道指向正四面体的4个顶点,每个轨道上都有一个未成对电子。这样,碳原子的4个sp3杂化轨道分别与H原子的1s轨道重叠,形成4个相同的σ键,从而形成CH4分子。CH4分子中C—H键之间的夹角——键角都是109°28'。
正四面体结构的分子或离子的中心原子,一般采用sp3杂化轨道形成共价键,如CCl4、等。金刚石中的碳原子、晶体硅和石英(SiO2)晶体中的硅原子也是采用sp3杂化轨道形成共价键的。
sp2杂化与BF3分子的空间构型
sp2杂化轨道的形成
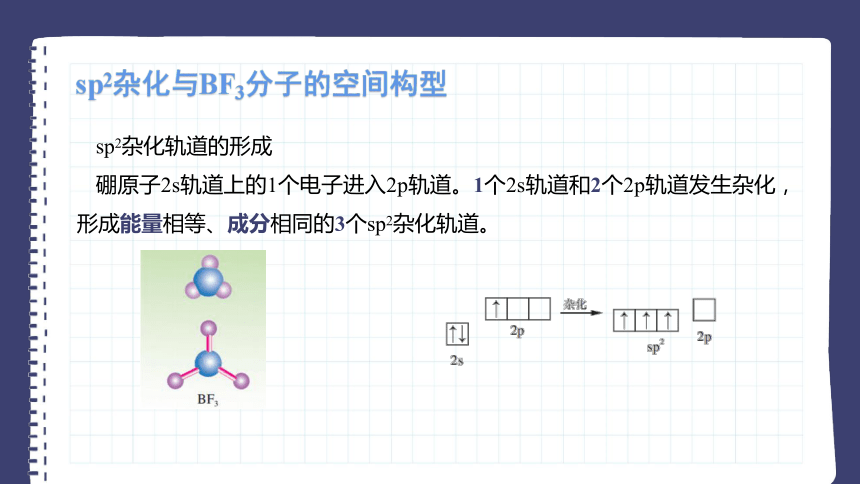
硼原子2s轨道上的1个电子进入2p轨道。1个2s轨道和2个2p轨道发生杂化,形成能量相等、成分相同的3个sp2杂化轨道。
sp2杂化与BF3分子的空间构型
在形成BF3分子的过程中,B原子2s轨道上的1个电子进入2p轨道。
这样,1个2s轨道和2个2p轨道发生杂化,形成能量相等、成分相同的3个sp2杂化轨道。
B原子中的3个sp2杂化轨道间的夹角为120°,这3个sp2杂化轨道分别与F原子的2p轨道形成σ键,因此BF3分子具有平面三角形结构。
sp杂化与BeCl2分子的空间构型
sp杂化轨道的形成
Be原子2s轨道上的1个电子进入2p轨道,1个2s轨道和1个2p轨道发生杂化,形成能量相等、成分相同的2个sp杂化轨道。
sp杂化与BeCl2分子的空间构型
在形成气态BeCl2分子的过程中,Be原子的1个2s轨道和1个2p轨道发生杂化,形成能量相等、成分相同的2个sp杂化轨道。
Be原子中的2个sp杂化轨道间的夹角为180°,这2个sp杂化轨道分别与Cl原子的3p轨道形成σ键,因此BeCl2为直线形分子。
杂化轨道数目与成键数目相同时分子的空间构型
实例 BeCl2 BF3 CH4
杂化类型 sp sp2 sp3
参与杂化的原子轨道及数目 1个s轨道 1个p轨道 1个s轨道 2个p轨道 1个s轨道
3个p轨道
杂化轨道的数目 2 3 4
杂化轨道间的夹角 180° 120° 109°28′
杂化轨道空间构型 直线形 平面三角形 正四面体
分子的空间构型 直线形 平面三角形 正四面体
常见分子的空间构型
杂化类型 分子类型 空间构型 举例
sp3 AB4 正四面体 CH4、CCl4、NH4+、金刚石等
AB3C 四面体 CH3Cl、CH3CH3等
AB3 三角锥 NH3、NF3等
AB2 V形 H2O、H2S
sp2 AB3 平面三角形 BF3、AlCl3、苯环等
sp AB2 直线形 CO2、CS2等
杂化轨道理论的应用
PART 02
乙烷分子的成键情况
(1) 碳原子的杂化方式:
碳原子为sp3杂化,形成4个sp3杂化轨道。
(2) 成键情况及空间结构
每个碳原子的sp3杂化轨道分别与3个氢原子的1s轨道形成3个C-H σ键(sp3—s),与另一个碳原子sp3轨道形成1个C-Cσ键(sp3—sp3)。
每个C原子与3个H原子和1个C原子形成四面体结构。
乙烯分子的成键情况
(1) 碳原子的杂化方式:
碳原子为sp2杂化,形成3个sp2杂化轨道。
(2) 成键方式和空间构型:
每个碳原子的sp2杂化轨道分别与2个氢原子的1s轨道形成2个C-Hσ键(sp2—s),与另一个碳原子的sp2杂化轨道形成C-Cσ键(sp2—sp2)。
2个碳原子未杂化的2p轨道形成1个π键。
乙烯分子的空间构型为平面结构。
(3)C=C、C=O、石墨、苯环中的碳原子,都是sp2杂化。
乙炔分子的成键情况
(1) 碳原子的杂化方式:
碳原子为sp杂化,形成2个sp杂化轨道。
(2)成键方式和空间构型:
每个碳原子的sp杂化轨道分别与1个氢原子的1s轨道形成2个C-Hσ键(sp—s),与另一个碳原子的sp杂化轨道形成C-Cσ键(sp—sp)。
碳原子未杂化的2p轨道两两形成2个π键。
乙炔分子的空间构型为直线形。
(3) C≡C、C≡N、CO2中的碳原子,都是sp杂化。
H2O分子的空间构型
(1)杂化轨道类型:
O原子上的1个2s轨道与3个2p轨道混合,形成4个sp3化轨道,杂化轨道的空间构型是正四面体形。
(2)成键情况:
O原子的2个sp3杂化轨道分别与H原子的1s轨道重叠,形成2个σ键,2对孤电子对没有参加成键。
(3)空间构型:
由于孤电子对—成键电子对的排斥作用>成键电子对—成键电子对作用,使键角小于109°28'。H2O分子的空间构型为V形,键角为104°30'。
NH3分子的空间构型
(1)杂化轨道类型:
N原子上的1个2s轨道与3个2p轨道混合,形成4个sp3杂化轨道,该杂化轨道的空间构型是正四面体形。
(2)成键情况:
N原子的3个sp3杂化轨道分别与H原子的1s轨道重叠,形成3个σ键,1对孤电子对没有参加成键。
(3)空间构型:
NH3分子的空间构型为三角锥形,键角为107°18'。
杂化轨道及成键规律
(1)当杂化轨道数目等于成键轨道数目时,杂化轨道全部参与成键,成键类型是σ键,分子的空间构型与杂化轨道的空间构型一致。
(2)当杂化轨道数目大于成键轨道数目时,分子中存在孤电子对,对成键电子对产生排斥作用,使键角增大,分子的空间构型与杂化轨道的空间构型不同。
(3)若未杂化的轨道上有成单电子,则形成π键。
课堂小结
PART 03
乙烷、乙烯、乙炔分子成键情况
杂化轨道理论要点
2
1
杂化轨道理论
H2O、NH3分子的空间构型
3
杂化过程
杂化轨道
共价键的形成
类型
空间结构
成键方式
分子的空间结构
课堂练习
PART 04
1.下列说法错误的是( )
A.ⅠA族元素成键时不可能有杂化轨道
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和1个C原子的2p轨道混合起来而形成的
C.孤电子对有可能参加杂化
D.s轨道和p轨道杂化不可能出现sp4杂化
B
2.氮的最高价氧化物为无色晶体,它由和构成,已知其阴离子结构为平面三角形,阳离子中氮的杂化方式为sp,则其阳离子的结构和阴离子中氮的杂化方式为( )
A.直线形 sp2 B.V形 sp
C.平面三角形 sp2 D.平面三角形 sp3
A
A
4.化合物A是一种新型锅炉水除氧剂,其结构式如图所示:
下列说法正确的是( )
A.碳、氮原子的杂化类型相同
B.氮原子与碳原子分别为sp3杂化与sp2杂化
C.1 mol A分子中所含σ键的数目为10NA
D.编号为a的氮原子和与其成键的另外三个原子在同一平面内
B
Thanks
好好学习天天向上
专题4 分子空间结构与物质性质
第一单元 分子的空间结构
4.1.1 杂化轨道理论
核心素养目标
宏观辨识与微观探析:
能从宏观上描述常见分子的空间构型,如 CH 的正四面体结构、BF 的平面三角形结构等;从微观层面理解杂化轨道理论,认识原子轨道杂化过程,以及杂化轨道与分子空间构型、共价键形成之间的内在联系,建立 “结构决定性质” 的观念。
证据推理与模型认知:
依据杂化轨道理论,结合实验数据、分子结构信息等证据,推断分子的空间构型、中心原子杂化方式;构建不同杂化类型与分子空间构型关系的模型,并运用模型解释和预测相关分子的结构。
教学重难点
重点
杂化轨道理论的基本要点(杂化类型、轨道数目、能量关系)。
运用杂化轨道理论解释典型分子(CH 、BF 、BeCl )的空间构型。
难点
孤电子对与成键电子对的排斥作用对分子键角的影响(如H O的V形结构、NH 的三角锥形)。
杂化轨道理论与分子空间构型的动态关联(如sp 杂化与平面三角形结构的对应关系)。
我们都知道甲烷(CH )是天然气的主要成分,它的分子结构非常稳定。可是,按照我们之前学的原子轨道知识,碳原子的 2s 和 2p 轨道能量、形状都不一样,那它怎么能和 4 个氢原子形成完全相同的共价键,还构成完美的正四面体结构呢?这是不是很奇怪?(稍作停顿,观察学生反应 )其实,这个谜题的答案就藏在一种神奇的理论里 —— 杂化轨道理论。接下来,让我们一起探索这个理论,去解开甲烷分子结构的谜团,说不定还能发现更多化学世界的秘密 。
课前导入
杂化轨道理论
PART 01
杂化轨道的定义
在外界条件影响下,原子内部能量相近的原子轨道重新组合成新的原子轨道的过程叫做原子轨道的杂化(双原子分子的形成不存在杂化过程),组合后形成一组新的原子轨道叫做杂化原子轨道,简称杂化轨道。
杂化轨道的要点
原子在成键时,同一原子中能量相近的原子轨道重新组合成新的、能量相同的原子轨道(如2s和2p)
01 能量相近
杂化前后原子轨道数目不变(参加杂化的轨道数目等于形成的杂化轨道数目),且杂化轨道的能量相同。
02 数目不变
杂化轨道的要点
杂化改变了原有原子轨道的能量、形状和伸展方向。杂化轨道在与其他原子的原子轨道成键时重叠程度更大。从而形成更稳定的化学键。
03 成键能力增强
杂化轨道成键时要满足化学键间最小排斥原理,使轨道在空间取得最大夹角分布。故杂化后轨道的伸展方向、形状发生改变,但杂化轨道的形状完全相同。
04 排斥力最小
sp3杂化与CH4分子的空间构型
杂化轨道的形成
碳原子2s轨道上的1个电子进入2p空轨道,1个2s轨道和3个2p轨道“混合”,形成能量相等、成分相同的4个sp3杂化轨道。
sp3杂化与CH4分子的空间构型
碳原子的4个sp3杂化轨道指向正四面体的4个顶点,每个轨道上都有一个未成对电子。这样,碳原子的4个sp3杂化轨道分别与H原子的1s轨道重叠,形成4个相同的σ键,从而形成CH4分子。CH4分子中C—H键之间的夹角——键角都是109°28'。
正四面体结构的分子或离子的中心原子,一般采用sp3杂化轨道形成共价键,如CCl4、等。金刚石中的碳原子、晶体硅和石英(SiO2)晶体中的硅原子也是采用sp3杂化轨道形成共价键的。
sp2杂化与BF3分子的空间构型
sp2杂化轨道的形成
硼原子2s轨道上的1个电子进入2p轨道。1个2s轨道和2个2p轨道发生杂化,形成能量相等、成分相同的3个sp2杂化轨道。
sp2杂化与BF3分子的空间构型
在形成BF3分子的过程中,B原子2s轨道上的1个电子进入2p轨道。
这样,1个2s轨道和2个2p轨道发生杂化,形成能量相等、成分相同的3个sp2杂化轨道。
B原子中的3个sp2杂化轨道间的夹角为120°,这3个sp2杂化轨道分别与F原子的2p轨道形成σ键,因此BF3分子具有平面三角形结构。
sp杂化与BeCl2分子的空间构型
sp杂化轨道的形成
Be原子2s轨道上的1个电子进入2p轨道,1个2s轨道和1个2p轨道发生杂化,形成能量相等、成分相同的2个sp杂化轨道。
sp杂化与BeCl2分子的空间构型
在形成气态BeCl2分子的过程中,Be原子的1个2s轨道和1个2p轨道发生杂化,形成能量相等、成分相同的2个sp杂化轨道。
Be原子中的2个sp杂化轨道间的夹角为180°,这2个sp杂化轨道分别与Cl原子的3p轨道形成σ键,因此BeCl2为直线形分子。
杂化轨道数目与成键数目相同时分子的空间构型
实例 BeCl2 BF3 CH4
杂化类型 sp sp2 sp3
参与杂化的原子轨道及数目 1个s轨道 1个p轨道 1个s轨道 2个p轨道 1个s轨道
3个p轨道
杂化轨道的数目 2 3 4
杂化轨道间的夹角 180° 120° 109°28′
杂化轨道空间构型 直线形 平面三角形 正四面体
分子的空间构型 直线形 平面三角形 正四面体
常见分子的空间构型
杂化类型 分子类型 空间构型 举例
sp3 AB4 正四面体 CH4、CCl4、NH4+、金刚石等
AB3C 四面体 CH3Cl、CH3CH3等
AB3 三角锥 NH3、NF3等
AB2 V形 H2O、H2S
sp2 AB3 平面三角形 BF3、AlCl3、苯环等
sp AB2 直线形 CO2、CS2等
杂化轨道理论的应用
PART 02
乙烷分子的成键情况
(1) 碳原子的杂化方式:
碳原子为sp3杂化,形成4个sp3杂化轨道。
(2) 成键情况及空间结构
每个碳原子的sp3杂化轨道分别与3个氢原子的1s轨道形成3个C-H σ键(sp3—s),与另一个碳原子sp3轨道形成1个C-Cσ键(sp3—sp3)。
每个C原子与3个H原子和1个C原子形成四面体结构。
乙烯分子的成键情况
(1) 碳原子的杂化方式:
碳原子为sp2杂化,形成3个sp2杂化轨道。
(2) 成键方式和空间构型:
每个碳原子的sp2杂化轨道分别与2个氢原子的1s轨道形成2个C-Hσ键(sp2—s),与另一个碳原子的sp2杂化轨道形成C-Cσ键(sp2—sp2)。
2个碳原子未杂化的2p轨道形成1个π键。
乙烯分子的空间构型为平面结构。
(3)C=C、C=O、石墨、苯环中的碳原子,都是sp2杂化。
乙炔分子的成键情况
(1) 碳原子的杂化方式:
碳原子为sp杂化,形成2个sp杂化轨道。
(2)成键方式和空间构型:
每个碳原子的sp杂化轨道分别与1个氢原子的1s轨道形成2个C-Hσ键(sp—s),与另一个碳原子的sp杂化轨道形成C-Cσ键(sp—sp)。
碳原子未杂化的2p轨道两两形成2个π键。
乙炔分子的空间构型为直线形。
(3) C≡C、C≡N、CO2中的碳原子,都是sp杂化。
H2O分子的空间构型
(1)杂化轨道类型:
O原子上的1个2s轨道与3个2p轨道混合,形成4个sp3化轨道,杂化轨道的空间构型是正四面体形。
(2)成键情况:
O原子的2个sp3杂化轨道分别与H原子的1s轨道重叠,形成2个σ键,2对孤电子对没有参加成键。
(3)空间构型:
由于孤电子对—成键电子对的排斥作用>成键电子对—成键电子对作用,使键角小于109°28'。H2O分子的空间构型为V形,键角为104°30'。
NH3分子的空间构型
(1)杂化轨道类型:
N原子上的1个2s轨道与3个2p轨道混合,形成4个sp3杂化轨道,该杂化轨道的空间构型是正四面体形。
(2)成键情况:
N原子的3个sp3杂化轨道分别与H原子的1s轨道重叠,形成3个σ键,1对孤电子对没有参加成键。
(3)空间构型:
NH3分子的空间构型为三角锥形,键角为107°18'。
杂化轨道及成键规律
(1)当杂化轨道数目等于成键轨道数目时,杂化轨道全部参与成键,成键类型是σ键,分子的空间构型与杂化轨道的空间构型一致。
(2)当杂化轨道数目大于成键轨道数目时,分子中存在孤电子对,对成键电子对产生排斥作用,使键角增大,分子的空间构型与杂化轨道的空间构型不同。
(3)若未杂化的轨道上有成单电子,则形成π键。
课堂小结
PART 03
乙烷、乙烯、乙炔分子成键情况
杂化轨道理论要点
2
1
杂化轨道理论
H2O、NH3分子的空间构型
3
杂化过程
杂化轨道
共价键的形成
类型
空间结构
成键方式
分子的空间结构
课堂练习
PART 04
1.下列说法错误的是( )
A.ⅠA族元素成键时不可能有杂化轨道
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和1个C原子的2p轨道混合起来而形成的
C.孤电子对有可能参加杂化
D.s轨道和p轨道杂化不可能出现sp4杂化
B
2.氮的最高价氧化物为无色晶体,它由和构成,已知其阴离子结构为平面三角形,阳离子中氮的杂化方式为sp,则其阳离子的结构和阴离子中氮的杂化方式为( )
A.直线形 sp2 B.V形 sp
C.平面三角形 sp2 D.平面三角形 sp3
A
A
4.化合物A是一种新型锅炉水除氧剂,其结构式如图所示:
下列说法正确的是( )
A.碳、氮原子的杂化类型相同
B.氮原子与碳原子分别为sp3杂化与sp2杂化
C.1 mol A分子中所含σ键的数目为10NA
D.编号为a的氮原子和与其成键的另外三个原子在同一平面内
B
Thanks
好好学习天天向上
