4.1.1 单糖(教学课件)(共22张PPT)_高中化学人教版(2019)人教版选择性必修三
文档属性
| 名称 | 4.1.1 单糖(教学课件)(共22张PPT)_高中化学人教版(2019)人教版选择性必修三 |  | |
| 格式 | pptx | ||
| 文件大小 | 59.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-08 08:21:45 | ||
图片预览








文档简介
(共22张PPT)
4.1.1 单糖
核心素养目标
宏观辨识与微观探析
能从宏观上认识单糖的典型物理性质,如葡萄糖、果糖的颜色、状态、溶解性等。
从微观层面理解单糖的分子结构,包括官能团(羟基、醛基或羰基)的种类与位置,以及结构对性质的影响。例如,能依据葡萄糖的醛基结构,解释其可发生银镜反应的原因。
证据推理与模型认知
通过对单糖化学性质实验现象的观察与分析,如葡萄糖与新制氢氧化铜悬浊液反应产生砖红色沉淀,推理出单糖具有还原性等性质。
构建单糖的结构模型,利用模型解释单糖的同分异构现象,如葡萄糖和果糖互为同分异构体,其结构差异导致性质有所不同。
科学态度与社会责任
认识到单糖在生命活动中的重要作用,如葡萄糖是人体重要的供能物质,培养学生关注化学与生命科学的联系。
了解单糖在食品、医药等行业的应用,同时认识到合理摄入糖类物质对健康的重要性,增强学生的社会责任感。
学习重难点
重点
单糖的结构,尤其是葡萄糖和果糖的结构简式,以及它们官能团的特点。
单糖的化学性质,如氧化反应(包括与银氨溶液、新制氢氧化铜悬浊液的反应)、还原反应等。
单糖在生物体内的作用,如葡萄糖的氧化供能过程。
难点
理解单糖的环状结构,以及环状结构与链状结构之间的相互转化,这需要学生具备较强的空间想象能力。
从分子结构角度深入理解单糖的化学性质,以及不同单糖性质差异的本质原因。例如,虽然葡萄糖和果糖都能发生银镜反应,但反应机理因结构不同而有所区别。
课前导入
在日常生活中,我们都有过这样的体验:当我们剧烈运动后,会感到浑身乏力、疲惫不堪,这时如果喝上一杯含糖的饮料,很快就会恢复一些体力。那大家知道这是为什么吗?
这其中的关键物质就是糖类,而今天我们要深入学习糖类中的重要成员 —— 单糖。大家想想,我们平时吃的水果,像苹果、葡萄,吃起来甜甜的,这里面就含有丰富的单糖。那这些单糖到底是什么样的物质,它们具有怎样独特的结构和性质,又在我们的生命活动中扮演着怎样至关重要的角色呢?
糖类的组成和分类
PART 01
1.糖类的组成和分类
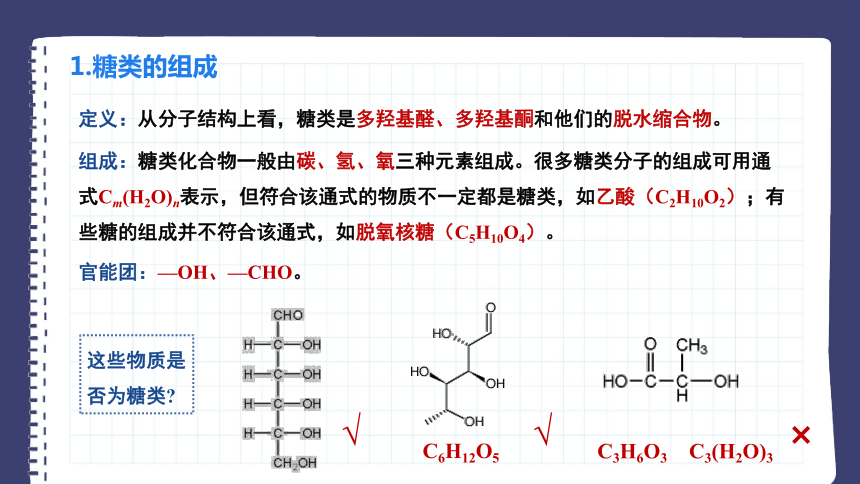
1.糖类的组成
定义:从分子结构上看,糖类是多羟基醛、多羟基酮和他们的脱水缩合物。
组成:糖类化合物一般由碳、氢、氧三种元素组成。很多糖类分子的组成可用通式Cm(H2O)n表示,但符合该通式的物质不一定都是糖类,如乙酸(C2H10O2);有些糖的组成并不符合该通式,如脱氧核糖(C5H10O4)。
官能团:—OH、—CHO。
这些物质是否为糖类
C6H12O5
C3H6O3
C3(H2O)3
√
√
×
2.糖类的分类
糖类
单糖
寡糖
多糖
通常将不能水解的糖称为单糖,如葡萄糖、果糖、核糖和脱氧核糖等。
1mol糖水解后能产生2~10mol单糖的称为寡糖或低聚糖。其中,能水解成2mol单糖的称为二糖,常见的二糖有蔗糖、麦芽糖和乳糖等。
1mol糖水解后能产生10mol以上单糖的称为多糖。如淀粉、纤维素和糖原等。
单糖
PART 02
1.葡萄糖和果糖
葡萄糖 果糖
存在
物理性质
用途
葡萄糖是自然界中分布最广的单糖。葡萄糖存在于水果、蜂蜜,以及植物的种子、叶、根、花中。动物的血液和淋巴液中也含有葡萄糖。
无色晶体,易溶于水,熔点为146℃,有甜味,但甜度不如蔗糖。
①重要的营养物质,在食品和医药工业中有广泛的应用。②人体能量的主要来源,经酶的催化发生氧化反应放出热量,提供维持生命活动所需要的能量:
C6H12O6+6O2 6CO2+6H2O
酶
果糖在水果和蜂蜜中含量较高。
无色晶体,易溶于水,吸湿性强,比蔗糖的甜度高。
广泛应用于食品和医药的生产中。
1.葡萄糖和果糖
葡萄糖的组成及结构:
①分子式:
C6H12O6
—OH、—CHO
②结构简式:
③官能团:
CH2-CH-CH-CH-CH-CHO
OH
丨
丨
丨
丨
丨
OH
OH
OH
OH
C6H12O6
果糖的组成及结构:
①分子式:
②结构简式:
—OH、—C—O
=
O
CH2-CH-CH-CH-C-CH2
OH
丨
丨
丨
丨
丨
OH
OH
OH
OH
O
=
③官能团:
2.葡萄糖的化学性质
葡萄糖分子含有—CHO和—OH,具有醇和醛的化学性质,可以发生氧化反应、还原(加成)反应和酯化反应等。
① 与羟基有关的反应。
能与羧酸发生酯化反应;
能被酸性KMnO4溶液、酸性K2Cr2O7溶液氧化、能被催化氧化;
能与HX发生取代反应;
能与活泼金属发生置换反应;
一定条件下可发生消去反应等。
② 与醛基有关的反应。
能被新制氢氧化铜、银氨溶液等弱氧化剂氧化;
能发生加氢还原
能发生加成反应(HCN等)
2.葡萄糖的化学性质
尝试写出葡萄糖发生加氢还原和酯化反应的方程式。
CH2OH -(CHOH)4 - CH2OH
CH2OH -(CHOH)4- CHO + H2
催化剂
加热
+
5CH3COOH
CHO
(CHOH )4
CH2OH
CHO
(CHOOCCH 3) 4
CH2OOCCH3
5H2O
+
浓H2SO4
△
(1)在一支洁净的试管中配制约2mL银氨溶液,加入1 mL 10%葡萄糖溶液,振荡,然后在水浴中加热。观察实验现象。
(2)在另一支试管中加入2 mL 10% NaOH溶液,加入5滴5% CuSO4溶液,再加入2 mL 10%葡萄糖溶液,加热。观察实验现象。
【实验探究】
2.葡萄糖的化学性质
实验操作
实验现象
实验结论 化学方程式 试管内壁出现光亮的银镜
生成砖红色沉淀
葡萄糖(C6H12O6)分子中含有醛基,属于醛糖,有还原性,属于还原糖
CH2OH(CHOH)4CHO + 2Cu(OH)2 +NaOH
Δ
CH2OH(CHOH)4COONa
+ Cu2O ↓+ 3H2O
2Ag(NH3)2OH + CH2OH(CHOH)4CHO 2Ag↓
Δ
+CH2OH(CHOH)4COONH4+3NH3↑+H2O
2.葡萄糖的化学性质
① 为保证实验现象明显,操作中所使用的试管必须洁净。试管最好先用NaOH溶液清洗,再用水清洗。
② 银氨溶液和Cu(OH)2必须现用现制。反应混合液应及时处理,不可久置。生成的银镜可用少量硝酸去除
③向新制Cu(OH)2中加入2 mL 10%葡萄糖溶液时可观察到绛蓝色的澄清溶液,这是由于多羟基有机化合物遇到新制Cu(OH)2会形成绛蓝色配合物。该现象也可作为葡萄糖分子结构中存在多个羟基官能团的实验证据之一。
葡萄糖分子中的醛基能被新制Cu(OH)2和银氨溶液等弱氧化剂氧化成羧基。葡萄糖是一种还原性糖。
注意事项:
实验结论:
2.葡萄糖的化学性质
葡萄糖在体内氧化,为生理活动提供能量
有氧时的氧化反应
C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l)
无氧分解生成乳酸
酶
CH2OH(CHOH)4CHO 2CH3CH(OH)COOH
C6H12O6
2C2H5OH+2CO2↑
酒化酶
分解生成乙醇(酿酒)
2.葡萄糖的化学性质
葡萄糖的环状结构
α D 吡喃葡萄糖
链状葡萄糖
β D 吡喃葡萄糖
葡萄糖分子中的醛基可以与分子内的羟基作用,形成两种六元环状结构。在葡萄糖水溶液中,存在着链状和环状结构葡萄糖之间的平衡,其中绝大部分葡萄糖为环状结构。很多单糖,以及寡糖和多糖中的单糖单元多以环状结构的形式存在。
3. 核糖 脱氧核糖
核糖与脱氧核糖分别是生物体的遗传物质核糖核酸(RNA)与脱氧核糖核酸(DNA)的重要组成部分。
H—C—OH
—
H—C—OH
—
H—C—OH
—
H2C—OH
C
—
—
H
‖
O
H—C—H
—
H—C—OH
—
H—C—OH
—
H2C—OH
C
—
—
H
‖
O
核糖:C5H10O5
脱氧核糖:C5H10O4
二者都含有醛基,均属于醛糖,均具有还原性,属于还原糖。
4.糖类分子与手性
(1)最简单的醛糖是丙醛糖,又称甘油醛,其结构简式为: 。
(2)连有4个不同的原子或原子团的碳原子叫做不对称碳原子,也叫手性碳原子,如甘油醛分子中注*号的碳原子。
(3)有手性碳原子的分子存在对映异构体。人们把这样的分子称为手性分子。
L-甘油醛
D-甘油醛
随堂训练
(1)所有的糖都有甜味,在分子组成上均满足Cm(H2O)n。 ( )
(2)所有糖类均可以发生水解反应。 ( )
(3)蔗糖与麦芽糖互称同分异构体,二者的水解产物不完全相同。
( )
(4)淀粉、纤维素均为天然高分子,且二者互为同分异构体。 ( )
(5)淀粉、纤维素均是人类重要的营养物质。 ( )
(6)葡萄糖能与乙酸发生取代反应或酯化反应。 ( )
1.判断正误。(正确的画“√”,错误的画“×”)
随堂训练
2.核糖是合成核酸的重要原料,结构简式为CH2OH—CHOH—CHOH—CHOH—CHO,下列关于核糖的叙述正确的是
A.与葡萄糖互为同分异构体
B.可与新制的Cu(OH)2反应生成砖红色沉淀
C.不能发生取代反应
D.可以使紫色的石蕊溶液变红
B
谢谢观看
4.1.1 单糖
核心素养目标
宏观辨识与微观探析
能从宏观上认识单糖的典型物理性质,如葡萄糖、果糖的颜色、状态、溶解性等。
从微观层面理解单糖的分子结构,包括官能团(羟基、醛基或羰基)的种类与位置,以及结构对性质的影响。例如,能依据葡萄糖的醛基结构,解释其可发生银镜反应的原因。
证据推理与模型认知
通过对单糖化学性质实验现象的观察与分析,如葡萄糖与新制氢氧化铜悬浊液反应产生砖红色沉淀,推理出单糖具有还原性等性质。
构建单糖的结构模型,利用模型解释单糖的同分异构现象,如葡萄糖和果糖互为同分异构体,其结构差异导致性质有所不同。
科学态度与社会责任
认识到单糖在生命活动中的重要作用,如葡萄糖是人体重要的供能物质,培养学生关注化学与生命科学的联系。
了解单糖在食品、医药等行业的应用,同时认识到合理摄入糖类物质对健康的重要性,增强学生的社会责任感。
学习重难点
重点
单糖的结构,尤其是葡萄糖和果糖的结构简式,以及它们官能团的特点。
单糖的化学性质,如氧化反应(包括与银氨溶液、新制氢氧化铜悬浊液的反应)、还原反应等。
单糖在生物体内的作用,如葡萄糖的氧化供能过程。
难点
理解单糖的环状结构,以及环状结构与链状结构之间的相互转化,这需要学生具备较强的空间想象能力。
从分子结构角度深入理解单糖的化学性质,以及不同单糖性质差异的本质原因。例如,虽然葡萄糖和果糖都能发生银镜反应,但反应机理因结构不同而有所区别。
课前导入
在日常生活中,我们都有过这样的体验:当我们剧烈运动后,会感到浑身乏力、疲惫不堪,这时如果喝上一杯含糖的饮料,很快就会恢复一些体力。那大家知道这是为什么吗?
这其中的关键物质就是糖类,而今天我们要深入学习糖类中的重要成员 —— 单糖。大家想想,我们平时吃的水果,像苹果、葡萄,吃起来甜甜的,这里面就含有丰富的单糖。那这些单糖到底是什么样的物质,它们具有怎样独特的结构和性质,又在我们的生命活动中扮演着怎样至关重要的角色呢?
糖类的组成和分类
PART 01
1.糖类的组成和分类
1.糖类的组成
定义:从分子结构上看,糖类是多羟基醛、多羟基酮和他们的脱水缩合物。
组成:糖类化合物一般由碳、氢、氧三种元素组成。很多糖类分子的组成可用通式Cm(H2O)n表示,但符合该通式的物质不一定都是糖类,如乙酸(C2H10O2);有些糖的组成并不符合该通式,如脱氧核糖(C5H10O4)。
官能团:—OH、—CHO。
这些物质是否为糖类
C6H12O5
C3H6O3
C3(H2O)3
√
√
×
2.糖类的分类
糖类
单糖
寡糖
多糖
通常将不能水解的糖称为单糖,如葡萄糖、果糖、核糖和脱氧核糖等。
1mol糖水解后能产生2~10mol单糖的称为寡糖或低聚糖。其中,能水解成2mol单糖的称为二糖,常见的二糖有蔗糖、麦芽糖和乳糖等。
1mol糖水解后能产生10mol以上单糖的称为多糖。如淀粉、纤维素和糖原等。
单糖
PART 02
1.葡萄糖和果糖
葡萄糖 果糖
存在
物理性质
用途
葡萄糖是自然界中分布最广的单糖。葡萄糖存在于水果、蜂蜜,以及植物的种子、叶、根、花中。动物的血液和淋巴液中也含有葡萄糖。
无色晶体,易溶于水,熔点为146℃,有甜味,但甜度不如蔗糖。
①重要的营养物质,在食品和医药工业中有广泛的应用。②人体能量的主要来源,经酶的催化发生氧化反应放出热量,提供维持生命活动所需要的能量:
C6H12O6+6O2 6CO2+6H2O
酶
果糖在水果和蜂蜜中含量较高。
无色晶体,易溶于水,吸湿性强,比蔗糖的甜度高。
广泛应用于食品和医药的生产中。
1.葡萄糖和果糖
葡萄糖的组成及结构:
①分子式:
C6H12O6
—OH、—CHO
②结构简式:
③官能团:
CH2-CH-CH-CH-CH-CHO
OH
丨
丨
丨
丨
丨
OH
OH
OH
OH
C6H12O6
果糖的组成及结构:
①分子式:
②结构简式:
—OH、—C—O
=
O
CH2-CH-CH-CH-C-CH2
OH
丨
丨
丨
丨
丨
OH
OH
OH
OH
O
=
③官能团:
2.葡萄糖的化学性质
葡萄糖分子含有—CHO和—OH,具有醇和醛的化学性质,可以发生氧化反应、还原(加成)反应和酯化反应等。
① 与羟基有关的反应。
能与羧酸发生酯化反应;
能被酸性KMnO4溶液、酸性K2Cr2O7溶液氧化、能被催化氧化;
能与HX发生取代反应;
能与活泼金属发生置换反应;
一定条件下可发生消去反应等。
② 与醛基有关的反应。
能被新制氢氧化铜、银氨溶液等弱氧化剂氧化;
能发生加氢还原
能发生加成反应(HCN等)
2.葡萄糖的化学性质
尝试写出葡萄糖发生加氢还原和酯化反应的方程式。
CH2OH -(CHOH)4 - CH2OH
CH2OH -(CHOH)4- CHO + H2
催化剂
加热
+
5CH3COOH
CHO
(CHOH )4
CH2OH
CHO
(CHOOCCH 3) 4
CH2OOCCH3
5H2O
+
浓H2SO4
△
(1)在一支洁净的试管中配制约2mL银氨溶液,加入1 mL 10%葡萄糖溶液,振荡,然后在水浴中加热。观察实验现象。
(2)在另一支试管中加入2 mL 10% NaOH溶液,加入5滴5% CuSO4溶液,再加入2 mL 10%葡萄糖溶液,加热。观察实验现象。
【实验探究】
2.葡萄糖的化学性质
实验操作
实验现象
实验结论 化学方程式 试管内壁出现光亮的银镜
生成砖红色沉淀
葡萄糖(C6H12O6)分子中含有醛基,属于醛糖,有还原性,属于还原糖
CH2OH(CHOH)4CHO + 2Cu(OH)2 +NaOH
Δ
CH2OH(CHOH)4COONa
+ Cu2O ↓+ 3H2O
2Ag(NH3)2OH + CH2OH(CHOH)4CHO 2Ag↓
Δ
+CH2OH(CHOH)4COONH4+3NH3↑+H2O
2.葡萄糖的化学性质
① 为保证实验现象明显,操作中所使用的试管必须洁净。试管最好先用NaOH溶液清洗,再用水清洗。
② 银氨溶液和Cu(OH)2必须现用现制。反应混合液应及时处理,不可久置。生成的银镜可用少量硝酸去除
③向新制Cu(OH)2中加入2 mL 10%葡萄糖溶液时可观察到绛蓝色的澄清溶液,这是由于多羟基有机化合物遇到新制Cu(OH)2会形成绛蓝色配合物。该现象也可作为葡萄糖分子结构中存在多个羟基官能团的实验证据之一。
葡萄糖分子中的醛基能被新制Cu(OH)2和银氨溶液等弱氧化剂氧化成羧基。葡萄糖是一种还原性糖。
注意事项:
实验结论:
2.葡萄糖的化学性质
葡萄糖在体内氧化,为生理活动提供能量
有氧时的氧化反应
C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l)
无氧分解生成乳酸
酶
CH2OH(CHOH)4CHO 2CH3CH(OH)COOH
C6H12O6
2C2H5OH+2CO2↑
酒化酶
分解生成乙醇(酿酒)
2.葡萄糖的化学性质
葡萄糖的环状结构
α D 吡喃葡萄糖
链状葡萄糖
β D 吡喃葡萄糖
葡萄糖分子中的醛基可以与分子内的羟基作用,形成两种六元环状结构。在葡萄糖水溶液中,存在着链状和环状结构葡萄糖之间的平衡,其中绝大部分葡萄糖为环状结构。很多单糖,以及寡糖和多糖中的单糖单元多以环状结构的形式存在。
3. 核糖 脱氧核糖
核糖与脱氧核糖分别是生物体的遗传物质核糖核酸(RNA)与脱氧核糖核酸(DNA)的重要组成部分。
H—C—OH
—
H—C—OH
—
H—C—OH
—
H2C—OH
C
—
—
H
‖
O
H—C—H
—
H—C—OH
—
H—C—OH
—
H2C—OH
C
—
—
H
‖
O
核糖:C5H10O5
脱氧核糖:C5H10O4
二者都含有醛基,均属于醛糖,均具有还原性,属于还原糖。
4.糖类分子与手性
(1)最简单的醛糖是丙醛糖,又称甘油醛,其结构简式为: 。
(2)连有4个不同的原子或原子团的碳原子叫做不对称碳原子,也叫手性碳原子,如甘油醛分子中注*号的碳原子。
(3)有手性碳原子的分子存在对映异构体。人们把这样的分子称为手性分子。
L-甘油醛
D-甘油醛
随堂训练
(1)所有的糖都有甜味,在分子组成上均满足Cm(H2O)n。 ( )
(2)所有糖类均可以发生水解反应。 ( )
(3)蔗糖与麦芽糖互称同分异构体,二者的水解产物不完全相同。
( )
(4)淀粉、纤维素均为天然高分子,且二者互为同分异构体。 ( )
(5)淀粉、纤维素均是人类重要的营养物质。 ( )
(6)葡萄糖能与乙酸发生取代反应或酯化反应。 ( )
1.判断正误。(正确的画“√”,错误的画“×”)
随堂训练
2.核糖是合成核酸的重要原料,结构简式为CH2OH—CHOH—CHOH—CHOH—CHO,下列关于核糖的叙述正确的是
A.与葡萄糖互为同分异构体
B.可与新制的Cu(OH)2反应生成砖红色沉淀
C.不能发生取代反应
D.可以使紫色的石蕊溶液变红
B
谢谢观看
