3.4.1 羧酸(教学课件)(共27张PPT)_高中化学人教版(2019)人教版选择性必修三
文档属性
| 名称 | 3.4.1 羧酸(教学课件)(共27张PPT)_高中化学人教版(2019)人教版选择性必修三 |  | |
| 格式 | pptx | ||
| 文件大小 | 31.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-08 08:25:53 | ||
图片预览





文档简介
(共27张PPT)
3.4.1 羧酸
核心素养目标
宏观辨识与微观探析
能从宏观上认识羧酸的典型物理性质和化学性质,如乙酸具有酸性、能发生酯化反应;从微观角度理解羧基的结构对其性质的影响,如羧基中羰基和羟基的相互作用决定了羧酸的特性。
证据推理与模型认知
通过实验探究羧酸的性质,如用实验证明乙酸的酸性比碳酸强,依据实验现象进行推理,构建羧酸性质的认知模型。
科学态度与社会责任
了解羧酸在生活和生产中的应用,如乙酸用于食品调味、苯甲酸用于食品防腐等,认识化学物质对人类生活的影响,树立合理使用化学物质的科学态度和社会责任 。
学习重难点
重点
羧酸的结构特点,尤其是羧基的结构,这是理解羧酸性质的基础。
羧酸的酸性及酯化反应的原理和规律,如酯化反应中酸脱羟基醇脱氢的断键方式。
乙酸的性质,它是羧酸的典型代表物,掌握乙酸的性质有助于理解其他羧酸的共性。
难点
酯化反应的机理,理解反应中化学键的断裂和形成过程较为抽象。
羧酸与其他有机物之间的相互转化关系,如醇、醛、羧酸、酯之间的转化,涉及多种反应类型和条件。
课前导入
羧酸的基本知识
PART 01
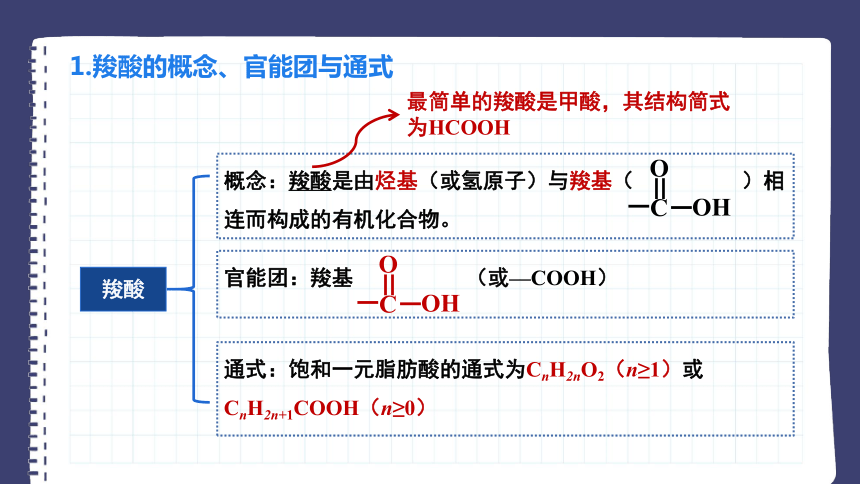
1.羧酸的概念、官能团与通式
羧酸
概念:羧酸是由烃基(或氢原子)与羧基( )相连而构成的有机化合物。
C
O
OH
官能团:羧基 (或—COOH)
C
O
OH
通式:饱和一元脂肪酸的通式为CnH2nO2(n≥1)或CnH2n+1COOH(n≥0)
最简单的羧酸是甲酸,其结构简式为HCOOH
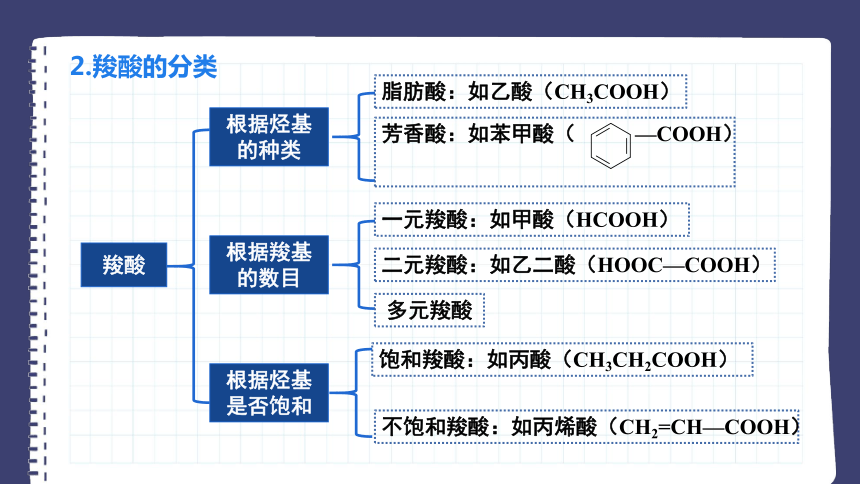
2.羧酸的分类
羧酸
根据烃基的种类
根据羧基的数目
根据烃基是否饱和
脂肪酸:如乙酸(CH3COOH)
芳香酸:如苯甲酸( —COOH)
一元羧酸:如甲酸(HCOOH)
二元羧酸:如乙二酸(HOOC—COOH)
多元羧酸
饱和羧酸:如丙酸(CH3CH2COOH)
不饱和羧酸:如丙烯酸(CH2=CH—COOH)
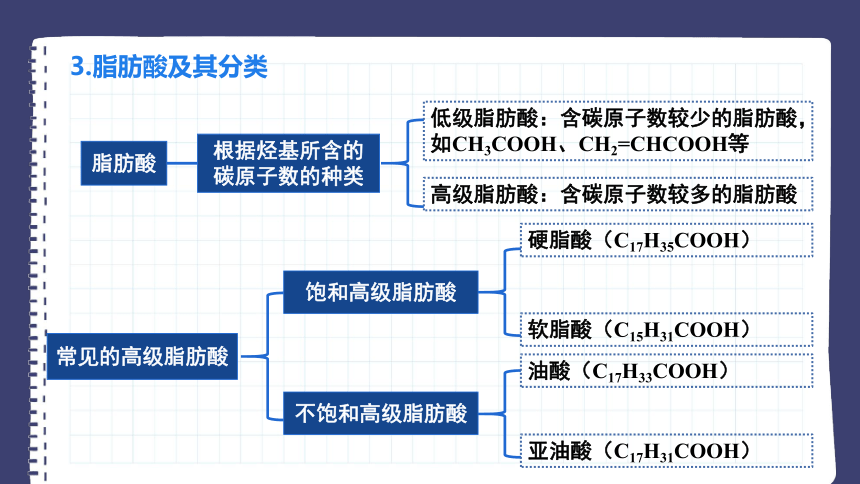
3.脂肪酸及其分类
脂肪酸
根据烃基所含的碳原子数的种类
低级脂肪酸:含碳原子数较少的脂肪酸,如CH3COOH、CH2=CHCOOH等
高级脂肪酸:含碳原子数较多的脂肪酸
常见的高级脂肪酸
饱和高级脂肪酸
不饱和高级脂肪酸
硬脂酸(C17H35COOH)
软脂酸(C15H31COOH)
油酸(C17H33COOH)
亚油酸(C17H31COOH)
羧酸的性质
PART 02
1.羧酸的物理性质
物理性质 规律 举例
水溶性 分子中碳原子数较少的羧酸能够与水互溶 (低级脂肪酸分子与水分子间形成氢键) 甲酸、乙酸、乙二酸
随着分子中碳原子数的增加 (烃基(亲油基团)所占比例逐渐增大) 一元羧酸在水中的溶解度迅速减小,甚至不溶于水。 高级脂肪酸是不溶于水的蜡状固体
沸点 随着分子中碳原子数的增加,一元羧酸的沸点逐渐升高,且高于相对分子质量相近的醇的沸点 丙酸>乙酸>甲酸
2.羧酸的化学性质
羧酸的化学性质主要取决于羧基官能团。由于受氧原子电负性较大等因素的影响,羧基中C—O和O—H的极性均较强,容易断裂而发生化学反应:
C=O
H—O
δ
δ+
羧酸表现出酸性
发生取代反应,生成酯、酰胺等羧酸衍生物。
2.羧酸的化学性质
(1)酸性
【实验探究】相同浓度的甲酸溶液、 苯甲酸溶液、乙二酸溶液、试管、紫色石蕊试剂、酚酞、 pH试纸、铝片、10%NaOH溶液、10%NaHCO3溶液、CaO等。
试验方案 实验试剂 实验现象 实验结论
方案1:指示剂遇酸变色
方案2:用pH试纸测定羧酸溶液的pH
方案3:酸与活泼金属反应产生H2
甲酸 紫色石蕊试剂
紫色石蕊溶液变红
甲酸有酸性
苯甲酸 pH试纸
pH试纸显红色
苯甲酸有酸性
乙二酸 金属铝
有气泡产生
乙二酸有酸性
2.羧酸的化学性质
【实验探究2】乙酸、碳酸和苯酚酸性强弱
利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,比较乙酸、碳酸和苯酚的酸性强弱。
注:D、E、F、G分别是双孔橡胶塞上的孔
2.羧酸的化学性质
实验装置
实验现象
实验结论
B中:有气泡产生 C中:溶液变浑浊
酸性:乙酸>碳酸>苯酚
除CO2中的乙酸
乙酸具有挥发性,挥发出的乙酸可能会与苯酚钠反应,影响碳酸与苯酚酸性强弱的对比。
2.羧酸的化学性质
(1)羧基由羰基和羟基构成,由于二者之间的相互影响,羧基上的氢原子比醇羟基上的氢原子易电离,因此羧酸具有酸性,其酸性通常强于碳酸。
(2)随着分子中碳原子数的增加,羧酸的酸性逐渐减弱。
(3)随着羧基数目的增加,羧酸的酸性逐渐增强。如酸性:乙二酸>乙酸。几种常见的酸性物质的酸性比较:乙二酸>甲酸>乙酸>丙酸>碳酸>苯酚。
基团之间的相互影响使得羧酸的化学性质并不是羧基和羟基具有的化学性质的简单加和。
烷基是推电子基团,烷基越长,推电子效应越大,使羧基中O—H的极性减弱,羧酸的酸性减弱。
2.羧酸的化学性质
(2)酯化反应—(取代反应)
CH3 C O C2H5 + H2O
=
O
CH3 C O H +H O C2H5
浓H2SO4
=
O
CH3 C O C2H5 + H2O
=
O
CH3 C O H +H O C2H5
浓H2SO4
=
O
乙酸和乙醇的酯化反应,从形式上看是羧基与羟基之间脱去一个水分子。脱水时有以上两种可能的方式,你能证明是哪一种吗?
2.羧酸的化学性质
CH3 C 18O C2H5 + H2O
=
O
CH3 C O H+H 18O C2H5
浓H2SO4
=
O
CH3 C O C2H5 + H218O
=
O
CH3 C O H +H 18O C2H5
浓H2SO4
=
O
使用同位素示踪法,将乙醇中的O用18O进行标记,证实了乙酸与乙醇的酯化反应是乙酸分子中羧基的羟基与乙醇分子中羟基的氢原子结合成水,其余部分相互结合成酯。即为第一种脱水方式:酸脱羟基醇脱氢。
2.羧酸的化学性质
(3)酸和醇酯化反应的类型
CH3COOH + H18OCH3
①一元羧酸与一元醇。如:
②一元羧酸与二元醇或多元醇。如:
浓硫酸
浓硫酸
浓硫酸
二乙酸乙二酯
2
CH3CO18OCH3 + H2O
2.羧酸的化学性质
(3)酸和醇酯化反应的类型
③一元醇与多元羧酸分子间脱水形成酯
+ C2H5OH
COOH
COOH
2
浓硫酸
COOC2H5
COOC2H5
+ 2H2O
乙二酸二乙酯
④多元羧酸与多元醇之间的脱水反应
生成普通酯:
COOH
COOH
CH2OH
CH2OH
+
浓硫酸
+ H2O
HOOC—COOCH2CH2OH
生成环酯:
COOH
COOH
CH2OH
CH2OH
+
浓硫酸
环乙二酸乙二酯
乙二酸(单)乙二酯
2.羧酸的化学性质
(3)酸和醇酯化反应的类型
⑤羟基酸自身的脱水反应—两种情况:生成普通酯、环状酯
浓硫酸
浓硫酸
浓硫酸
2
CH3CHCOOH
OH
(乳酸)
CH3CHCOOH
OH
CH3CHCOOH
OH
2
2.羧酸的化学性质
(3)酸和醇酯化反应的类型
⑥无机酸与醇的酯化反应
CH2 - OH
CH2 - OH
CH - OH
+ 3HO-NO2
浓硫酸
CH2 - ONO2
CH2 - ONO2
CH - ONO2
+ 3H2O
硝酸甘油酯
3.常见的羧酸
醛基
羧基
酸性,酯化反应
HCOOH
甲酸是一种无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶。
羧基
醛基
具有还原性,氧化反应(如银镜反应)
工业上作还原剂,也是合成医药、农药和染料等的原料。
(1)甲酸(蚁酸)
H—C—O—H
O
用途:
【思考】如何鉴别甲酸和乙酸
利用银氨溶液或新制的氢氧化铜。
2.羧酸的化学性质
(2)苯甲酸(安息香酸)
苯甲酸是一种无色晶体,易升华,微溶于水,易溶于乙醇。苯甲酸可以用于合成香料、药物等,它的钠盐或钾盐是常用的食品防腐剂。
乙二酸是最简单的二元羧酸。无色透明晶体,可溶于水和乙醇。通常含有两分子结晶水。常用于化学分析的还原剂,能使酸性高锰酸钾溶液褪色;也是重要的化工原料。
(3)乙二酸(草酸)
COOH
HOOC-COOH
随堂训练
1.判断正误。(正确的画“√”,错误的画“×”)
甲酸、乙酸、苯甲酸均可与钠发生置换反应。 ( )
可以表现为酮和醇的性质。 ( )
乙酸的酸性比H2CO3强,可以溶解石灰石。 ( )
含18O的乙醇与乙酸发生酯化反应生成的H2O中含18O。 ( )
分子式为C4H8O2的羧酸,有3种同分异构体。 ( )
甲苯、乙苯均可被酸性KMnO4氧化为苯甲酸。 ( )
随堂训练
2.某有机物的结构简式如下图所示,等物质的量的该有机化合物分别与Na、NaOH和新制Cu(OH)2充分反应(反应时可加热煮沸),所需Na、NaOH和Cu(OH)2的物质的量之比为( )
A.6∶4∶5
B.1∶1∶1
C.3∶2∶2
D.3∶2∶3
D
随堂训练
3.下列转化中的“X溶液”可以是( )
A.NaOH B.Na2CO3 C.NaHCO3 D.Na
C
谢谢观看
3.4.1 羧酸
核心素养目标
宏观辨识与微观探析
能从宏观上认识羧酸的典型物理性质和化学性质,如乙酸具有酸性、能发生酯化反应;从微观角度理解羧基的结构对其性质的影响,如羧基中羰基和羟基的相互作用决定了羧酸的特性。
证据推理与模型认知
通过实验探究羧酸的性质,如用实验证明乙酸的酸性比碳酸强,依据实验现象进行推理,构建羧酸性质的认知模型。
科学态度与社会责任
了解羧酸在生活和生产中的应用,如乙酸用于食品调味、苯甲酸用于食品防腐等,认识化学物质对人类生活的影响,树立合理使用化学物质的科学态度和社会责任 。
学习重难点
重点
羧酸的结构特点,尤其是羧基的结构,这是理解羧酸性质的基础。
羧酸的酸性及酯化反应的原理和规律,如酯化反应中酸脱羟基醇脱氢的断键方式。
乙酸的性质,它是羧酸的典型代表物,掌握乙酸的性质有助于理解其他羧酸的共性。
难点
酯化反应的机理,理解反应中化学键的断裂和形成过程较为抽象。
羧酸与其他有机物之间的相互转化关系,如醇、醛、羧酸、酯之间的转化,涉及多种反应类型和条件。
课前导入
羧酸的基本知识
PART 01
1.羧酸的概念、官能团与通式
羧酸
概念:羧酸是由烃基(或氢原子)与羧基( )相连而构成的有机化合物。
C
O
OH
官能团:羧基 (或—COOH)
C
O
OH
通式:饱和一元脂肪酸的通式为CnH2nO2(n≥1)或CnH2n+1COOH(n≥0)
最简单的羧酸是甲酸,其结构简式为HCOOH
2.羧酸的分类
羧酸
根据烃基的种类
根据羧基的数目
根据烃基是否饱和
脂肪酸:如乙酸(CH3COOH)
芳香酸:如苯甲酸( —COOH)
一元羧酸:如甲酸(HCOOH)
二元羧酸:如乙二酸(HOOC—COOH)
多元羧酸
饱和羧酸:如丙酸(CH3CH2COOH)
不饱和羧酸:如丙烯酸(CH2=CH—COOH)
3.脂肪酸及其分类
脂肪酸
根据烃基所含的碳原子数的种类
低级脂肪酸:含碳原子数较少的脂肪酸,如CH3COOH、CH2=CHCOOH等
高级脂肪酸:含碳原子数较多的脂肪酸
常见的高级脂肪酸
饱和高级脂肪酸
不饱和高级脂肪酸
硬脂酸(C17H35COOH)
软脂酸(C15H31COOH)
油酸(C17H33COOH)
亚油酸(C17H31COOH)
羧酸的性质
PART 02
1.羧酸的物理性质
物理性质 规律 举例
水溶性 分子中碳原子数较少的羧酸能够与水互溶 (低级脂肪酸分子与水分子间形成氢键) 甲酸、乙酸、乙二酸
随着分子中碳原子数的增加 (烃基(亲油基团)所占比例逐渐增大) 一元羧酸在水中的溶解度迅速减小,甚至不溶于水。 高级脂肪酸是不溶于水的蜡状固体
沸点 随着分子中碳原子数的增加,一元羧酸的沸点逐渐升高,且高于相对分子质量相近的醇的沸点 丙酸>乙酸>甲酸
2.羧酸的化学性质
羧酸的化学性质主要取决于羧基官能团。由于受氧原子电负性较大等因素的影响,羧基中C—O和O—H的极性均较强,容易断裂而发生化学反应:
C=O
H—O
δ
δ+
羧酸表现出酸性
发生取代反应,生成酯、酰胺等羧酸衍生物。
2.羧酸的化学性质
(1)酸性
【实验探究】相同浓度的甲酸溶液、 苯甲酸溶液、乙二酸溶液、试管、紫色石蕊试剂、酚酞、 pH试纸、铝片、10%NaOH溶液、10%NaHCO3溶液、CaO等。
试验方案 实验试剂 实验现象 实验结论
方案1:指示剂遇酸变色
方案2:用pH试纸测定羧酸溶液的pH
方案3:酸与活泼金属反应产生H2
甲酸 紫色石蕊试剂
紫色石蕊溶液变红
甲酸有酸性
苯甲酸 pH试纸
pH试纸显红色
苯甲酸有酸性
乙二酸 金属铝
有气泡产生
乙二酸有酸性
2.羧酸的化学性质
【实验探究2】乙酸、碳酸和苯酚酸性强弱
利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,比较乙酸、碳酸和苯酚的酸性强弱。
注:D、E、F、G分别是双孔橡胶塞上的孔
2.羧酸的化学性质
实验装置
实验现象
实验结论
B中:有气泡产生 C中:溶液变浑浊
酸性:乙酸>碳酸>苯酚
除CO2中的乙酸
乙酸具有挥发性,挥发出的乙酸可能会与苯酚钠反应,影响碳酸与苯酚酸性强弱的对比。
2.羧酸的化学性质
(1)羧基由羰基和羟基构成,由于二者之间的相互影响,羧基上的氢原子比醇羟基上的氢原子易电离,因此羧酸具有酸性,其酸性通常强于碳酸。
(2)随着分子中碳原子数的增加,羧酸的酸性逐渐减弱。
(3)随着羧基数目的增加,羧酸的酸性逐渐增强。如酸性:乙二酸>乙酸。几种常见的酸性物质的酸性比较:乙二酸>甲酸>乙酸>丙酸>碳酸>苯酚。
基团之间的相互影响使得羧酸的化学性质并不是羧基和羟基具有的化学性质的简单加和。
烷基是推电子基团,烷基越长,推电子效应越大,使羧基中O—H的极性减弱,羧酸的酸性减弱。
2.羧酸的化学性质
(2)酯化反应—(取代反应)
CH3 C O C2H5 + H2O
=
O
CH3 C O H +H O C2H5
浓H2SO4
=
O
CH3 C O C2H5 + H2O
=
O
CH3 C O H +H O C2H5
浓H2SO4
=
O
乙酸和乙醇的酯化反应,从形式上看是羧基与羟基之间脱去一个水分子。脱水时有以上两种可能的方式,你能证明是哪一种吗?
2.羧酸的化学性质
CH3 C 18O C2H5 + H2O
=
O
CH3 C O H+H 18O C2H5
浓H2SO4
=
O
CH3 C O C2H5 + H218O
=
O
CH3 C O H +H 18O C2H5
浓H2SO4
=
O
使用同位素示踪法,将乙醇中的O用18O进行标记,证实了乙酸与乙醇的酯化反应是乙酸分子中羧基的羟基与乙醇分子中羟基的氢原子结合成水,其余部分相互结合成酯。即为第一种脱水方式:酸脱羟基醇脱氢。
2.羧酸的化学性质
(3)酸和醇酯化反应的类型
CH3COOH + H18OCH3
①一元羧酸与一元醇。如:
②一元羧酸与二元醇或多元醇。如:
浓硫酸
浓硫酸
浓硫酸
二乙酸乙二酯
2
CH3CO18OCH3 + H2O
2.羧酸的化学性质
(3)酸和醇酯化反应的类型
③一元醇与多元羧酸分子间脱水形成酯
+ C2H5OH
COOH
COOH
2
浓硫酸
COOC2H5
COOC2H5
+ 2H2O
乙二酸二乙酯
④多元羧酸与多元醇之间的脱水反应
生成普通酯:
COOH
COOH
CH2OH
CH2OH
+
浓硫酸
+ H2O
HOOC—COOCH2CH2OH
生成环酯:
COOH
COOH
CH2OH
CH2OH
+
浓硫酸
环乙二酸乙二酯
乙二酸(单)乙二酯
2.羧酸的化学性质
(3)酸和醇酯化反应的类型
⑤羟基酸自身的脱水反应—两种情况:生成普通酯、环状酯
浓硫酸
浓硫酸
浓硫酸
2
CH3CHCOOH
OH
(乳酸)
CH3CHCOOH
OH
CH3CHCOOH
OH
2
2.羧酸的化学性质
(3)酸和醇酯化反应的类型
⑥无机酸与醇的酯化反应
CH2 - OH
CH2 - OH
CH - OH
+ 3HO-NO2
浓硫酸
CH2 - ONO2
CH2 - ONO2
CH - ONO2
+ 3H2O
硝酸甘油酯
3.常见的羧酸
醛基
羧基
酸性,酯化反应
HCOOH
甲酸是一种无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶。
羧基
醛基
具有还原性,氧化反应(如银镜反应)
工业上作还原剂,也是合成医药、农药和染料等的原料。
(1)甲酸(蚁酸)
H—C—O—H
O
用途:
【思考】如何鉴别甲酸和乙酸
利用银氨溶液或新制的氢氧化铜。
2.羧酸的化学性质
(2)苯甲酸(安息香酸)
苯甲酸是一种无色晶体,易升华,微溶于水,易溶于乙醇。苯甲酸可以用于合成香料、药物等,它的钠盐或钾盐是常用的食品防腐剂。
乙二酸是最简单的二元羧酸。无色透明晶体,可溶于水和乙醇。通常含有两分子结晶水。常用于化学分析的还原剂,能使酸性高锰酸钾溶液褪色;也是重要的化工原料。
(3)乙二酸(草酸)
COOH
HOOC-COOH
随堂训练
1.判断正误。(正确的画“√”,错误的画“×”)
甲酸、乙酸、苯甲酸均可与钠发生置换反应。 ( )
可以表现为酮和醇的性质。 ( )
乙酸的酸性比H2CO3强,可以溶解石灰石。 ( )
含18O的乙醇与乙酸发生酯化反应生成的H2O中含18O。 ( )
分子式为C4H8O2的羧酸,有3种同分异构体。 ( )
甲苯、乙苯均可被酸性KMnO4氧化为苯甲酸。 ( )
随堂训练
2.某有机物的结构简式如下图所示,等物质的量的该有机化合物分别与Na、NaOH和新制Cu(OH)2充分反应(反应时可加热煮沸),所需Na、NaOH和Cu(OH)2的物质的量之比为( )
A.6∶4∶5
B.1∶1∶1
C.3∶2∶2
D.3∶2∶3
D
随堂训练
3.下列转化中的“X溶液”可以是( )
A.NaOH B.Na2CO3 C.NaHCO3 D.Na
C
谢谢观看
