3.2 课时2 离子晶体 课件 (共21张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 3.2 课时2 离子晶体 课件 (共21张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-08 09:16:47 | ||
图片预览





文档简介
物质的转化
1.了解几种典型离子晶体的晶胞结构;
2.认识离子晶体的物理性质与晶体结构的关系。
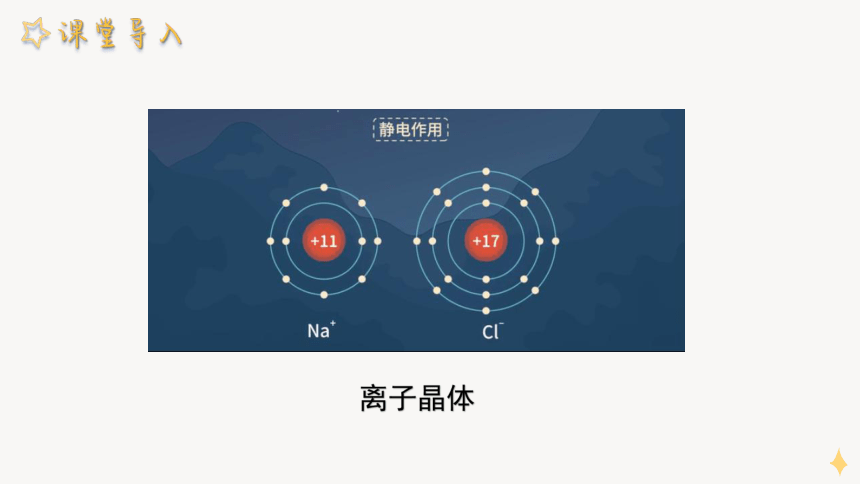
离子晶体
1、概念
离子晶体是阴、阳离子通过离子键在空间中呈现周期性重复排列所形成的晶体。
许多离子晶体(如CuSO4.5H2O)中还存在共价键、氢键。范德华力等。
NaCl晶体
{912C8C85-51F0-491E-9774-3900AFEF0FD7}
用手揉捏食盐
硬度大
生活经验
NaCl的物理性质
炒盐烤盐,未见其熔融
熔点较高(801 oC)
2、性质
①熔沸点较高,硬度较大。
③大多数离子晶体能溶于水,难溶于有机溶剂。
相似相溶,离子晶体极性强
②离子晶体不导电,但溶于水或熔化后能导电
NaCl晶体
常见离子晶体的结构
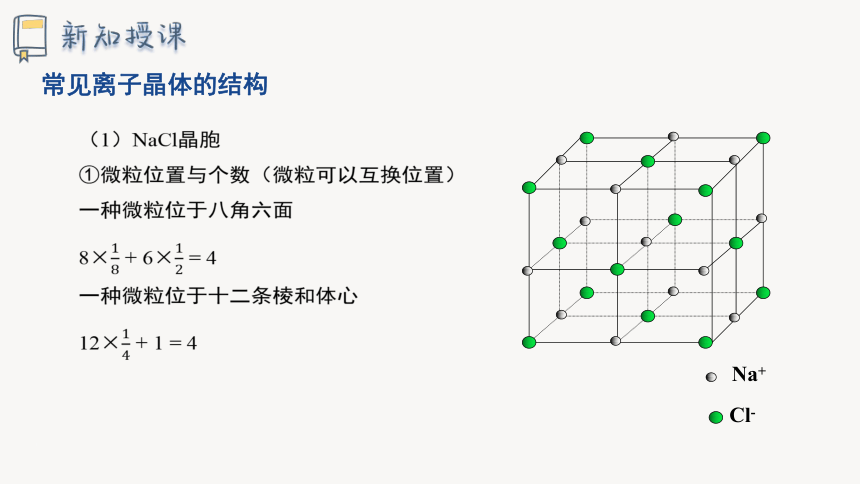
(1)NaCl晶胞
①微粒位置与个数(微粒可以互换位置)
一种微粒位于八角六面
8×18 + 6×12 = 4
一种微粒位于十二条棱和体心
12×14 + 1 = 4
?
Na+
Cl-
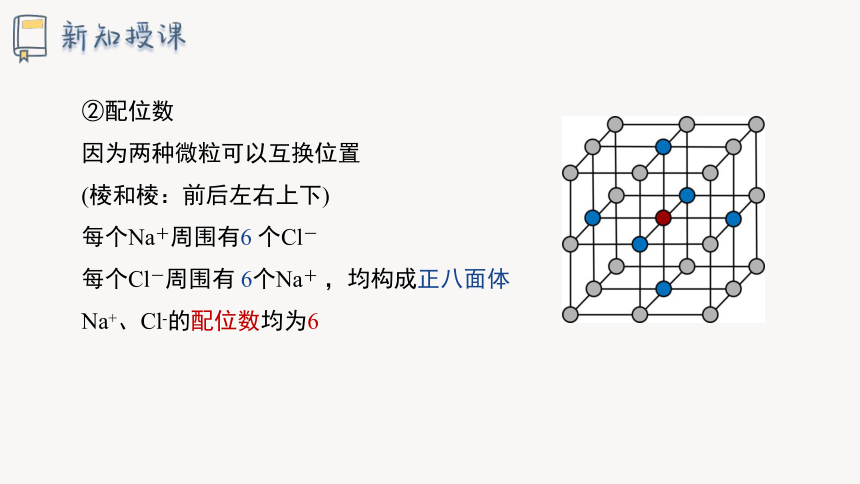
②配位数
因为两种微粒可以互换位置
(棱和棱:前后左右上下)
每个Na+周围有6 个Cl-
每个Cl-周围有 6个Na+ ,均构成正八面体
Na+、Cl-的配位数均为6
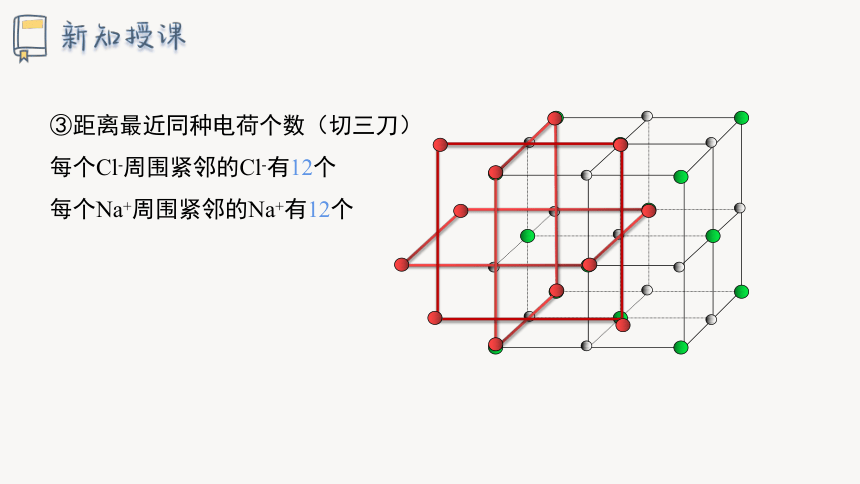
③距离最近同种电荷个数(切三刀)
每个Cl-周围紧邻的Cl-有12个
每个Na+周围紧邻的Na+有12个
常见离子晶体的结构
(2)CsCl晶胞
①微粒位置与个数(微粒可以互换位置)
一种微粒位于八角
8×18 = 1
一种微粒位于体心: 1
?
②配位数
因为两种微粒可以互换位置
每个Cs+周围有8个Cl-
每个Cl-周围有8个Cs+ ,均构成正六面体
Cs+、Cl-的配位数均为8
③距离最近同种电荷个数(前后左右上下)
每个Cl-周围紧邻的Cl-有6个
每个Cs+周围紧邻的Cs+有6个
(3)ZnS晶胞
①微粒位置与个数(微粒可以互换位置)
一种微粒位于八角六面
8×18 + 6×12 = 4
一种微粒位于四个小立方体体心: 4
Zn2+与S2-之间的最短距离
晶胞的体对角线长的 1/4
?
常见离子晶体的结构
②配位数
因为两种微粒可以互换位置
每个Zn2+周围有4个S2-
每个S2-周围有4个Zn2+,均构成正四面体
Zn2+、S2-的配位数均为4
常见离子晶体的结构
(4)CaF2晶胞
①微粒位置与个数
Ca2+位于八角六面
8×18 + 6×12 = 4
F-位于八个小立方体体心: 8
Ca2+与F-之间的最短距离
晶胞的体对角线长的 1/4
?
②配位数
因为两种微粒可以互换位置
每个Ca2+周围有8个F-,构成立方体,配位数为8
每个F-周围有4个Ca2+,构成正四面体,配位数为4
Ca2+
F-
Ca2+
F-
(4)CaF2晶胞
③距离最近同种电荷个数
每个Ca2+周围等距离且紧邻的Ca2+ 有12个
(4)CaF2晶胞
③距离最近同种电荷个数
每个F-周围等距离且紧邻的F-有6个
{2D5ABB26-0587-4C30-8999-92F81FD0307C}晶胞
物质
晶胞中含
有粒子数
Na+
Cl-
Cs+
Cl-
S2-
Zn2+
Ca2+
F-
KCl、NaBr、LiF、CaO、MgO、NiO、CaS等
CsBr、CsI、NH4Cl等
BeO、BeS等
BaF2、PbF2、CeO2等
Na+
Cl-
Cs+
Cl-
S2-
Zn2+
Ca2+
F-
:
:
:
:
:
:
:
:
4
4
1
1
4
4
4
8
1、 氟在自然界中常以CaF2的形式存在,下列表述正确的是( )
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点低于CaCl2
C. 阴、阳离子数目比为2∶1的物质,均具有与CaF2相同的晶胞结构
D. CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
D
2.如图所示,在较高温度时,钾、氧两种元素形成的一种晶体结构与NaCl晶体结构相似,则该化合物的化学式为( )
D
A.K2O
B.K2O2
C.K2O3
D.KO2
1.了解几种典型离子晶体的晶胞结构;
2.认识离子晶体的物理性质与晶体结构的关系。
离子晶体
1、概念
离子晶体是阴、阳离子通过离子键在空间中呈现周期性重复排列所形成的晶体。
许多离子晶体(如CuSO4.5H2O)中还存在共价键、氢键。范德华力等。
NaCl晶体
{912C8C85-51F0-491E-9774-3900AFEF0FD7}
用手揉捏食盐
硬度大
生活经验
NaCl的物理性质
炒盐烤盐,未见其熔融
熔点较高(801 oC)
2、性质
①熔沸点较高,硬度较大。
③大多数离子晶体能溶于水,难溶于有机溶剂。
相似相溶,离子晶体极性强
②离子晶体不导电,但溶于水或熔化后能导电
NaCl晶体
常见离子晶体的结构
(1)NaCl晶胞
①微粒位置与个数(微粒可以互换位置)
一种微粒位于八角六面
8×18 + 6×12 = 4
一种微粒位于十二条棱和体心
12×14 + 1 = 4
?
Na+
Cl-
②配位数
因为两种微粒可以互换位置
(棱和棱:前后左右上下)
每个Na+周围有6 个Cl-
每个Cl-周围有 6个Na+ ,均构成正八面体
Na+、Cl-的配位数均为6
③距离最近同种电荷个数(切三刀)
每个Cl-周围紧邻的Cl-有12个
每个Na+周围紧邻的Na+有12个
常见离子晶体的结构
(2)CsCl晶胞
①微粒位置与个数(微粒可以互换位置)
一种微粒位于八角
8×18 = 1
一种微粒位于体心: 1
?
②配位数
因为两种微粒可以互换位置
每个Cs+周围有8个Cl-
每个Cl-周围有8个Cs+ ,均构成正六面体
Cs+、Cl-的配位数均为8
③距离最近同种电荷个数(前后左右上下)
每个Cl-周围紧邻的Cl-有6个
每个Cs+周围紧邻的Cs+有6个
(3)ZnS晶胞
①微粒位置与个数(微粒可以互换位置)
一种微粒位于八角六面
8×18 + 6×12 = 4
一种微粒位于四个小立方体体心: 4
Zn2+与S2-之间的最短距离
晶胞的体对角线长的 1/4
?
常见离子晶体的结构
②配位数
因为两种微粒可以互换位置
每个Zn2+周围有4个S2-
每个S2-周围有4个Zn2+,均构成正四面体
Zn2+、S2-的配位数均为4
常见离子晶体的结构
(4)CaF2晶胞
①微粒位置与个数
Ca2+位于八角六面
8×18 + 6×12 = 4
F-位于八个小立方体体心: 8
Ca2+与F-之间的最短距离
晶胞的体对角线长的 1/4
?
②配位数
因为两种微粒可以互换位置
每个Ca2+周围有8个F-,构成立方体,配位数为8
每个F-周围有4个Ca2+,构成正四面体,配位数为4
Ca2+
F-
Ca2+
F-
(4)CaF2晶胞
③距离最近同种电荷个数
每个Ca2+周围等距离且紧邻的Ca2+ 有12个
(4)CaF2晶胞
③距离最近同种电荷个数
每个F-周围等距离且紧邻的F-有6个
{2D5ABB26-0587-4C30-8999-92F81FD0307C}晶胞
物质
晶胞中含
有粒子数
Na+
Cl-
Cs+
Cl-
S2-
Zn2+
Ca2+
F-
KCl、NaBr、LiF、CaO、MgO、NiO、CaS等
CsBr、CsI、NH4Cl等
BeO、BeS等
BaF2、PbF2、CeO2等
Na+
Cl-
Cs+
Cl-
S2-
Zn2+
Ca2+
F-
:
:
:
:
:
:
:
:
4
4
1
1
4
4
4
8
1、 氟在自然界中常以CaF2的形式存在,下列表述正确的是( )
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点低于CaCl2
C. 阴、阳离子数目比为2∶1的物质,均具有与CaF2相同的晶胞结构
D. CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
D
2.如图所示,在较高温度时,钾、氧两种元素形成的一种晶体结构与NaCl晶体结构相似,则该化合物的化学式为( )
D
A.K2O
B.K2O2
C.K2O3
D.KO2
