3.2 课时4 分子晶体 混合型晶体 课件 (共26张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 3.2 课时4 分子晶体 混合型晶体 课件 (共26张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-08 00:00:00 | ||
图片预览





文档简介
(共26张PPT)
分子晶体 混合型晶体
1.了解分子晶体的结构特点及性质;
2.知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。
分子晶体是分子通过分子间作用力构成的固态物质。
以共价键结合的物质,除金刚石、晶体硅、二氧化硅等空间网状结构的物质属于共价晶体外,其他多数非金属单质(如H2、Cl2、N2等)、非金属元素组成的无机化合物(如H2O、HCl、CO2等)以及大多数有机化合物在低温下形成的晶体都属于分子晶体。
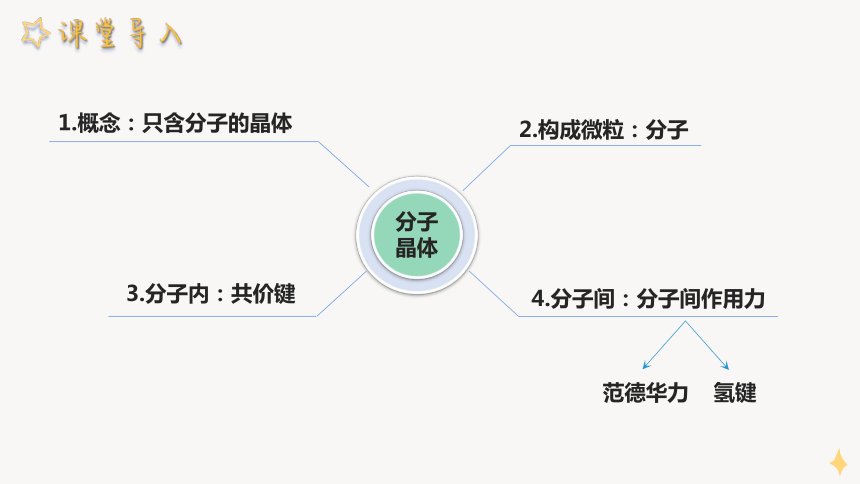
碘晶体
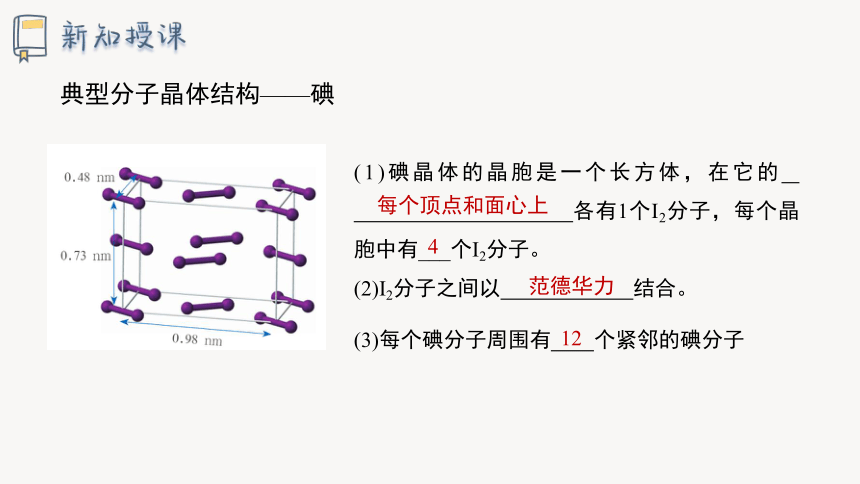
干冰晶体
分子晶体
1.概念:只含分子的晶体
2.构成微粒:分子
3.分子内:共价键
4.分子间:分子间作用力
范德华力
氢键
典型分子晶体结构——碘
(1)碘晶体的晶胞是一个长方体,在它的 各有1个I2分子,每个晶胞中有___个I2分子。
(2)I2分子之间以 结合。
每个顶点和面心上
4
范德华力
(3)每个碘分子周围有 个紧邻的碘分子
12
典型分子晶体结构——干冰
(3)CO2分子之间的作用力 。
(1)晶胞为面心立方体
8个顶点和6个面心上各有一个CO2分子
8×1/8+6×1/2=4
(2)每个晶胞含二氧化碳分子的个数为 。
(4)与每个二氧化碳分子等距离且最近的二氧化碳分子有 。
4
范德华力
12
典型分子晶体结构——冰
(1)水分子之间的主要作用力是 ,当然也存在 。
(2) 有方向性,它的存在迫使在 的每个水分子与____________方向的 个相邻水分子互相吸引。
氢键
范德华力
四面体中心
四面体
顶角
氢键
4
(3)与每个水分子等距离且最近的水分子有 个。
4
总结:分子晶体结构特征
(1)有分子间氢键—分子非密堆积
氢键具有方向性和饱和性,使晶体中的空间利率不高,留有相当大的空隙。 如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)。
(2)只有范德华力,无分子间氢键-分子密堆积
通常每个分子周围有12个紧邻的分子。 如:C60、干冰 、I2 O2
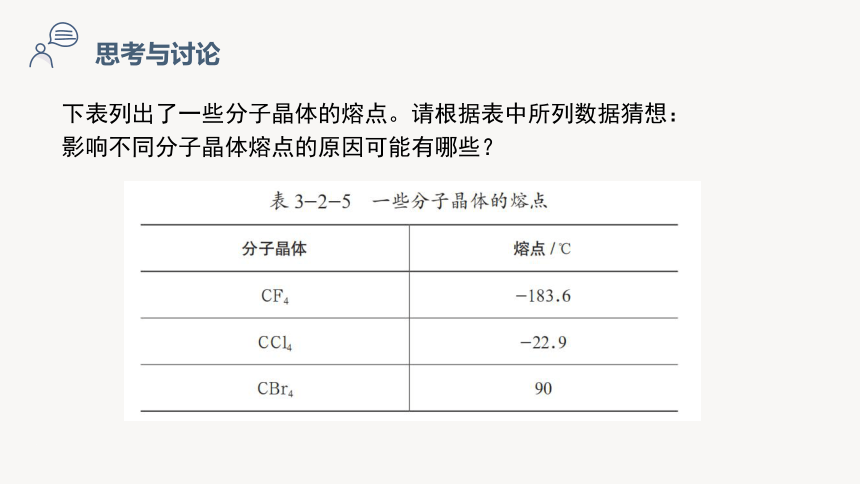
下表列出了一些分子晶体的熔点。请根据表中所列数据猜想:
影响不同分子晶体熔点的原因可能有哪些?
5.分子晶体的物理性质
(1)性质:
分子晶体熔沸点低、硬度小、易升华,固体和熔融状态不导电,有些在水溶液中能导电,溶解度相似相溶原理。
(2)本质原因: 分子间作用力很弱。
(3)熔沸点的比较:
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体,熔、沸点反常的高。
如H2O>H2Te>H2Se>H2S。
②不含氢键且组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
如SnH4>GeH4>SiH4>CH4。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。
如CO>N2,CH3OH>CH3CH3。
④同分异构体,支链越多,熔、沸点越低。如CH3CH2CH2CH3 > CH3CH(CH3)CH3
1.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、HD、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5 D.CCl4、Na2S、H2O2
B
2.下列各物质的固体,属于分子晶体且分子内只含极性键的是 ( )
A.CO2 B.O2 C.NH4 Br D.Ar
A
石墨晶体——混合型晶体
石墨的层状结构
实验测定,石墨的熔点高达3850℃,高于金刚石的熔点,这说明石墨晶体具有原子晶体的特点;但是,石墨很软并且能导电,是非常好的润滑剂,这说明它又不同于原子晶体。那么石墨究竟属于哪种类型的晶体呢?
石墨的层状结构
石墨晶体
①石墨晶体为层状结构。层与层之间以
结合。故石墨质软,有滑腻感。
②在同一层内,碳原子以 彼此结合,故石墨熔点较高。
分子间作用力
共价键
③在同一层内,每个碳原子以C-C键与3个碳原子结合,形成六元环。每个六元环平均 个 C原子。
④每个六元环中有 个C-C键,故1mol石墨晶体中C-C键为 。
2
1.5NA
3
层内碳原子的这些p轨道相互平行,相邻碳原子的p轨道相互重叠,形成大π键。
在石墨的二维结构平面内,每个碳原子以C—C键与3个碳原子结合,形成六元环层。
这些电子比较自由,相当于金属中的自由电子,所以石墨能导热和导电。
碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为____________。
同素异形体
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为_____、_______。
(3)C60属于________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm。其原因是金刚石中只存在C—C间的_____共价键,而石墨层内的C—C间不仅存在_____共价键,还有____键。
混合型
分子
几种类型晶体的结构和性质
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
结 构 构成微粒 金属阳离子、自由电子 阴、阳离子 原子 分子
微粒间作用力 金属键 离子键 共价键 分子间作用力
性 质 熔、沸点 差异较大 高 很高 低
硬 度 差异较大 硬而脆 很大 小
导电性 导电 熔化或溶于水导电 一般不导电,硅是半导体 固体及熔融状态不导电,有的溶于水能导电。
举 例 金属、 金属合金 离子化合物 金刚石、Si、SiO2、SiC 硫、干冰、冰、
冰醋酸、蔗糖
考点过关:晶体类型的判断特征
1.依据组成晶体的微粒和微粒间的相互作用判断
共价晶体:原子→共价键;
分子晶体:分子→分子间作用力;
离子晶体:离子→离子键;
金属晶体:金属阳离子和自由电子→金属键。
2.依据物质的分类判断
①常见的共价晶体单质有金刚石、晶体硅、晶体硼等,常见的原子晶体化合物有SiC、BN、AlN、Si3N4、C3N4、SiO2等;
②分子晶体:大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外);
③离子晶体:金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类;
④金属晶体:金属单质与合金。
考点过关:晶体类型的判断特征
3.依据晶体的熔点判断
①离子晶体的熔点较高,常在数百至1 000余度;
②共价晶体熔点很高,常在1 000度至几千度;
③分子晶体熔点低,常在数百度以下至很低温度;
④金属晶体多数熔点高,但也有少数熔点很低。
考点过关:晶体类型的判断特征
4.依据导电性判断
①共价晶体:一般不导电;
②分子晶体:
若不是电解质:固态、液态不导电、溶于水(不反应)
不导电
若是电解质:固态、液态不导电,溶于水导电
③离子晶体:固态不导电,熔融或溶于水导电;
④金属晶体:固态或熔融均导电。
5.依据硬度和机械性能判断
共价晶体硬度大;分子晶体硬度小且较脆;离子晶体硬度较大或较硬、脆;金属晶体多数硬度大,但也有较低的,且具有延展性。
考点过关:比较晶体的熔点沸点
1.不同类型晶体熔、沸点的比较:
①不同类型晶体的熔、沸点高低的一般规律:
___________>___________>___________。
②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点
很高,汞、铯等熔、沸点很低。
分子晶体
共价晶体
离子晶体
(2)同种晶体类型熔、沸点的比较:
如熔点:金刚石____碳化硅____硅。
小
短
大
高
>
>
①共价晶体:
考点过关:比较晶体的熔点沸点
a.一般地说,阴、阳离子的电荷数越____,离子半径越
____,则离子间的作用力就越____,其离子晶体的熔、
沸点就越____,
如熔点:MgO____MgCl2____NaCl____CsCl。
b.衡量离子晶体稳定性的物理量是晶格能。晶格能越____,
形成的离子晶体越____,熔点越____,硬度越____。
②离子晶体:
多
小
强
高
>
>
>
大
稳定
高
大
考点过关:比较晶体的熔点沸点
a.分子间作用力越____,物质的熔、沸点越____;具有
氢键的分子晶体熔、沸点反常地____。
如H2O____H2Te____H2Se____H2S。
b.组成和结构相似的分子晶体,相对分子质量越____,
熔、沸点越____,如SnH4____GeH4____SiH4____CH4。
③分子晶体:
大
高
高
大
高
>
>
>
>
>
>
考点过关:比较晶体的熔点沸点
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,
其熔、沸点越高,如CO>N2,CH3OH>CH3CH3。
d.同分异构体,支链越多,熔、沸点越低。
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高,如熔、沸点:Na④金属晶体:
考点过关:比较晶体的熔点沸点
下表列举了几种物质的性质,据此判断属于分子晶体的是____________。
物质 性质
X 熔点为10.31 ℃,液态不导电,水溶液导电
Y 易溶于CCl4,熔点为11.2 ℃,沸点为44.8 ℃
Z 常温下为气态,极易溶于水,溶液pH>7
W 常温下为固体,加热变为紫红色蒸气,遇冷变为紫黑色固体
M 熔点为1 170 ℃,易溶于水,水溶液导电
N 熔点为97.81 ℃,质软,导电,密度为0.97 g·cm-3
X、Y、Z、W
分子晶体 混合型晶体
1.了解分子晶体的结构特点及性质;
2.知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。
分子晶体是分子通过分子间作用力构成的固态物质。
以共价键结合的物质,除金刚石、晶体硅、二氧化硅等空间网状结构的物质属于共价晶体外,其他多数非金属单质(如H2、Cl2、N2等)、非金属元素组成的无机化合物(如H2O、HCl、CO2等)以及大多数有机化合物在低温下形成的晶体都属于分子晶体。
碘晶体
干冰晶体
分子晶体
1.概念:只含分子的晶体
2.构成微粒:分子
3.分子内:共价键
4.分子间:分子间作用力
范德华力
氢键
典型分子晶体结构——碘
(1)碘晶体的晶胞是一个长方体,在它的 各有1个I2分子,每个晶胞中有___个I2分子。
(2)I2分子之间以 结合。
每个顶点和面心上
4
范德华力
(3)每个碘分子周围有 个紧邻的碘分子
12
典型分子晶体结构——干冰
(3)CO2分子之间的作用力 。
(1)晶胞为面心立方体
8个顶点和6个面心上各有一个CO2分子
8×1/8+6×1/2=4
(2)每个晶胞含二氧化碳分子的个数为 。
(4)与每个二氧化碳分子等距离且最近的二氧化碳分子有 。
4
范德华力
12
典型分子晶体结构——冰
(1)水分子之间的主要作用力是 ,当然也存在 。
(2) 有方向性,它的存在迫使在 的每个水分子与____________方向的 个相邻水分子互相吸引。
氢键
范德华力
四面体中心
四面体
顶角
氢键
4
(3)与每个水分子等距离且最近的水分子有 个。
4
总结:分子晶体结构特征
(1)有分子间氢键—分子非密堆积
氢键具有方向性和饱和性,使晶体中的空间利率不高,留有相当大的空隙。 如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)。
(2)只有范德华力,无分子间氢键-分子密堆积
通常每个分子周围有12个紧邻的分子。 如:C60、干冰 、I2 O2
下表列出了一些分子晶体的熔点。请根据表中所列数据猜想:
影响不同分子晶体熔点的原因可能有哪些?
5.分子晶体的物理性质
(1)性质:
分子晶体熔沸点低、硬度小、易升华,固体和熔融状态不导电,有些在水溶液中能导电,溶解度相似相溶原理。
(2)本质原因: 分子间作用力很弱。
(3)熔沸点的比较:
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体,熔、沸点反常的高。
如H2O>H2Te>H2Se>H2S。
②不含氢键且组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
如SnH4>GeH4>SiH4>CH4。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。
如CO>N2,CH3OH>CH3CH3。
④同分异构体,支链越多,熔、沸点越低。如CH3CH2CH2CH3 > CH3CH(CH3)CH3
1.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、HD、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5 D.CCl4、Na2S、H2O2
B
2.下列各物质的固体,属于分子晶体且分子内只含极性键的是 ( )
A.CO2 B.O2 C.NH4 Br D.Ar
A
石墨晶体——混合型晶体
石墨的层状结构
实验测定,石墨的熔点高达3850℃,高于金刚石的熔点,这说明石墨晶体具有原子晶体的特点;但是,石墨很软并且能导电,是非常好的润滑剂,这说明它又不同于原子晶体。那么石墨究竟属于哪种类型的晶体呢?
石墨的层状结构
石墨晶体
①石墨晶体为层状结构。层与层之间以
结合。故石墨质软,有滑腻感。
②在同一层内,碳原子以 彼此结合,故石墨熔点较高。
分子间作用力
共价键
③在同一层内,每个碳原子以C-C键与3个碳原子结合,形成六元环。每个六元环平均 个 C原子。
④每个六元环中有 个C-C键,故1mol石墨晶体中C-C键为 。
2
1.5NA
3
层内碳原子的这些p轨道相互平行,相邻碳原子的p轨道相互重叠,形成大π键。
在石墨的二维结构平面内,每个碳原子以C—C键与3个碳原子结合,形成六元环层。
这些电子比较自由,相当于金属中的自由电子,所以石墨能导热和导电。
碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为____________。
同素异形体
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为_____、_______。
(3)C60属于________晶体,石墨属于________晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm。其原因是金刚石中只存在C—C间的_____共价键,而石墨层内的C—C间不仅存在_____共价键,还有____键。
混合型
分子
几种类型晶体的结构和性质
晶体类型 金属晶体 离子晶体 共价晶体 分子晶体
结 构 构成微粒 金属阳离子、自由电子 阴、阳离子 原子 分子
微粒间作用力 金属键 离子键 共价键 分子间作用力
性 质 熔、沸点 差异较大 高 很高 低
硬 度 差异较大 硬而脆 很大 小
导电性 导电 熔化或溶于水导电 一般不导电,硅是半导体 固体及熔融状态不导电,有的溶于水能导电。
举 例 金属、 金属合金 离子化合物 金刚石、Si、SiO2、SiC 硫、干冰、冰、
冰醋酸、蔗糖
考点过关:晶体类型的判断特征
1.依据组成晶体的微粒和微粒间的相互作用判断
共价晶体:原子→共价键;
分子晶体:分子→分子间作用力;
离子晶体:离子→离子键;
金属晶体:金属阳离子和自由电子→金属键。
2.依据物质的分类判断
①常见的共价晶体单质有金刚石、晶体硅、晶体硼等,常见的原子晶体化合物有SiC、BN、AlN、Si3N4、C3N4、SiO2等;
②分子晶体:大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外);
③离子晶体:金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类;
④金属晶体:金属单质与合金。
考点过关:晶体类型的判断特征
3.依据晶体的熔点判断
①离子晶体的熔点较高,常在数百至1 000余度;
②共价晶体熔点很高,常在1 000度至几千度;
③分子晶体熔点低,常在数百度以下至很低温度;
④金属晶体多数熔点高,但也有少数熔点很低。
考点过关:晶体类型的判断特征
4.依据导电性判断
①共价晶体:一般不导电;
②分子晶体:
若不是电解质:固态、液态不导电、溶于水(不反应)
不导电
若是电解质:固态、液态不导电,溶于水导电
③离子晶体:固态不导电,熔融或溶于水导电;
④金属晶体:固态或熔融均导电。
5.依据硬度和机械性能判断
共价晶体硬度大;分子晶体硬度小且较脆;离子晶体硬度较大或较硬、脆;金属晶体多数硬度大,但也有较低的,且具有延展性。
考点过关:比较晶体的熔点沸点
1.不同类型晶体熔、沸点的比较:
①不同类型晶体的熔、沸点高低的一般规律:
___________>___________>___________。
②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点
很高,汞、铯等熔、沸点很低。
分子晶体
共价晶体
离子晶体
(2)同种晶体类型熔、沸点的比较:
如熔点:金刚石____碳化硅____硅。
小
短
大
高
>
>
①共价晶体:
考点过关:比较晶体的熔点沸点
a.一般地说,阴、阳离子的电荷数越____,离子半径越
____,则离子间的作用力就越____,其离子晶体的熔、
沸点就越____,
如熔点:MgO____MgCl2____NaCl____CsCl。
b.衡量离子晶体稳定性的物理量是晶格能。晶格能越____,
形成的离子晶体越____,熔点越____,硬度越____。
②离子晶体:
多
小
强
高
>
>
>
大
稳定
高
大
考点过关:比较晶体的熔点沸点
a.分子间作用力越____,物质的熔、沸点越____;具有
氢键的分子晶体熔、沸点反常地____。
如H2O____H2Te____H2Se____H2S。
b.组成和结构相似的分子晶体,相对分子质量越____,
熔、沸点越____,如SnH4____GeH4____SiH4____CH4。
③分子晶体:
大
高
高
大
高
>
>
>
>
>
>
考点过关:比较晶体的熔点沸点
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,
其熔、沸点越高,如CO>N2,CH3OH>CH3CH3。
d.同分异构体,支链越多,熔、沸点越低。
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高,如熔、沸点:Na
考点过关:比较晶体的熔点沸点
下表列举了几种物质的性质,据此判断属于分子晶体的是____________。
物质 性质
X 熔点为10.31 ℃,液态不导电,水溶液导电
Y 易溶于CCl4,熔点为11.2 ℃,沸点为44.8 ℃
Z 常温下为气态,极易溶于水,溶液pH>7
W 常温下为固体,加热变为紫红色蒸气,遇冷变为紫黑色固体
M 熔点为1 170 ℃,易溶于水,水溶液导电
N 熔点为97.81 ℃,质软,导电,密度为0.97 g·cm-3
X、Y、Z、W
