3.2 课时2 离子晶体 课件(共17张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 3.2 课时2 离子晶体 课件(共17张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 27.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-08 00:00:00 | ||
图片预览





文档简介
离子晶体
第3章 不同聚集状态的物质与性质
1.了解几种典型离子晶体的晶胞结构;
2.认识离子晶体的物理性质与晶体结构的关系。
一、离子晶体
离子晶体:由阳离子和阴离子通过离子键结合而成的晶体。
胆矾
CuSO4·5H2O
明矾
KAl(SO4)2·12H2O
莹石
CaF2
重晶石
BaSO4
无方向性、无饱和性
→紧密堆积
概念辨析
离子晶体的化学式只表示晶体中阴、阳离子的个数比,不表示其分子组成。
离子晶体中不一定都含有金属元素,如NH4Cl是离子晶体。
离子晶体中除离子键外还可能含其他化学键,如NaOH晶体中还含有O—H共价键,Na2O2晶体中还含有O—O共价键。
由金属元素和非金属元素组成的晶体不一定是离子晶体,如AlCl3是由金属元素Al和非金属元素Cl组成的分子晶体。
含有金属离子的晶体不一定是离子晶体,如金属晶体中含有金属离子。
二、几种离子晶体的结构
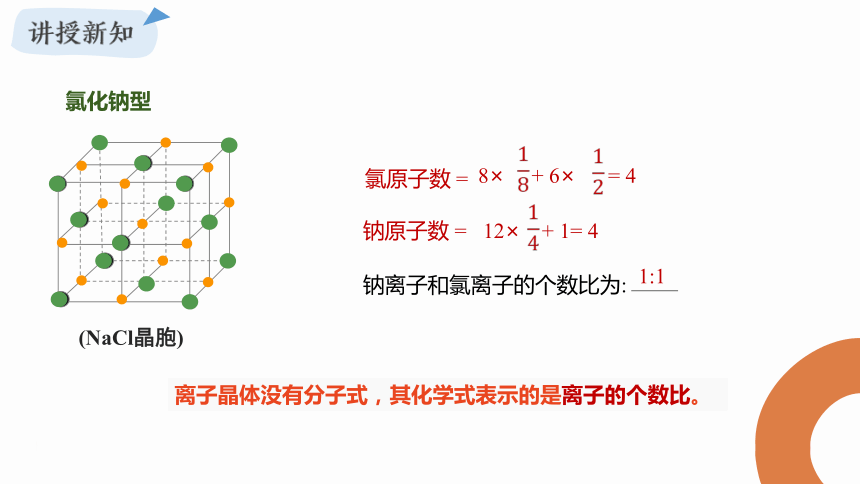
氯化钠型
1. Na+ 、 Cl- 在晶胞中的什么位置?
2. 在一个晶胞中, Cl- 的个数等于多少? Na+的个数等于多少?
3.在NaCl晶体中,是否存在单独“NaCl”分子?
Cl-按面心立方堆积方式排列,Na+离子填充在Cl-所成的空隙中。
氯化钠型
(NaCl晶胞)
离子晶体没有分子式,其化学式表示的是离子的个数比。
8× + 6× = 4
18
?
12
?
氯原子数 =
12× + 1= 4
14
?
钠原子数 =
钠离子和氯离子的个数比为:
1:1
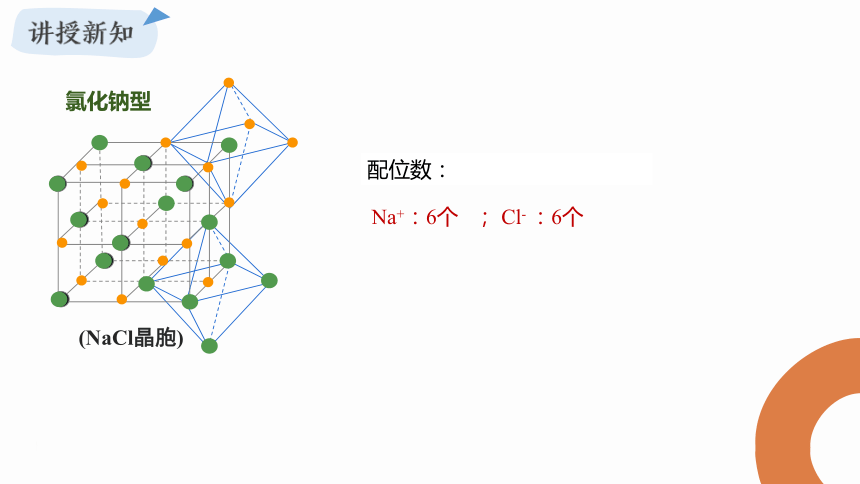
氯化钠型
(NaCl晶胞)
配位数:
Na+:6个 ; Cl- :6个
氯化铯型
Cl?
Cs+
8×
18
?
氯原子数 =
1
铯原子数 =
铯离子和氯离子的个数比为:
1:1
配位数:
Cs+:8个 ; Cl- :8个
ZnS型
S2-按 面心立方堆积方式排列,
Zn2+ 离子填在S2-所成的空隙中。
每个晶胞含:
Zn2+ :4个 ; S2- :4个
配位数:
Zn2+ :4个 ; S2- :4个
CaF2型
Ca2+按 面心立方堆积方式排列,
F?填在Ca2+所成的空隙中。
每个晶胞含:
Ca2+ :4个 ; F- :8个
配位数:
Ca2+ :8个 ; F- :4个
【思考】结构相似的离子晶体,为什么熔沸点仍存在差异?
{5940675A-B579-460E-94D1-54222C63F5DA}
NaCl
MgO
熔点 /℃
801
2800
沸点 /℃
1413
3600
离子晶体中阴、阳离子间作用力的强弱在一定程度上可以用离子晶体的晶格能来衡量。
三、离子晶体的晶格能
(2)意义:吸收的能量越多,晶格能越大,表示离子间作用力越强,离子晶体越稳定。
(1)概念:将1mol离子晶体完全气化为气态阴、阳离子所吸收的能量。
NaCl (s) = Na+ (g) + Cl- (g)
U = 787kJ/mol
依据表3-2-3 中的数据分析晶格能的大小与离子晶体的熔点的关系,
并与同学们交流研讨结构相似的离子晶体其晶格能的大小与哪些因素有关。
影响晶格能大小的因素
②离子半径越小,所带电荷数越多,晶格能越大
①离子电荷一定时,离子半径越大,晶格能越小
③晶格能越大,离子晶体的熔点越高,硬度越大
1. 高温下,超氧化钾晶体(KO2)呈立方体结构。如下图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是 ( )
A.KO2中只存在离子键
B.超氧化钾的化学式为KO2,
每个晶胞含有1个K+和1个O2-
C.晶体中与每个K+距离最近的O2-有6个
D.晶体中,所有原子之间都以离子键相结合
C
2.如图是从NaCl或CaF2晶体结构图中分割出来的部分结构图,其中属于从CaF2晶体中分割出来的结构图是( )
A.图(1)和图(3)
B.图(2)和图(4)
C.只有图(1)
D.只有图(4)
A
3. 氟在自然界中常以CaF2的形式存在,下列表述正确的是( )
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点低于CaCl2
C. 阴、阳离子数目比为2∶1的物质,均具有与CaF2相同的晶胞结构
D. CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
D
第3章 不同聚集状态的物质与性质
1.了解几种典型离子晶体的晶胞结构;
2.认识离子晶体的物理性质与晶体结构的关系。
一、离子晶体
离子晶体:由阳离子和阴离子通过离子键结合而成的晶体。
胆矾
CuSO4·5H2O
明矾
KAl(SO4)2·12H2O
莹石
CaF2
重晶石
BaSO4
无方向性、无饱和性
→紧密堆积
概念辨析
离子晶体的化学式只表示晶体中阴、阳离子的个数比,不表示其分子组成。
离子晶体中不一定都含有金属元素,如NH4Cl是离子晶体。
离子晶体中除离子键外还可能含其他化学键,如NaOH晶体中还含有O—H共价键,Na2O2晶体中还含有O—O共价键。
由金属元素和非金属元素组成的晶体不一定是离子晶体,如AlCl3是由金属元素Al和非金属元素Cl组成的分子晶体。
含有金属离子的晶体不一定是离子晶体,如金属晶体中含有金属离子。
二、几种离子晶体的结构
氯化钠型
1. Na+ 、 Cl- 在晶胞中的什么位置?
2. 在一个晶胞中, Cl- 的个数等于多少? Na+的个数等于多少?
3.在NaCl晶体中,是否存在单独“NaCl”分子?
Cl-按面心立方堆积方式排列,Na+离子填充在Cl-所成的空隙中。
氯化钠型
(NaCl晶胞)
离子晶体没有分子式,其化学式表示的是离子的个数比。
8× + 6× = 4
18
?
12
?
氯原子数 =
12× + 1= 4
14
?
钠原子数 =
钠离子和氯离子的个数比为:
1:1
氯化钠型
(NaCl晶胞)
配位数:
Na+:6个 ; Cl- :6个
氯化铯型
Cl?
Cs+
8×
18
?
氯原子数 =
1
铯原子数 =
铯离子和氯离子的个数比为:
1:1
配位数:
Cs+:8个 ; Cl- :8个
ZnS型
S2-按 面心立方堆积方式排列,
Zn2+ 离子填在S2-所成的空隙中。
每个晶胞含:
Zn2+ :4个 ; S2- :4个
配位数:
Zn2+ :4个 ; S2- :4个
CaF2型
Ca2+按 面心立方堆积方式排列,
F?填在Ca2+所成的空隙中。
每个晶胞含:
Ca2+ :4个 ; F- :8个
配位数:
Ca2+ :8个 ; F- :4个
【思考】结构相似的离子晶体,为什么熔沸点仍存在差异?
{5940675A-B579-460E-94D1-54222C63F5DA}
NaCl
MgO
熔点 /℃
801
2800
沸点 /℃
1413
3600
离子晶体中阴、阳离子间作用力的强弱在一定程度上可以用离子晶体的晶格能来衡量。
三、离子晶体的晶格能
(2)意义:吸收的能量越多,晶格能越大,表示离子间作用力越强,离子晶体越稳定。
(1)概念:将1mol离子晶体完全气化为气态阴、阳离子所吸收的能量。
NaCl (s) = Na+ (g) + Cl- (g)
U = 787kJ/mol
依据表3-2-3 中的数据分析晶格能的大小与离子晶体的熔点的关系,
并与同学们交流研讨结构相似的离子晶体其晶格能的大小与哪些因素有关。
影响晶格能大小的因素
②离子半径越小,所带电荷数越多,晶格能越大
①离子电荷一定时,离子半径越大,晶格能越小
③晶格能越大,离子晶体的熔点越高,硬度越大
1. 高温下,超氧化钾晶体(KO2)呈立方体结构。如下图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是 ( )
A.KO2中只存在离子键
B.超氧化钾的化学式为KO2,
每个晶胞含有1个K+和1个O2-
C.晶体中与每个K+距离最近的O2-有6个
D.晶体中,所有原子之间都以离子键相结合
C
2.如图是从NaCl或CaF2晶体结构图中分割出来的部分结构图,其中属于从CaF2晶体中分割出来的结构图是( )
A.图(1)和图(3)
B.图(2)和图(4)
C.只有图(1)
D.只有图(4)
A
3. 氟在自然界中常以CaF2的形式存在,下列表述正确的是( )
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点低于CaCl2
C. 阴、阳离子数目比为2∶1的物质,均具有与CaF2相同的晶胞结构
D. CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
D
