3.2 课时4 晶体结构的复杂性 课件 (共19张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 3.2 课时4 晶体结构的复杂性 课件 (共19张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 21.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-08 10:35:54 | ||
图片预览






文档简介
(共19张PPT)
晶体结构的复杂性
第3章 不同聚集状态的物质与性质
以石墨为例认识晶体的复杂性,借助过渡晶体及混合型晶体模型,解释其具有的独特性质。
同是碳单质的晶体,金刚石和石墨的性质存在哪些异同?是什么造成了这种差异?
金刚石部分物理性质 熔点 莫氏硬度 电导率/(s·m-1)
3550℃ 10 2.11*10-13
石墨部分物理性质 熔点 莫氏硬度 电导率/(s·m-1)
3850℃ 1 2.5*103
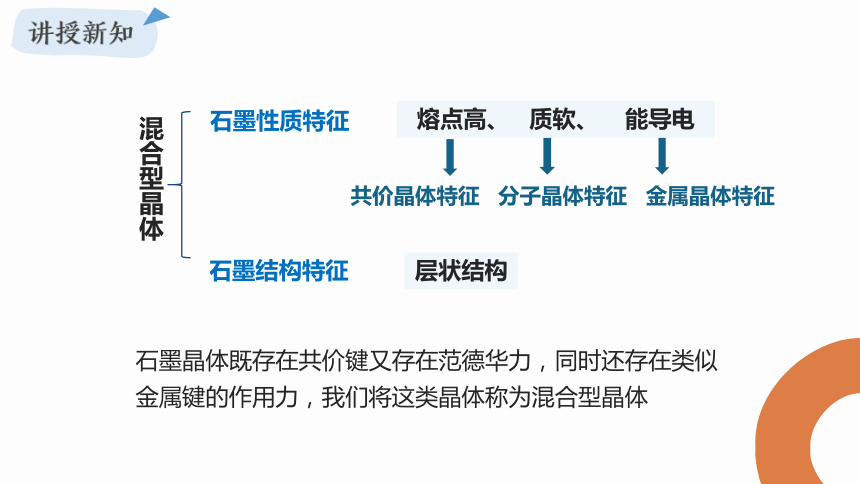
一、混合型晶体
实验测定,石墨的熔点高达 3850 ℃,这说明石墨晶体具有共价晶体的特点。但是,石墨很软并且能导电,是非常好的润滑剂,这说明它又不同于共价晶体。那么,石墨究竞属于哪种类型的晶体呢
石墨性质特征
熔点高、 质软、 能导电
共价晶体特征
金属晶体特征
石墨结构特征
混合型晶体
层状结构
分子晶体特征
石墨晶体既存在共价键又存在范德华力,同时还存在类似金属键的作用力,我们将这类晶体称为混合型晶体
石墨晶体是层状结构,层内的碳原子的核间距为142 pm,层间距离为335 pm。
109°28′
碳原子杂化方式:
347kJ·mol-1
键角:
键长:
键能:
0.154nm
sp2
石墨的层状结构
⑴石墨的晶体具有层状结构,同一层中的每个碳原子与邻近的3个碳原子以共价键相结合,形成无限的六边形平面网状结构。每个碳原子还有1个与碳环平面垂直的未参与杂化的2p轨道,并含有1个未成对电子,能形成遍及整个平面的大π键
⑵碳原子采取sp2杂化,C—C键之间的夹角为120°。
⑶层与层之间以范德华力结合。
⑷石墨晶体既含有共价键,又有范德华力,同时还存在类似金属键的作用力,这类晶体称为混合型晶体。石墨熔点高、质软、能导电。
事实上,纯粹的典型晶体是不多的,大多数离子晶体中的化学键具有一定的共价键成分。
金属晶体、离子晶体、共价晶体、分子晶体等模型都是典型的晶体结构模型,大多数实际晶体结构要复杂得多
O2-
Ba2+
Ti4+
例如:BaTiO3含有一种阴离子O2-和多种阳离子Ti4+、Ba2+
二、过渡晶体
如,Na2SiO3 与 Na2CO3 组成看似相似,但结构明显不同。
在Na2SiO3固体中并不存在单个的简单SiO32-,Si通过共价键与4个O原子相连,形成硅氧四面体。硅氧四面体通过共用顶角O原子而连成较大的链状硅酸盐{SiO32-}∞单元(如图所示),带负电的链状硅酸盐{SiO32-}∞单元与金属阳离子以离子键相互作用。
从表格中可知:上述晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键,这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的过渡晶体
几种氧化物的化学键中离子键成分的百分数 氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子键的 百分数/% 62 50 41 33 离子键的百分数更小
离子
晶体
共价
晶体
分子
晶体
几种氧化物的化学键中离子键成分的百分数 氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子键的 百分数/% 62 50 41 33 离子键的百分数更小 离子晶体和共价晶体的过渡标准是化学键中离子键成分的百分数。离子键成分的百分数大,作为离子晶体处理,离子键成分的百分数小,作为共价晶体处理。
三、四种晶体类型比较
类型项目 金属晶体 共价晶体 分子晶体 离子晶体
构成晶体的微粒 金属阳离子和“自由电子” 原子 分子 阴、阳
离子微粒间作用 金属键 共价键 分子间作用力(范德华力或氢键) 离子键
作用力强弱(一般地) 一般较强,有的较弱 很强 弱 较强
确定作用力强弱的一般判断方法 离子半径、价电子数 键长(原子半径) 组成结构相似时比较相对分子质量 离子所带
电荷、半径熔、沸点 差别较大(汞常温下为液态,钨熔点为3 410 ℃) 高 低 较高
硬度 差别较大 大 较小 略硬而脆
导热和导电性 良导体 不良导体 不良导体(部分溶于水发生电离后导电) 不良导体(熔化后或溶于水导电)
溶解性(水) 一般不溶于水,少数与水反应 一般不溶 相似相溶 多数易溶
组成微粒堆积方式 等径圆球紧密堆积 不服从紧密堆积原理 紧密堆积(与分子形状有关且分子间不存在氢键) 非等径圆球紧密堆积
各类晶体的熔点大小比较
1、根据物质状态判断
即物质沸点高低按常温下的状态:固体>液体>气体。
如:NaCl>H2O>CO2。
2、根据物质不同结构特点判断
解题程序:①首先确定晶体类型。
②分析影响熔点的因素--晶体中微粒间的作用:金属键、晶格能、离子键、共价键、分子间作用力(范德华力、氢键)等。
③分析影响微粒间作用大小的因素:原子半径、价电子数、离子半径、电荷数、键长、键能、相对分子质量等。
④回答问题:按顺序①—→③—→②—→结论
1.石墨晶体是层状结构,在每一层内,每一个碳原子都与其他三个碳原子相结合。如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( )
A.10 B.18 C.24 D.14
D
2.石墨晶体中,层内C—C的键长为142 pm,而金刚石中C—C的键长为154 pm,回答下列问题。
(1)熔点:石墨_____(填“>”“<”或“=”)金刚石。
(2)石墨中C—C的键长小于金刚石中C—C键长的原因:
__________________________________________________________________________________________________________________。
>
金刚石中只存在C—C间的σ键,而石墨中层内的C—C间不仅存在σ键,还存在π键,电子层重叠程度大,所以C—C间的键长短
3.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为____________。
同素异形体
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为_____、_______。
sp2
sp3
(3)C60属于________晶体,石墨属于________晶体。
分子
混合型
4.下列表述不正确的是( )
A、熔点:CF4B、硬度:金刚石>碳化硅>晶体硅
C、晶格能:NaF>NaCl>NaBr>NaI
D、熔点:Na>Mg>Al
D
晶体结构的复杂性
第3章 不同聚集状态的物质与性质
以石墨为例认识晶体的复杂性,借助过渡晶体及混合型晶体模型,解释其具有的独特性质。
同是碳单质的晶体,金刚石和石墨的性质存在哪些异同?是什么造成了这种差异?
金刚石部分物理性质 熔点 莫氏硬度 电导率/(s·m-1)
3550℃ 10 2.11*10-13
石墨部分物理性质 熔点 莫氏硬度 电导率/(s·m-1)
3850℃ 1 2.5*103
一、混合型晶体
实验测定,石墨的熔点高达 3850 ℃,这说明石墨晶体具有共价晶体的特点。但是,石墨很软并且能导电,是非常好的润滑剂,这说明它又不同于共价晶体。那么,石墨究竞属于哪种类型的晶体呢
石墨性质特征
熔点高、 质软、 能导电
共价晶体特征
金属晶体特征
石墨结构特征
混合型晶体
层状结构
分子晶体特征
石墨晶体既存在共价键又存在范德华力,同时还存在类似金属键的作用力,我们将这类晶体称为混合型晶体
石墨晶体是层状结构,层内的碳原子的核间距为142 pm,层间距离为335 pm。
109°28′
碳原子杂化方式:
347kJ·mol-1
键角:
键长:
键能:
0.154nm
sp2
石墨的层状结构
⑴石墨的晶体具有层状结构,同一层中的每个碳原子与邻近的3个碳原子以共价键相结合,形成无限的六边形平面网状结构。每个碳原子还有1个与碳环平面垂直的未参与杂化的2p轨道,并含有1个未成对电子,能形成遍及整个平面的大π键
⑵碳原子采取sp2杂化,C—C键之间的夹角为120°。
⑶层与层之间以范德华力结合。
⑷石墨晶体既含有共价键,又有范德华力,同时还存在类似金属键的作用力,这类晶体称为混合型晶体。石墨熔点高、质软、能导电。
事实上,纯粹的典型晶体是不多的,大多数离子晶体中的化学键具有一定的共价键成分。
金属晶体、离子晶体、共价晶体、分子晶体等模型都是典型的晶体结构模型,大多数实际晶体结构要复杂得多
O2-
Ba2+
Ti4+
例如:BaTiO3含有一种阴离子O2-和多种阳离子Ti4+、Ba2+
二、过渡晶体
如,Na2SiO3 与 Na2CO3 组成看似相似,但结构明显不同。
在Na2SiO3固体中并不存在单个的简单SiO32-,Si通过共价键与4个O原子相连,形成硅氧四面体。硅氧四面体通过共用顶角O原子而连成较大的链状硅酸盐{SiO32-}∞单元(如图所示),带负电的链状硅酸盐{SiO32-}∞单元与金属阳离子以离子键相互作用。
从表格中可知:上述晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键,这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的过渡晶体
几种氧化物的化学键中离子键成分的百分数 氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子键的 百分数/% 62 50 41 33 离子键的百分数更小
离子
晶体
共价
晶体
分子
晶体
几种氧化物的化学键中离子键成分的百分数 氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子键的 百分数/% 62 50 41 33 离子键的百分数更小 离子晶体和共价晶体的过渡标准是化学键中离子键成分的百分数。离子键成分的百分数大,作为离子晶体处理,离子键成分的百分数小,作为共价晶体处理。
三、四种晶体类型比较
类型项目 金属晶体 共价晶体 分子晶体 离子晶体
构成晶体的微粒 金属阳离子和“自由电子” 原子 分子 阴、阳
离子微粒间作用 金属键 共价键 分子间作用力(范德华力或氢键) 离子键
作用力强弱(一般地) 一般较强,有的较弱 很强 弱 较强
确定作用力强弱的一般判断方法 离子半径、价电子数 键长(原子半径) 组成结构相似时比较相对分子质量 离子所带
电荷、半径熔、沸点 差别较大(汞常温下为液态,钨熔点为3 410 ℃) 高 低 较高
硬度 差别较大 大 较小 略硬而脆
导热和导电性 良导体 不良导体 不良导体(部分溶于水发生电离后导电) 不良导体(熔化后或溶于水导电)
溶解性(水) 一般不溶于水,少数与水反应 一般不溶 相似相溶 多数易溶
组成微粒堆积方式 等径圆球紧密堆积 不服从紧密堆积原理 紧密堆积(与分子形状有关且分子间不存在氢键) 非等径圆球紧密堆积
各类晶体的熔点大小比较
1、根据物质状态判断
即物质沸点高低按常温下的状态:固体>液体>气体。
如:NaCl>H2O>CO2。
2、根据物质不同结构特点判断
解题程序:①首先确定晶体类型。
②分析影响熔点的因素--晶体中微粒间的作用:金属键、晶格能、离子键、共价键、分子间作用力(范德华力、氢键)等。
③分析影响微粒间作用大小的因素:原子半径、价电子数、离子半径、电荷数、键长、键能、相对分子质量等。
④回答问题:按顺序①—→③—→②—→结论
1.石墨晶体是层状结构,在每一层内,每一个碳原子都与其他三个碳原子相结合。如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( )
A.10 B.18 C.24 D.14
D
2.石墨晶体中,层内C—C的键长为142 pm,而金刚石中C—C的键长为154 pm,回答下列问题。
(1)熔点:石墨_____(填“>”“<”或“=”)金刚石。
(2)石墨中C—C的键长小于金刚石中C—C键长的原因:
__________________________________________________________________________________________________________________。
>
金刚石中只存在C—C间的σ键,而石墨中层内的C—C间不仅存在σ键,还存在π键,电子层重叠程度大,所以C—C间的键长短
3.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为____________。
同素异形体
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为_____、_______。
sp2
sp3
(3)C60属于________晶体,石墨属于________晶体。
分子
混合型
4.下列表述不正确的是( )
A、熔点:CF4
C、晶格能:NaF>NaCl>NaBr>NaI
D、熔点:Na>Mg>Al
D
