4.1.1醇和酚(教学课件)(共29张PPT)_高中化学苏教版选择性必修三(2019)
文档属性
| 名称 | 4.1.1醇和酚(教学课件)(共29张PPT)_高中化学苏教版选择性必修三(2019) |

|
|
| 格式 | pptx | ||
| 文件大小 | 64.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-08 00:24:39 | ||
图片预览








文档简介
专题四 生活中常用的有机物——烃的含氧衍生物
第一单元 醇和酚
4.1.1 醇
核心素养目标
宏观辨识与微观探析:
学生能够识别醇类物质的宏观特征,如物理性质,并能从微观结构角度理解醇类物质(特别是乙醇)的化学性质,如官能团羟基(—OH)的特性及其在不同反应中的作用。
证据推理与模型认知:
基于醇类物质的化学反应事实和数据,引导学生归纳总结醇的化学性质规律,构建醇类反应的模型。
科学探究与创新意识:
通过设计并进行醇类物质的化学实验,学生能够体验科学探究的过程,培养创新意识,学会如何提出科学问题、设计实验方案、观察实验现象、分析实验结果,并得出科学结论。
教学重难点
重点
醇类物质的结构特点,特别是官能团羟基(—OH)的结构和性质。
乙醇的主要化学性质,包括与金属钠的反应、氧化反应、取代反应(与氢卤酸、酸的酯化)和消去反应。
醇类物质在日常生活中的应用及其对现代社会可持续发展的影响。
难点
理解并掌握醇类物质发生取代反应和消去反应的条件及机理。
运用醇类物质的化学性质解决实际问题,如判断反应产物、设计合成路线等。
醇类物质结构与性质之间的关系,特别是官能团羟基(—OH)在不同反应中的作用和转化。
同学们,在日常生活中,我们经常会接触到各种各样的含醇类物质。比如,大家都知道喝酒会有醉的感觉,这是因为酒中含有乙醇。那你们有没有想过,为什么乙醇会让我们产生这样的生理反应呢?
再看看我们家里的汽车,在冬天为了防止水箱结冰,我们会添加防冻液,而乙二醇就是防冻液的主要成分之一。还有我们使用的一些护肤品、化妆品中也常常含有丙三醇,它具有很好的保湿作用。
这些醇类物质虽然在我们生活中扮演着不同的角色,但它们都有一个共同的结构特征 —— 含有羟基官能团。那么,这个羟基官能团到底赋予了醇类物质怎样独特的化学性质呢?今天,就让我们一起走进醇的化学世界,去探究它们的奥秘。
课前导入
醇的概述
PART 01
1.概念与结构通式
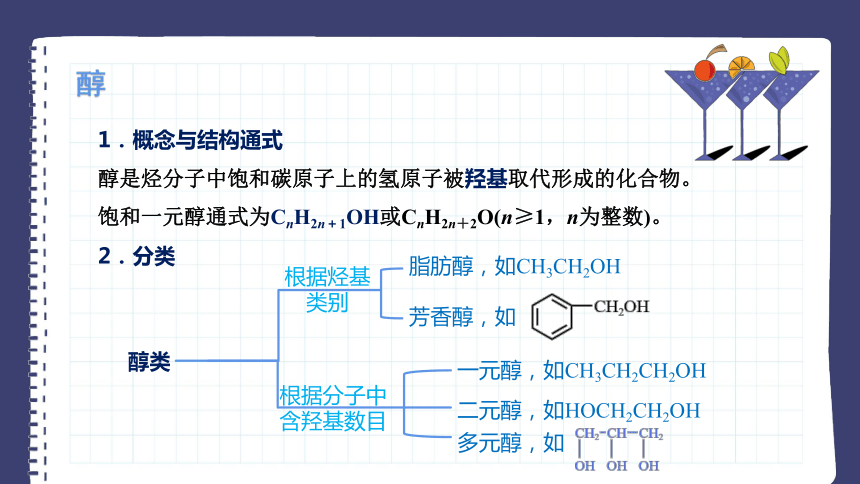
醇是烃分子中饱和碳原子上的氢原子被羟基取代形成的化合物。
饱和一元醇通式为CnH2n+1OH或CnH2n+2O(n≥1,n为整数)。
2.分类
醇
醇类
根据烃基
类别
脂肪醇,如CH3CH2OH
芳香醇,如
根据分子中含羟基数目
一元醇,如CH3CH2CH2OH
二元醇,如HOCH2CH2OH
多元醇,如
醇的命名
选择主链:选择含有羟基的最长碳链作为主链。如果醇分子中存在不饱和键(如双键或三键),则应选择同时包含羟基和不饱和键的最长碳链作为主链。
编号:从离羟基最近的一端开始编号。编号时,应确保羟基的位次最小。如果不饱和键的位次比羟基小,也可以从不饱和键开始编号。
标出羟基位置:在命名时,需要标出羟基在主链上的位置。羟基的位置用阿拉伯数字表示,放在“醇”字前面。
体现羟基个数:如果分子中含有多个羟基,则需要在主体名称中体现羟基的个数。例如,“二醇”表示分子中含有两个羟基的醇类化合物。
溶解性:
低级脂肪醇(如甲醇、乙醇、丙醇等)易溶于水,这是因为它们能与水形成氢键。随着碳原子数的增加,饱和一元醇的溶解性逐渐降低
密度:
一元脂肪醇的密度一般比水小,且随着碳原子数的增多,密度一般逐渐增大。
沸点:
直链饱和一元醇的沸点随着分子中碳原子数的递增而逐渐升高。
醇分子间存在氢键,因此相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。
碳原子数相同时,羟基个数越多,醇的沸点越高。
状态:
常温常压下,碳原子数为1~3的饱和一元醇为液体,碳原子数为4~11的饱和一元醇为油状液体,碳原子数更多的高级饱和一元醇为固体。
醇的物理性质
几种重要的醇
①
甲醇
性质
是无色有酒精气味易挥发的液体,沸点较低。有毒性,误服会损伤视神经,甚至会致人死亡。
用途
甲醇是重要的化工原料,可用于制造甲醛、乙酸、氯甲烷、甲胺和硫酸二甲酯等多种有机产品。
用作涂料、清漆、虫胶、油墨、胶黏剂、染料、生物碱、醋酸纤维素、硝酸纤维素、乙基纤维素、聚乙烯醇缩丁醛等的溶剂。
作为燃料,可掺入汽油作替代燃料使用,也广泛应用于甲醇燃料电池中。
几种重要的醇
②
乙醇
性质
是无色透明、具有特殊香味的液体,密度比水小,沸点较低,易挥发,能与水以任意比例互溶。
用途
乙醇是常用的燃料、溶剂和消毒剂,在有机合成中应用广泛。
医疗上常用体积分数为70%~75%的乙醇作消毒剂。
用于制造醋酸、饮料、香精、染料等。
作为有机溶剂、制饮料酒以及食品工业的原料。
几种重要的醇
③
乙二醇
性质
乙二醇是无水、无臭、具有甜味的黏稠液体,熔点较低,沸点较高,能与水互溶。能显著降低水的凝固点,具有很强的吸水能力。
用途
主要用作汽车发动机的防冻液。
是合成涤纶的主要原料。
在化妆品和个人护理产品中作为保湿剂使用。
几种重要的醇
④
丙三醇
性质
丙三醇俗称甘油,是无色、无臭、具有甜味的黏稠液体,沸点较高,能与水互溶。具有很强的吸水能力。
用途
在日用化妆品中作为保湿成分。
用于制造三硝酸甘油酯(俗称硝化甘油),主要用作炸药。
是治疗心绞痛药物的主要成分。
在医学上,丙三醇可作为溶剂、润滑剂。
醇的结构与性质
PART 02
乙醇的分子结构
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子式
结构式
结构简式
C2H6O
CH3CH2OH
或
C2H5OH
官能团
空间填充模型
球棍模型
羟基
——OH
乙醇的化学性质
(1)与金属钠反应
①乙醇与钠的反应
【实验目的】验证乙醇与钠的反应及产物。
【实验步骤】向小烧杯中加入无水乙醇,再放入一小块切去表层的金属钠(绿豆粒般大小),观察实验现象。
【实验现象】钠与乙醇反应较快,反应放出的气体可在空气中安静地燃烧,火焰呈淡蓝色,烧杯内壁上有水珠生成,而且加入烧杯中的澄清石灰水不变浑浊。
【实验结论】钠能置换出乙醇分子中的氢原子。化学方程式为
2C2H5OH+2Na→2C2H5ONa+H2↑。
乙醇与钠的反应
【注意事项】
a.在乙醇分子里,被钠置换的氢是羟基上的氢,而不是乙基上的氢。
b.该反应属于取代反应,1 mol乙醇与足量Na反应可产生0.5 mol H2。
c.综合乙醇与钠反应和金属活动性顺序可知,钾、钙等活泼性金属也能与乙醇发生反应,如:2CH3CH2OH+2K→2CH3CH2OK+H2↑。
d.CH3CH2OH与Na的反应成本高且反应不易控制,故工业上常利用下列反应来制备CH3CH2ONa:
CH3CH2OH+NaOH?CH3CH2ONa+H2O,
生产时设法除去水以利于CH3CH2ONa的生成。
?
乙醇的化学性质
②水、乙醚分别与钠反应
【实验目的】用水、乙醚分别与钠反应和乙醇与钠反应对比,来证明乙醇分子中羟基氢的活泼性。
【实验步骤】向两支试管中分别加入3 mL水和3 mL乙醚(C2H5—O—C2H5),再分别向两支试管中放入切去表层的金属钠(绿豆粒般大),观察实验现象。
【实验现象】钠与水剧烈反应,放出H2;乙醚与钠不反应。
【实验结论】氢原子的活泼性顺序为水>乙醇>乙醚;
羟基上的氢原子可被钠原子取代而烃基上的氢原子不能被钠原子取代。
归纳总结——钠与水、乙醇反应的比较
{F5AB1C69-6EDB-4FF4-983F-18BD219EF322}?
钠与水反应
钠与乙醇反应
反应现象
钠块熔为闪亮的小球,浮游于水面,并迅速消失
钠块未熔化,沉入乙醇液体底部,并慢慢消失
有“嘶嘶”的声音
无任何声音
钠块在水面游动
钠块沉入底部
反应实质
水分子中的氢原子被钠置换出来的置换反应
乙醇分子羟基上的氢原子被钠取代的取代反应
结论
乙醇分子羟基中的氢原子不如水分子中的氢原子活泼
乙醇的化学性质
(3)与氢卤酸的反应(取代反应)
【实验操作】在试管Ⅰ中依次加入2 mL蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3 g溴化钠粉末,在试管Ⅱ中注入蒸馏水,烧杯中注入自来水。加热试管Ⅰ至微沸状态数分钟后,冷却。观察并描述实验现象。
【实验现象】试管Ⅱ中生成一种无色油状液体
【实验结论】乙醇与氢溴酸混合加热后发生取代反应,生成溴乙烷。反应方程式为
NaBr+H2SO4(浓)?NaHSO4+HBr;
CH3CH2OH+HBr △ CH3CH2Br+H2O。
?
乙醇的化学性质——脱水反应
【实验步骤】组装如图所示装置,在圆底烧瓶中加入2 g P2O5并注入4 mL 95%的乙醇,加热,观察实验现象。
【实验现象】①温度在170 ℃时有气体生成;
②温度在140 ℃时无气体生成,洗气瓶液面上有油状液体出现;
③酸性高锰酸钾溶液褪色。
【实验结论】乙醇可以在浓H2SO4、Al2O3(400 ℃左右)或P2O5等催化剂的作用下发生脱水反应。反应方程式为
乙醇的化学性质——脱水反应
课堂小结
PART 03
代表物及其化学性质
通式:CnH2n+1OH(n≥1)
?
2
1
醇
氧化(生成醛或酮)
取代(与氢卤酸反应)
消去(生成烯烃)
课堂练习
PART 04
1.下列各组物质中均属于醇类,但不是同系物的是( )
A.C2H5OH和CH3OCH3
B.CH3OH和CH3CH(OH)CH3
C.CH3CH2OH和CH2===CHCH2OH
D.CH2OHCH2OH和CH3CH(OH)CH2OH
C
D
3.实验室常用浓硫酸和乙醇混合加热制取乙烯,下列说法正确的个数是
( )
①浓硫酸只作催化剂 ②在反应容器中放入几片碎瓷片防止混合液暴沸
③反应温度缓慢上升至170 ℃ ④用排水法或向下排气法收集乙烯
⑤圆底烧瓶中装的是4 mL乙醇和12 mL 3 mol·L-1?H2SO4混合液
⑥温度计应插入反应溶液液面下,以便控制温度
⑦反应完毕后先熄灭酒精灯,再从水中取出导管 ⑧该反应类型属于取代反应
⑨若a口出来的气体能使酸性 KMnO4溶液褪色,说明有乙烯生成
A.1 B.2 C.3 ? D.4
B
C
Thanks
好好学习天天向上
第一单元 醇和酚
4.1.1 醇
核心素养目标
宏观辨识与微观探析:
学生能够识别醇类物质的宏观特征,如物理性质,并能从微观结构角度理解醇类物质(特别是乙醇)的化学性质,如官能团羟基(—OH)的特性及其在不同反应中的作用。
证据推理与模型认知:
基于醇类物质的化学反应事实和数据,引导学生归纳总结醇的化学性质规律,构建醇类反应的模型。
科学探究与创新意识:
通过设计并进行醇类物质的化学实验,学生能够体验科学探究的过程,培养创新意识,学会如何提出科学问题、设计实验方案、观察实验现象、分析实验结果,并得出科学结论。
教学重难点
重点
醇类物质的结构特点,特别是官能团羟基(—OH)的结构和性质。
乙醇的主要化学性质,包括与金属钠的反应、氧化反应、取代反应(与氢卤酸、酸的酯化)和消去反应。
醇类物质在日常生活中的应用及其对现代社会可持续发展的影响。
难点
理解并掌握醇类物质发生取代反应和消去反应的条件及机理。
运用醇类物质的化学性质解决实际问题,如判断反应产物、设计合成路线等。
醇类物质结构与性质之间的关系,特别是官能团羟基(—OH)在不同反应中的作用和转化。
同学们,在日常生活中,我们经常会接触到各种各样的含醇类物质。比如,大家都知道喝酒会有醉的感觉,这是因为酒中含有乙醇。那你们有没有想过,为什么乙醇会让我们产生这样的生理反应呢?
再看看我们家里的汽车,在冬天为了防止水箱结冰,我们会添加防冻液,而乙二醇就是防冻液的主要成分之一。还有我们使用的一些护肤品、化妆品中也常常含有丙三醇,它具有很好的保湿作用。
这些醇类物质虽然在我们生活中扮演着不同的角色,但它们都有一个共同的结构特征 —— 含有羟基官能团。那么,这个羟基官能团到底赋予了醇类物质怎样独特的化学性质呢?今天,就让我们一起走进醇的化学世界,去探究它们的奥秘。
课前导入
醇的概述
PART 01
1.概念与结构通式
醇是烃分子中饱和碳原子上的氢原子被羟基取代形成的化合物。
饱和一元醇通式为CnH2n+1OH或CnH2n+2O(n≥1,n为整数)。
2.分类
醇
醇类
根据烃基
类别
脂肪醇,如CH3CH2OH
芳香醇,如
根据分子中含羟基数目
一元醇,如CH3CH2CH2OH
二元醇,如HOCH2CH2OH
多元醇,如
醇的命名
选择主链:选择含有羟基的最长碳链作为主链。如果醇分子中存在不饱和键(如双键或三键),则应选择同时包含羟基和不饱和键的最长碳链作为主链。
编号:从离羟基最近的一端开始编号。编号时,应确保羟基的位次最小。如果不饱和键的位次比羟基小,也可以从不饱和键开始编号。
标出羟基位置:在命名时,需要标出羟基在主链上的位置。羟基的位置用阿拉伯数字表示,放在“醇”字前面。
体现羟基个数:如果分子中含有多个羟基,则需要在主体名称中体现羟基的个数。例如,“二醇”表示分子中含有两个羟基的醇类化合物。
溶解性:
低级脂肪醇(如甲醇、乙醇、丙醇等)易溶于水,这是因为它们能与水形成氢键。随着碳原子数的增加,饱和一元醇的溶解性逐渐降低
密度:
一元脂肪醇的密度一般比水小,且随着碳原子数的增多,密度一般逐渐增大。
沸点:
直链饱和一元醇的沸点随着分子中碳原子数的递增而逐渐升高。
醇分子间存在氢键,因此相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。
碳原子数相同时,羟基个数越多,醇的沸点越高。
状态:
常温常压下,碳原子数为1~3的饱和一元醇为液体,碳原子数为4~11的饱和一元醇为油状液体,碳原子数更多的高级饱和一元醇为固体。
醇的物理性质
几种重要的醇
①
甲醇
性质
是无色有酒精气味易挥发的液体,沸点较低。有毒性,误服会损伤视神经,甚至会致人死亡。
用途
甲醇是重要的化工原料,可用于制造甲醛、乙酸、氯甲烷、甲胺和硫酸二甲酯等多种有机产品。
用作涂料、清漆、虫胶、油墨、胶黏剂、染料、生物碱、醋酸纤维素、硝酸纤维素、乙基纤维素、聚乙烯醇缩丁醛等的溶剂。
作为燃料,可掺入汽油作替代燃料使用,也广泛应用于甲醇燃料电池中。
几种重要的醇
②
乙醇
性质
是无色透明、具有特殊香味的液体,密度比水小,沸点较低,易挥发,能与水以任意比例互溶。
用途
乙醇是常用的燃料、溶剂和消毒剂,在有机合成中应用广泛。
医疗上常用体积分数为70%~75%的乙醇作消毒剂。
用于制造醋酸、饮料、香精、染料等。
作为有机溶剂、制饮料酒以及食品工业的原料。
几种重要的醇
③
乙二醇
性质
乙二醇是无水、无臭、具有甜味的黏稠液体,熔点较低,沸点较高,能与水互溶。能显著降低水的凝固点,具有很强的吸水能力。
用途
主要用作汽车发动机的防冻液。
是合成涤纶的主要原料。
在化妆品和个人护理产品中作为保湿剂使用。
几种重要的醇
④
丙三醇
性质
丙三醇俗称甘油,是无色、无臭、具有甜味的黏稠液体,沸点较高,能与水互溶。具有很强的吸水能力。
用途
在日用化妆品中作为保湿成分。
用于制造三硝酸甘油酯(俗称硝化甘油),主要用作炸药。
是治疗心绞痛药物的主要成分。
在医学上,丙三醇可作为溶剂、润滑剂。
醇的结构与性质
PART 02
乙醇的分子结构
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}分子式
结构式
结构简式
C2H6O
CH3CH2OH
或
C2H5OH
官能团
空间填充模型
球棍模型
羟基
——OH
乙醇的化学性质
(1)与金属钠反应
①乙醇与钠的反应
【实验目的】验证乙醇与钠的反应及产物。
【实验步骤】向小烧杯中加入无水乙醇,再放入一小块切去表层的金属钠(绿豆粒般大小),观察实验现象。
【实验现象】钠与乙醇反应较快,反应放出的气体可在空气中安静地燃烧,火焰呈淡蓝色,烧杯内壁上有水珠生成,而且加入烧杯中的澄清石灰水不变浑浊。
【实验结论】钠能置换出乙醇分子中的氢原子。化学方程式为
2C2H5OH+2Na→2C2H5ONa+H2↑。
乙醇与钠的反应
【注意事项】
a.在乙醇分子里,被钠置换的氢是羟基上的氢,而不是乙基上的氢。
b.该反应属于取代反应,1 mol乙醇与足量Na反应可产生0.5 mol H2。
c.综合乙醇与钠反应和金属活动性顺序可知,钾、钙等活泼性金属也能与乙醇发生反应,如:2CH3CH2OH+2K→2CH3CH2OK+H2↑。
d.CH3CH2OH与Na的反应成本高且反应不易控制,故工业上常利用下列反应来制备CH3CH2ONa:
CH3CH2OH+NaOH?CH3CH2ONa+H2O,
生产时设法除去水以利于CH3CH2ONa的生成。
?
乙醇的化学性质
②水、乙醚分别与钠反应
【实验目的】用水、乙醚分别与钠反应和乙醇与钠反应对比,来证明乙醇分子中羟基氢的活泼性。
【实验步骤】向两支试管中分别加入3 mL水和3 mL乙醚(C2H5—O—C2H5),再分别向两支试管中放入切去表层的金属钠(绿豆粒般大),观察实验现象。
【实验现象】钠与水剧烈反应,放出H2;乙醚与钠不反应。
【实验结论】氢原子的活泼性顺序为水>乙醇>乙醚;
羟基上的氢原子可被钠原子取代而烃基上的氢原子不能被钠原子取代。
归纳总结——钠与水、乙醇反应的比较
{F5AB1C69-6EDB-4FF4-983F-18BD219EF322}?
钠与水反应
钠与乙醇反应
反应现象
钠块熔为闪亮的小球,浮游于水面,并迅速消失
钠块未熔化,沉入乙醇液体底部,并慢慢消失
有“嘶嘶”的声音
无任何声音
钠块在水面游动
钠块沉入底部
反应实质
水分子中的氢原子被钠置换出来的置换反应
乙醇分子羟基上的氢原子被钠取代的取代反应
结论
乙醇分子羟基中的氢原子不如水分子中的氢原子活泼
乙醇的化学性质
(3)与氢卤酸的反应(取代反应)
【实验操作】在试管Ⅰ中依次加入2 mL蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3 g溴化钠粉末,在试管Ⅱ中注入蒸馏水,烧杯中注入自来水。加热试管Ⅰ至微沸状态数分钟后,冷却。观察并描述实验现象。
【实验现象】试管Ⅱ中生成一种无色油状液体
【实验结论】乙醇与氢溴酸混合加热后发生取代反应,生成溴乙烷。反应方程式为
NaBr+H2SO4(浓)?NaHSO4+HBr;
CH3CH2OH+HBr △ CH3CH2Br+H2O。
?
乙醇的化学性质——脱水反应
【实验步骤】组装如图所示装置,在圆底烧瓶中加入2 g P2O5并注入4 mL 95%的乙醇,加热,观察实验现象。
【实验现象】①温度在170 ℃时有气体生成;
②温度在140 ℃时无气体生成,洗气瓶液面上有油状液体出现;
③酸性高锰酸钾溶液褪色。
【实验结论】乙醇可以在浓H2SO4、Al2O3(400 ℃左右)或P2O5等催化剂的作用下发生脱水反应。反应方程式为
乙醇的化学性质——脱水反应
课堂小结
PART 03
代表物及其化学性质
通式:CnH2n+1OH(n≥1)
?
2
1
醇
氧化(生成醛或酮)
取代(与氢卤酸反应)
消去(生成烯烃)
课堂练习
PART 04
1.下列各组物质中均属于醇类,但不是同系物的是( )
A.C2H5OH和CH3OCH3
B.CH3OH和CH3CH(OH)CH3
C.CH3CH2OH和CH2===CHCH2OH
D.CH2OHCH2OH和CH3CH(OH)CH2OH
C
D
3.实验室常用浓硫酸和乙醇混合加热制取乙烯,下列说法正确的个数是
( )
①浓硫酸只作催化剂 ②在反应容器中放入几片碎瓷片防止混合液暴沸
③反应温度缓慢上升至170 ℃ ④用排水法或向下排气法收集乙烯
⑤圆底烧瓶中装的是4 mL乙醇和12 mL 3 mol·L-1?H2SO4混合液
⑥温度计应插入反应溶液液面下,以便控制温度
⑦反应完毕后先熄灭酒精灯,再从水中取出导管 ⑧该反应类型属于取代反应
⑨若a口出来的气体能使酸性 KMnO4溶液褪色,说明有乙烯生成
A.1 B.2 C.3 ? D.4
B
C
Thanks
好好学习天天向上
