3.3.2共价键 共价晶体(教学课件)_(共28张ppt)高中化学苏教版选择性必修二(2019)
文档属性
| 名称 | 3.3.2共价键 共价晶体(教学课件)_(共28张ppt)高中化学苏教版选择性必修二(2019) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-07 21:05:37 | ||
图片预览








文档简介
(共27张PPT)
专题3 微粒间作用力与物质性质
第三单元 共价键 共价晶体
3.3.2 共价键的参数
共价晶体
核心素养目标
宏观辨识与微观探析:
引导学生从微观层面深入理解共价键键能与键长概念,明晰原子结构、原子半径对键能、键长的影响机制,助力学生以共价键理论为基础,剖析共价晶体结构特点,理解原子间共价键作用对晶体宏观性质的决定性影响。
证据推理与模型认知:
组织学生分析键能数据、化学反应热数据及晶体结构数据,归纳键能、键长变化规律,推导键能与反应热、晶体性质关联,引导学生运用构建的模型,预测未知共价化合物稳定性、反应热及新共价晶体性质,通过实例验证与修正模型,强化模型应用与创新思维。
教学重难点
重点
透彻讲解共价键键能、键长概念内涵,运用图表、实例对比不同共价键键能、键长数据,详细分析键能与共价键稳定性、分子稳定性关系
系统阐述共价晶体结构特征与性质关联,借助模型、动画展示金刚石、二氧化硅等晶体原子排列、共价键网络结构,深入分析结构如何决定其高熔沸点、高硬度、不导电性等性质。
难点
巧妙化解利用键能计算反应热的难点,精选典型化学反应实例,逐步引导学生分析反应物、生成物键能组成,清晰展示计算过程与原理,深入阐释共价晶体结构复杂性,通过构建多维晶体结构模型、剖析晶体晶胞结构,详细讲解原子配位情况、共价键键角与键长在空间结构中的分布规律
大家都知道氢气在氯气中燃烧会生成氯化氢气体,这个反应会放出热量。那为什么会放出热量呢?这其实就和我们今天要深入探究的共价键键能密切相关。再比如,我们生活中常见的金刚石,它是自然界中硬度非常大的物质,还有二氧化硅,它是沙子、石英的主要成分,这些物质都具有一些特殊的性质。它们为什么会有这么高的硬度和独特的物理性质呢?这是因为它们属于一种特殊的晶体 —— 共价晶体,而共价晶体的性质又和其中的共价键有着千丝万缕的联系。
接下来,就让我们一起深入探究共价键键能以及共价晶体的奥秘,去寻找这些问题的答案吧!
课前导入
键参数
PART 01
共价键的键长
(1)定义:形成共价键的两个原子核间的平均间距
(2)与共价键稳定性的关系:一般而言,共价键的键长越长,共价键就越强,键就越牢固。
(3)定性判定键长的方法:
①根据原子半径判断:在其他条件相同时,成键原子的半径越小,键长越短。如键长:H—I>H—Cl>H—F>Br—Br>Cl—Cl>F—F>;
Si—Si>Si—C>C—C
②根据共用电子对数判断:就相同的两原子形成的共价键而言,单间键长>双键键长>三键键长
共价键的键能
(1)概念:在101 kPa、298 K条件下,1 mol气态AB分子生成气态A原子和B原子的过程中所吸收的能量,称为AB间共价键的键能。其单位为kJ·mol-1。
(2)应用
①判断共价键的稳定性
原子间形成共价键时,原子轨道重叠程度越大,释放能量越多,所形成的共价键键能越大,共价键越稳定。
②判断分子的稳定性
一般来说,结构相似的分子,共价键的键能越大,分子越稳定。
③利用键能计算反应热:ΔH=反应物的总键能-生成物的总键能。
键能与反应热的关系
(1)化学反应的实质:旧化学键的断裂和新化学键的形成。
(2)化学反应中能量变化的原因:断裂反应物中旧化学键需要吸收能量,形成生成物中新的化学键需要放出能量,吸收的能量和放出的能量不相等,导致化学反应中产生能量变化
(3)放热反应和吸热反应:如果化学反应中旧化学键断裂所吸收的总能量大于新化学键形成所放出的总能量,该化学反应为吸热反应;反之,该化学反应为放热反应。
(4)化学反应中的能量变化与键能的关系:△H=E反应物—E生成物
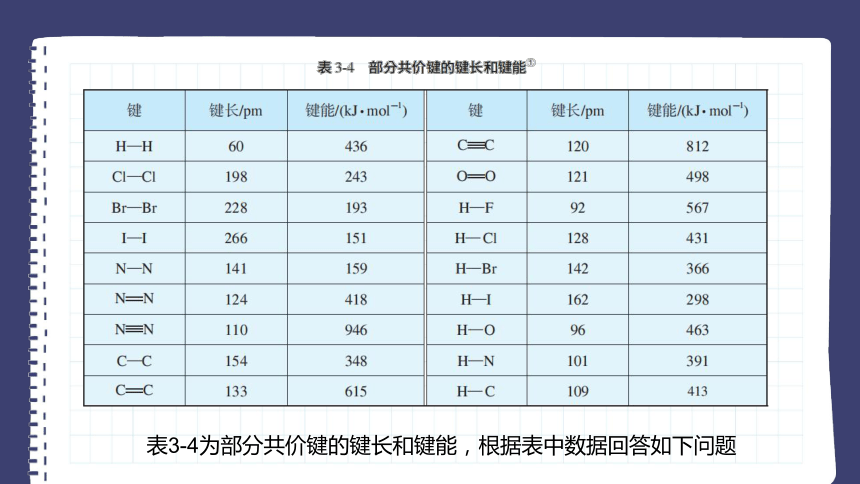
表3-4为部分共价键的键长和键能,根据表中数据回答如下问题
深度思考
1.N2、O2、F2与H2的反应能力依次增强,从键能的角度如何理解这一化学事实。
从表3-4的数据可知,H—N键、H—O键与H—F键的键能依次增大,意味着形成这些键时放出的能量依次增大,化学键越来越稳定。所以N2、O2、F2与H2的反应能力依次增强。
2.为什么F—F键的键长比Cl—Cl键的键长短,但键能却比Cl—Cl键的键能小?
氟原子的半径很小,因而F—F键的键长比Cl—Cl键的键长短,但也是由于F—F键的键长短,两个氟原子在形成共价键时,原子核之间的距离就小,排斥力大,因此键能比Cl—Cl键的键能小。
典例解析
下列分子中,最难分裂成原子的是( )
A.HF B.HCl C.HBr D.HI
A
【解析】一般来说,原子半径越小,其原子形成的共价键键长越短,键能越大,就越难断键。原子半径:FE(H—Cl)>E(H—Br)>E(H—I),即HF最难分裂成氟原子和氢原子。
共价晶体
PART 02
晶体中所有原子通过共价键结合,形成空间网状结构,像这样的晶体叫做共价晶体,晶体硅(Si)、金刚砂(SiC)、二氧化硅(SiO2)等都属于共价晶体。
共价晶体
金刚石、用金刚石制成的钻头和金刚石晶胞
共价晶体的物理性质
①熔、沸点很高:
共价晶体中,原子间通过共价键结合,熔化时破坏共价键,共价键键能较大,需要很高的能量
②硬度大:
共价晶体中原子间通过共价键结合形成的空间网状结构决定了共价晶体的硬度,如金刚石是天然存在的最硬的物质
③一般不导电:
构成微粒是原子,固态和熔融状态下都不导电
典型共价晶体——金刚石
①在晶体中每个碳原子以4个共价单键对称地与相邻的4个碳原子相结合,形成正四面体结构,这些正四面体向空间发展,构成彼此联结的立体网状结构。
②晶体中相邻碳碳键的夹角为109°28′。
③最小环上有6个碳原子,晶体中C原子个数与C—C键数之比为1∶2。
④每个金刚石晶胞中含有8个碳原子。
典型共价晶体——二氧化硅
①每个硅原子都以4个共价单键与4个氧原子结合,每个氧原子与2个硅原子结合,向空间扩展,构成空间网状结构。
②晶体中最小的环为6个硅原子、6个氧原子组成的12元环,硅、氧原子个数比为1∶2。
③每个二氧化硅晶胞中含有8个硅原子和16个氧原子。
晶体硅(Si)和金刚砂(SiC)都是与金刚石相似的共价晶体,请根据表3-5中的数据,分析其熔点、硬度的大小与其结构之间的关系。
对于结构相似的共价晶体而言,共价键的键长越长,键能就越小,晶体的熔、沸点越低,硬度越小。
典例解析
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法不正确的是( )
A.该晶体属于共价晶体,其化学键比金刚石中的碳碳键更牢固
B.该晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
C.该晶体与金刚石相似,碳原子个数与碳氮键个数之比为1∶2
D.该晶体中碳原子和氮原子的最外层都满足8电子稳定结构
C
【解析】C3N4晶体具有比金刚石还大的硬度,则该晶体属于共价晶体,其化学键比金刚石更牢固,A正确;C的最外层有4个电子,因此一个碳原子连接4个N原子,N的最外层有5个电子,因此一个N原子连接3个C原子,B正确;根据以上分析可知该晶体中碳原子个数与碳氮键个数之比为1∶4,C错误;构成该晶体的微粒间只以单键结合,每个碳原子连接4个氮原子,每个氮原子连接3个碳原子,则晶体中碳原子和氮原子的最外层都满足8电子稳定结构,D正确。
典例解析
课堂小结
PART 03
共价键晶体的结构特征:空间网状结构
共价键参数:键长,键能
2
1
共价键
共价晶体
共价晶体的性质特点:一般具有很高的熔沸点和很大的硬度
3
课堂练习
PART 04
1.下列事实不能用键能的大小来解释的是( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生化学反应
C.HF、HCl、HBr、HI的热稳定性逐渐减弱
D.F2比O2更容易与H2反应
B
2.对比以下几个反应式:
Cl+Cl―→Cl2 ΔH1=-247 kJ·mol-1;
O+O―→O2 ΔH2=-493 kJ·mol-1;
N+N―→N2 ΔH3=-946 kJ·mol-1。
可以得出的结论是( )
A.在常温下氮气比氧气和氯气稳定
B.氮、氧和氯的单质常温下为气体
C.氮、氧和氯都是双原子分子
D.氮气、氧气和氯气的密度不同
A
B
C
Thanks
好好学习天天向上
专题3 微粒间作用力与物质性质
第三单元 共价键 共价晶体
3.3.2 共价键的参数
共价晶体
核心素养目标
宏观辨识与微观探析:
引导学生从微观层面深入理解共价键键能与键长概念,明晰原子结构、原子半径对键能、键长的影响机制,助力学生以共价键理论为基础,剖析共价晶体结构特点,理解原子间共价键作用对晶体宏观性质的决定性影响。
证据推理与模型认知:
组织学生分析键能数据、化学反应热数据及晶体结构数据,归纳键能、键长变化规律,推导键能与反应热、晶体性质关联,引导学生运用构建的模型,预测未知共价化合物稳定性、反应热及新共价晶体性质,通过实例验证与修正模型,强化模型应用与创新思维。
教学重难点
重点
透彻讲解共价键键能、键长概念内涵,运用图表、实例对比不同共价键键能、键长数据,详细分析键能与共价键稳定性、分子稳定性关系
系统阐述共价晶体结构特征与性质关联,借助模型、动画展示金刚石、二氧化硅等晶体原子排列、共价键网络结构,深入分析结构如何决定其高熔沸点、高硬度、不导电性等性质。
难点
巧妙化解利用键能计算反应热的难点,精选典型化学反应实例,逐步引导学生分析反应物、生成物键能组成,清晰展示计算过程与原理,深入阐释共价晶体结构复杂性,通过构建多维晶体结构模型、剖析晶体晶胞结构,详细讲解原子配位情况、共价键键角与键长在空间结构中的分布规律
大家都知道氢气在氯气中燃烧会生成氯化氢气体,这个反应会放出热量。那为什么会放出热量呢?这其实就和我们今天要深入探究的共价键键能密切相关。再比如,我们生活中常见的金刚石,它是自然界中硬度非常大的物质,还有二氧化硅,它是沙子、石英的主要成分,这些物质都具有一些特殊的性质。它们为什么会有这么高的硬度和独特的物理性质呢?这是因为它们属于一种特殊的晶体 —— 共价晶体,而共价晶体的性质又和其中的共价键有着千丝万缕的联系。
接下来,就让我们一起深入探究共价键键能以及共价晶体的奥秘,去寻找这些问题的答案吧!
课前导入
键参数
PART 01
共价键的键长
(1)定义:形成共价键的两个原子核间的平均间距
(2)与共价键稳定性的关系:一般而言,共价键的键长越长,共价键就越强,键就越牢固。
(3)定性判定键长的方法:
①根据原子半径判断:在其他条件相同时,成键原子的半径越小,键长越短。如键长:H—I>H—Cl>H—F>Br—Br>Cl—Cl>F—F>;
Si—Si>Si—C>C—C
②根据共用电子对数判断:就相同的两原子形成的共价键而言,单间键长>双键键长>三键键长
共价键的键能
(1)概念:在101 kPa、298 K条件下,1 mol气态AB分子生成气态A原子和B原子的过程中所吸收的能量,称为AB间共价键的键能。其单位为kJ·mol-1。
(2)应用
①判断共价键的稳定性
原子间形成共价键时,原子轨道重叠程度越大,释放能量越多,所形成的共价键键能越大,共价键越稳定。
②判断分子的稳定性
一般来说,结构相似的分子,共价键的键能越大,分子越稳定。
③利用键能计算反应热:ΔH=反应物的总键能-生成物的总键能。
键能与反应热的关系
(1)化学反应的实质:旧化学键的断裂和新化学键的形成。
(2)化学反应中能量变化的原因:断裂反应物中旧化学键需要吸收能量,形成生成物中新的化学键需要放出能量,吸收的能量和放出的能量不相等,导致化学反应中产生能量变化
(3)放热反应和吸热反应:如果化学反应中旧化学键断裂所吸收的总能量大于新化学键形成所放出的总能量,该化学反应为吸热反应;反之,该化学反应为放热反应。
(4)化学反应中的能量变化与键能的关系:△H=E反应物—E生成物
表3-4为部分共价键的键长和键能,根据表中数据回答如下问题
深度思考
1.N2、O2、F2与H2的反应能力依次增强,从键能的角度如何理解这一化学事实。
从表3-4的数据可知,H—N键、H—O键与H—F键的键能依次增大,意味着形成这些键时放出的能量依次增大,化学键越来越稳定。所以N2、O2、F2与H2的反应能力依次增强。
2.为什么F—F键的键长比Cl—Cl键的键长短,但键能却比Cl—Cl键的键能小?
氟原子的半径很小,因而F—F键的键长比Cl—Cl键的键长短,但也是由于F—F键的键长短,两个氟原子在形成共价键时,原子核之间的距离就小,排斥力大,因此键能比Cl—Cl键的键能小。
典例解析
下列分子中,最难分裂成原子的是( )
A.HF B.HCl C.HBr D.HI
A
【解析】一般来说,原子半径越小,其原子形成的共价键键长越短,键能越大,就越难断键。原子半径:F
共价晶体
PART 02
晶体中所有原子通过共价键结合,形成空间网状结构,像这样的晶体叫做共价晶体,晶体硅(Si)、金刚砂(SiC)、二氧化硅(SiO2)等都属于共价晶体。
共价晶体
金刚石、用金刚石制成的钻头和金刚石晶胞
共价晶体的物理性质
①熔、沸点很高:
共价晶体中,原子间通过共价键结合,熔化时破坏共价键,共价键键能较大,需要很高的能量
②硬度大:
共价晶体中原子间通过共价键结合形成的空间网状结构决定了共价晶体的硬度,如金刚石是天然存在的最硬的物质
③一般不导电:
构成微粒是原子,固态和熔融状态下都不导电
典型共价晶体——金刚石
①在晶体中每个碳原子以4个共价单键对称地与相邻的4个碳原子相结合,形成正四面体结构,这些正四面体向空间发展,构成彼此联结的立体网状结构。
②晶体中相邻碳碳键的夹角为109°28′。
③最小环上有6个碳原子,晶体中C原子个数与C—C键数之比为1∶2。
④每个金刚石晶胞中含有8个碳原子。
典型共价晶体——二氧化硅
①每个硅原子都以4个共价单键与4个氧原子结合,每个氧原子与2个硅原子结合,向空间扩展,构成空间网状结构。
②晶体中最小的环为6个硅原子、6个氧原子组成的12元环,硅、氧原子个数比为1∶2。
③每个二氧化硅晶胞中含有8个硅原子和16个氧原子。
晶体硅(Si)和金刚砂(SiC)都是与金刚石相似的共价晶体,请根据表3-5中的数据,分析其熔点、硬度的大小与其结构之间的关系。
对于结构相似的共价晶体而言,共价键的键长越长,键能就越小,晶体的熔、沸点越低,硬度越小。
典例解析
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法不正确的是( )
A.该晶体属于共价晶体,其化学键比金刚石中的碳碳键更牢固
B.该晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
C.该晶体与金刚石相似,碳原子个数与碳氮键个数之比为1∶2
D.该晶体中碳原子和氮原子的最外层都满足8电子稳定结构
C
【解析】C3N4晶体具有比金刚石还大的硬度,则该晶体属于共价晶体,其化学键比金刚石更牢固,A正确;C的最外层有4个电子,因此一个碳原子连接4个N原子,N的最外层有5个电子,因此一个N原子连接3个C原子,B正确;根据以上分析可知该晶体中碳原子个数与碳氮键个数之比为1∶4,C错误;构成该晶体的微粒间只以单键结合,每个碳原子连接4个氮原子,每个氮原子连接3个碳原子,则晶体中碳原子和氮原子的最外层都满足8电子稳定结构,D正确。
典例解析
课堂小结
PART 03
共价键晶体的结构特征:空间网状结构
共价键参数:键长,键能
2
1
共价键
共价晶体
共价晶体的性质特点:一般具有很高的熔沸点和很大的硬度
3
课堂练习
PART 04
1.下列事实不能用键能的大小来解释的是( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生化学反应
C.HF、HCl、HBr、HI的热稳定性逐渐减弱
D.F2比O2更容易与H2反应
B
2.对比以下几个反应式:
Cl+Cl―→Cl2 ΔH1=-247 kJ·mol-1;
O+O―→O2 ΔH2=-493 kJ·mol-1;
N+N―→N2 ΔH3=-946 kJ·mol-1。
可以得出的结论是( )
A.在常温下氮气比氧气和氯气稳定
B.氮、氧和氯的单质常温下为气体
C.氮、氧和氯都是双原子分子
D.氮气、氧气和氯气的密度不同
A
B
C
Thanks
好好学习天天向上
