4.2.1配合物的形成与应用(教学课件)(共31张PPT)_高中化学苏教版选择性必修二(2019)
文档属性
| 名称 | 4.2.1配合物的形成与应用(教学课件)(共31张PPT)_高中化学苏教版选择性必修二(2019) |

|
|
| 格式 | pptx | ||
| 文件大小 | 24.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-07 21:13:46 | ||
图片预览











文档简介
(共31张PPT)
专题4 分子空间结构与物质性质
第二单元 配合物的形和应用
4.2.1 配合物的形成
核心素养目标
宏观辨识与微观探析:
通过实验现象,如铜氨配合物形成过程中沉淀的溶解与溶液颜色变化,从宏观层面认识配合物的形成;
能从微观角度理解配合物的组成、成键情况,建立宏观现象与微观结构的联系,培养学生从微观角度解释宏观化学现象的能力。
证据推理与模型认知:
依据配合物的相关实验事实建立证据意识,能基于证据对配合物的结构、性质及变化提出可能的假设,并通过推理加以证实或证伪;构建配合物的组成、结构和性质的思维模型,运用模型解释化学现象,预测配合物的相关性质。
教学重难点
重点
配合物的概念、组成和结构,包括中心原子、配位体、配位原子、配位数等;配合物的形成条件,即中心原子有空轨道、配位体有孤电子对;
配合物在不同领域的应用,如化学分析、工业生产、生命体中的作用等。
难点
理解配合物的成键本质和空间结构,如配位键的形成过程、配合物离子的空间构型判断;
掌握配合物形成对物质性质的影响,如溶解性、颜色、稳定性的改变;
学会分析复杂配合物的组成和结构,以及根据实验现象推断配合物的相关性质 。
同学们,在生活中我们可能都有过这样的经历,当衣服上不小心沾上铁锈时,用普通的洗涤剂很难洗净,但有一种特殊的 “除锈剂” 却能轻松搞定。大家知道这背后的化学原理吗?其实,这和我们今天要学习的配合物密切相关。配合物在我们的生活、生产以及科学研究中无处不在,它有着独特的结构和性质,能发挥许多神奇的作用。就像我们熟悉的血红蛋白,它能携带氧气为我们的身体提供能量,而血红蛋白就是一种含有铁离子的配合物。现在,就让我们一起走进配合物的奇妙世界,探索它的形成奥秘以及广泛应用 。
课前导入
配合物的形成
PART 01
【实验1】向试管中加入2 mL 5%的硫酸铜溶液,再逐滴加入浓氨水,边滴边振荡,观察并记录实验现象。
【实验2】取5%的氯化铜溶液、5%的硝酸铜溶液各2 mL,分别逐滴加入浓氨水,观察并记录实验现象。
配合物的制备
配合物的制备
实验现象:
三支试管中先生成蓝色沉淀,随浓氨水的滴入,沉淀逐渐溶解,最后变为深蓝色溶液。
结论:
生成蓝色沉淀Cu(OH)2且溶于浓氨水
反应方程式:
Cu2++2NH3·H2O=Cu(OH)2↓+;
Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
配合物的制备
配合物的概念
由提供孤电子对的分子或离子(称为配位体)与接受孤电子对的原子或离子(称为中心原子)以配位键结合形成的化合物称为配位化合物,简称配合物。
如[Zn(NH3)4]SO4、[Co(NH3)6]Cl3等均为配合物
配合物的形成
以[Cu(NH3)4]2+为例:
NH3分子中N原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的N原子通过共用N原子提供的孤电子对形成配位键。配离子[Cu(NH3)4]2+与组成配合物[Cu(NH3)4]SO4
形成条件:
中心原子必须存在空轨道,配位体存在孤电子对,且孤电子对能够填充到中心原子的空轨道里,二者之间形成配位键
配合物的组成
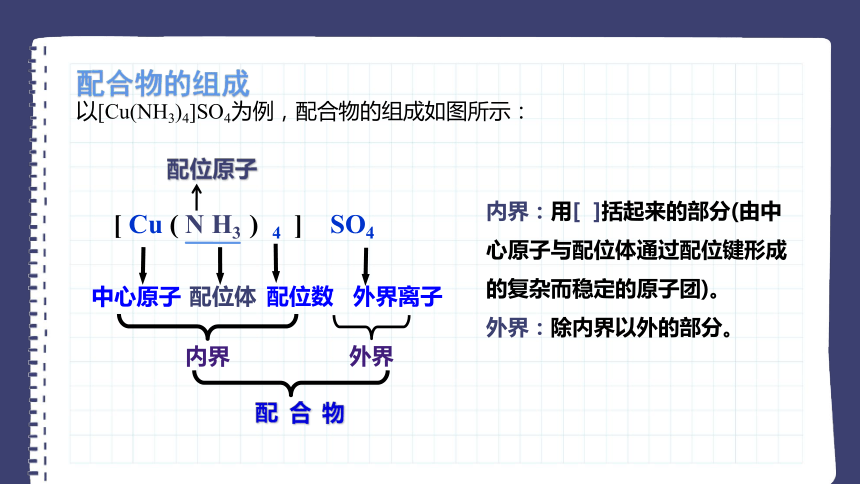
以[Cu(NH3)4]SO4为例,配合物的组成如图所示:
[ Cu ( N H3 ) 4 ] SO4
中心原子
配位体
配位数
外界离子
内界
外界
配 合 物
配位原子
内界:用[ ]括起来的部分(由中心原子与配位体通过配位键形成的复杂而稳定的原子团)。
外界:除内界以外的部分。
配合物的组成
中心原子
提供空轨道,接受孤电子对。通常是过渡金属元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+
配合物的中心原子不一定是阳离子,也可能是原子
许多过渡金属元素的离子对多种配位体具有很强的结合力,因而,过渡金属配合物远比驻足金属配合物多
配合物的组成
配位体
提供孤电子对的分子或离子,如分子CO、NH3、H2O,阴离子F-、CN-、Cl-等
配位原子
配位体中直接同中心原子配位的原子叫做配位原子。配位原子必须是含有孤对电子的与原子,如NH3中的N原子,H2O分子中的O原子等。
配合物的组成
配位数
配合物离子的电荷数
配合物中心原子周围的配位原子的个数,但配位数不一定等于配位体的数目
配离子的点合数等于中心原子与配位体总电荷数的代数和。
简称配离子
配合物的结构
PART 02
配合物的异构现象
定义:
配合物化学组成相同,但原子间连接方式或空间排列方式不同而引起配合物结构性质不同的现象。
产生异构现象原因:
①含有两种或两种以上配位体;
②配位体空间排列方式不同。
配合物的异构现象
顺式异构体:同种配位体处于相邻位置。
反式异构体:同种配位体处于对角位置。
例如Pt(NH3)2Cl2有顺式和反式两种异构体。
顺、反异构体在颜色、极性、溶解性、活性等方面都有差异。
配合物的异构现象
顺式Pt(NH3)2Cl2和反式Pt(NH3)2Cl2的颜色、在水中的溶解性等性质有一定的差异。
配合物 颜色 极性 在水中的溶解性(100 g水中) 抗癌活性
A 棕黄色 极性 0.257 7 g 有活性
B 淡黄色 非极性 0.036 6 g 无活性
配合物A和配合物B中,哪一种是顺式Pt(NH3)2Cl2,哪一种是反式Pt(NH3)2Cl2
配合物A为顺式Pt(NH3)2Cl2,配合物B为反式Pt(NH3)2Cl2。因为顺式Pt(NH3)2Cl2的空间结构不对称,正电荷重心和负电荷重心不能重合,为极性分子;而反式Pt(NH3)2Cl2分子空间结构对称,为非极性分子。根据“相似相溶规则”可知,顺式分子更易溶于水。
配合物离子的空间结构
配合物的中心原子、配位体的种类和数目不同,可以形成不同空间结构的配合物。例如,[Ag(NH3)2]+、[Zn(NH3)4]2+、[Ni(CN)4]2-和[AlF6]3-的空间结构都不一样
配合物结构特点
(1)配合物整体(包括内界和外界)显电中性,外界离子所带电荷总数等于配离子的电荷数。如K3[Fe(CN)6],外界总电荷数为+3,内界为-3,又知CN-为-1价,中心原子Fe为+3价。
(2)一个中心原子(离子)可同时结合多种配位体。如[Cr(H2O)5Cl]Cl2·H2O,配位体是H2O和Cl-,配位数为6。
(3)配合物的内界不仅可为阳离子、阴离子,还可以是中性分子。如K3[Fe(CN)6],内界为[Fe(CN)6]3-,Fe(CO)5为电中性,没有外界。
配合物结构特点
(4)对于具有内外界的配合物,中心原子和配位体通过配位键结合,一般很难发生解离;内、外界之间以离子键结合,在水溶液中较易电离。
可以通过实验方法确定有些配合物的内界和外界,如[Co(NH3)5Cl]Cl2,由于外界的Cl-易电离,可以通过实验测定外界含有的Cl-个数,从而确定配合物的化学式。
(5)配位键是一种特殊的共价键,具有饱和性和方向性。
配合物的空间结构
配位数:2
框架结构:直线形
结构示意图:
实例:[Ag(NH3)2]+、[Ag(CN)2]-
配位数:4
框架结构:正四面体
结构示意图:
实例:[ZnCl4]2-、[Cd(CN)4]2-、[CoCl4]2-、[Cd(NH3)4]2+
配合物的空间结构
配位数:4
框架结构:平面正方形
结构示意图:
实例:[PtCl4]2-、[Ni(CN)4]2-、[Cu(NH3)4]2+
配位数:6
框架结构:八面体
结构示意图:
实例:[AlF6]3-、[SiF6]2-、[Fe(CN)6]3-
课堂小结
PART 03
配合物的形成
配合物的形成
形成过程
配位化合物
形成条件
空间结构
顺反异构
空间异构
概念
组成
内界和外界
配位体和配位原子
配位数
课堂练习
PART 04
1.普鲁士蓝的化学式为Fe4[Fe(CN)6]3,下列说法正确的是( )
A.该物质中Fe2+与Fe3+数目之比为4∶3
B.1 mol该物质中含σ键数目为18NA
C.该物质中只存在共价键和配位键,不存在离子键
D.Fe3+的核外电子排布为[Ar]3d5
D
2.顺铂[Pt(NH3)2Cl2]是1969年发现的第一种具有抗癌活性的金属配合物;碳铂(如图所示)是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,其毒副作用低于顺铂。下列说法正确的是( )
A.碳铂中所有碳原子在同一平面上
B.碳铂的中心原子铂(Ⅱ)的配位数为4
C.顺铂分子中N原子的杂化方式是sp2
D.1 mol 1,1-环丁二羧酸二氨合铂(Ⅱ)含有σ键的数目为12NA
B
3.实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+,下列说法正确的是( )
A.铁元素位于周期表第4周期ⅧB族,属于ds区
B.FeCl3与KSCN溶液混合,得到的配合物K2[Fe(SCN)5]中,提供空轨道的是Fe3+,配体是SCN-,配位数是5
C.K4[Fe(CN)6]中含有离子键、极性共价键和非极性共价键
D.K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀(普鲁士蓝),其化学式为Fe4[Fe(CN)6]3,普鲁士蓝的内界是[Fe(CN)6]4-,其中Fe元素为+3价,外界是Fe2+
B
4.配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是( )
A.此配合物中存在离子键、配位键、极性键
B.配离子为[Fe(CN)5(NO)]2-,中心原子为Fe3+,配位数为6,配位原子只有C
C.1 mol配合物中含σ键数目为12NA
D.该配合物为离子化合物,易电离,1 mol配合物电离共得到3NA阴、阳离子
B
Thanks
好好学习天天向上
专题4 分子空间结构与物质性质
第二单元 配合物的形和应用
4.2.1 配合物的形成
核心素养目标
宏观辨识与微观探析:
通过实验现象,如铜氨配合物形成过程中沉淀的溶解与溶液颜色变化,从宏观层面认识配合物的形成;
能从微观角度理解配合物的组成、成键情况,建立宏观现象与微观结构的联系,培养学生从微观角度解释宏观化学现象的能力。
证据推理与模型认知:
依据配合物的相关实验事实建立证据意识,能基于证据对配合物的结构、性质及变化提出可能的假设,并通过推理加以证实或证伪;构建配合物的组成、结构和性质的思维模型,运用模型解释化学现象,预测配合物的相关性质。
教学重难点
重点
配合物的概念、组成和结构,包括中心原子、配位体、配位原子、配位数等;配合物的形成条件,即中心原子有空轨道、配位体有孤电子对;
配合物在不同领域的应用,如化学分析、工业生产、生命体中的作用等。
难点
理解配合物的成键本质和空间结构,如配位键的形成过程、配合物离子的空间构型判断;
掌握配合物形成对物质性质的影响,如溶解性、颜色、稳定性的改变;
学会分析复杂配合物的组成和结构,以及根据实验现象推断配合物的相关性质 。
同学们,在生活中我们可能都有过这样的经历,当衣服上不小心沾上铁锈时,用普通的洗涤剂很难洗净,但有一种特殊的 “除锈剂” 却能轻松搞定。大家知道这背后的化学原理吗?其实,这和我们今天要学习的配合物密切相关。配合物在我们的生活、生产以及科学研究中无处不在,它有着独特的结构和性质,能发挥许多神奇的作用。就像我们熟悉的血红蛋白,它能携带氧气为我们的身体提供能量,而血红蛋白就是一种含有铁离子的配合物。现在,就让我们一起走进配合物的奇妙世界,探索它的形成奥秘以及广泛应用 。
课前导入
配合物的形成
PART 01
【实验1】向试管中加入2 mL 5%的硫酸铜溶液,再逐滴加入浓氨水,边滴边振荡,观察并记录实验现象。
【实验2】取5%的氯化铜溶液、5%的硝酸铜溶液各2 mL,分别逐滴加入浓氨水,观察并记录实验现象。
配合物的制备
配合物的制备
实验现象:
三支试管中先生成蓝色沉淀,随浓氨水的滴入,沉淀逐渐溶解,最后变为深蓝色溶液。
结论:
生成蓝色沉淀Cu(OH)2且溶于浓氨水
反应方程式:
Cu2++2NH3·H2O=Cu(OH)2↓+;
Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
配合物的制备
配合物的概念
由提供孤电子对的分子或离子(称为配位体)与接受孤电子对的原子或离子(称为中心原子)以配位键结合形成的化合物称为配位化合物,简称配合物。
如[Zn(NH3)4]SO4、[Co(NH3)6]Cl3等均为配合物
配合物的形成
以[Cu(NH3)4]2+为例:
NH3分子中N原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的N原子通过共用N原子提供的孤电子对形成配位键。配离子[Cu(NH3)4]2+与组成配合物[Cu(NH3)4]SO4
形成条件:
中心原子必须存在空轨道,配位体存在孤电子对,且孤电子对能够填充到中心原子的空轨道里,二者之间形成配位键
配合物的组成
以[Cu(NH3)4]SO4为例,配合物的组成如图所示:
[ Cu ( N H3 ) 4 ] SO4
中心原子
配位体
配位数
外界离子
内界
外界
配 合 物
配位原子
内界:用[ ]括起来的部分(由中心原子与配位体通过配位键形成的复杂而稳定的原子团)。
外界:除内界以外的部分。
配合物的组成
中心原子
提供空轨道,接受孤电子对。通常是过渡金属元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+
配合物的中心原子不一定是阳离子,也可能是原子
许多过渡金属元素的离子对多种配位体具有很强的结合力,因而,过渡金属配合物远比驻足金属配合物多
配合物的组成
配位体
提供孤电子对的分子或离子,如分子CO、NH3、H2O,阴离子F-、CN-、Cl-等
配位原子
配位体中直接同中心原子配位的原子叫做配位原子。配位原子必须是含有孤对电子的与原子,如NH3中的N原子,H2O分子中的O原子等。
配合物的组成
配位数
配合物离子的电荷数
配合物中心原子周围的配位原子的个数,但配位数不一定等于配位体的数目
配离子的点合数等于中心原子与配位体总电荷数的代数和。
简称配离子
配合物的结构
PART 02
配合物的异构现象
定义:
配合物化学组成相同,但原子间连接方式或空间排列方式不同而引起配合物结构性质不同的现象。
产生异构现象原因:
①含有两种或两种以上配位体;
②配位体空间排列方式不同。
配合物的异构现象
顺式异构体:同种配位体处于相邻位置。
反式异构体:同种配位体处于对角位置。
例如Pt(NH3)2Cl2有顺式和反式两种异构体。
顺、反异构体在颜色、极性、溶解性、活性等方面都有差异。
配合物的异构现象
顺式Pt(NH3)2Cl2和反式Pt(NH3)2Cl2的颜色、在水中的溶解性等性质有一定的差异。
配合物 颜色 极性 在水中的溶解性(100 g水中) 抗癌活性
A 棕黄色 极性 0.257 7 g 有活性
B 淡黄色 非极性 0.036 6 g 无活性
配合物A和配合物B中,哪一种是顺式Pt(NH3)2Cl2,哪一种是反式Pt(NH3)2Cl2
配合物A为顺式Pt(NH3)2Cl2,配合物B为反式Pt(NH3)2Cl2。因为顺式Pt(NH3)2Cl2的空间结构不对称,正电荷重心和负电荷重心不能重合,为极性分子;而反式Pt(NH3)2Cl2分子空间结构对称,为非极性分子。根据“相似相溶规则”可知,顺式分子更易溶于水。
配合物离子的空间结构
配合物的中心原子、配位体的种类和数目不同,可以形成不同空间结构的配合物。例如,[Ag(NH3)2]+、[Zn(NH3)4]2+、[Ni(CN)4]2-和[AlF6]3-的空间结构都不一样
配合物结构特点
(1)配合物整体(包括内界和外界)显电中性,外界离子所带电荷总数等于配离子的电荷数。如K3[Fe(CN)6],外界总电荷数为+3,内界为-3,又知CN-为-1价,中心原子Fe为+3价。
(2)一个中心原子(离子)可同时结合多种配位体。如[Cr(H2O)5Cl]Cl2·H2O,配位体是H2O和Cl-,配位数为6。
(3)配合物的内界不仅可为阳离子、阴离子,还可以是中性分子。如K3[Fe(CN)6],内界为[Fe(CN)6]3-,Fe(CO)5为电中性,没有外界。
配合物结构特点
(4)对于具有内外界的配合物,中心原子和配位体通过配位键结合,一般很难发生解离;内、外界之间以离子键结合,在水溶液中较易电离。
可以通过实验方法确定有些配合物的内界和外界,如[Co(NH3)5Cl]Cl2,由于外界的Cl-易电离,可以通过实验测定外界含有的Cl-个数,从而确定配合物的化学式。
(5)配位键是一种特殊的共价键,具有饱和性和方向性。
配合物的空间结构
配位数:2
框架结构:直线形
结构示意图:
实例:[Ag(NH3)2]+、[Ag(CN)2]-
配位数:4
框架结构:正四面体
结构示意图:
实例:[ZnCl4]2-、[Cd(CN)4]2-、[CoCl4]2-、[Cd(NH3)4]2+
配合物的空间结构
配位数:4
框架结构:平面正方形
结构示意图:
实例:[PtCl4]2-、[Ni(CN)4]2-、[Cu(NH3)4]2+
配位数:6
框架结构:八面体
结构示意图:
实例:[AlF6]3-、[SiF6]2-、[Fe(CN)6]3-
课堂小结
PART 03
配合物的形成
配合物的形成
形成过程
配位化合物
形成条件
空间结构
顺反异构
空间异构
概念
组成
内界和外界
配位体和配位原子
配位数
课堂练习
PART 04
1.普鲁士蓝的化学式为Fe4[Fe(CN)6]3,下列说法正确的是( )
A.该物质中Fe2+与Fe3+数目之比为4∶3
B.1 mol该物质中含σ键数目为18NA
C.该物质中只存在共价键和配位键,不存在离子键
D.Fe3+的核外电子排布为[Ar]3d5
D
2.顺铂[Pt(NH3)2Cl2]是1969年发现的第一种具有抗癌活性的金属配合物;碳铂(如图所示)是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,其毒副作用低于顺铂。下列说法正确的是( )
A.碳铂中所有碳原子在同一平面上
B.碳铂的中心原子铂(Ⅱ)的配位数为4
C.顺铂分子中N原子的杂化方式是sp2
D.1 mol 1,1-环丁二羧酸二氨合铂(Ⅱ)含有σ键的数目为12NA
B
3.实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+,下列说法正确的是( )
A.铁元素位于周期表第4周期ⅧB族,属于ds区
B.FeCl3与KSCN溶液混合,得到的配合物K2[Fe(SCN)5]中,提供空轨道的是Fe3+,配体是SCN-,配位数是5
C.K4[Fe(CN)6]中含有离子键、极性共价键和非极性共价键
D.K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀(普鲁士蓝),其化学式为Fe4[Fe(CN)6]3,普鲁士蓝的内界是[Fe(CN)6]4-,其中Fe元素为+3价,外界是Fe2+
B
4.配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是( )
A.此配合物中存在离子键、配位键、极性键
B.配离子为[Fe(CN)5(NO)]2-,中心原子为Fe3+,配位数为6,配位原子只有C
C.1 mol配合物中含σ键数目为12NA
D.该配合物为离子化合物,易电离,1 mol配合物电离共得到3NA阴、阳离子
B
Thanks
好好学习天天向上
