4.2.2配合物的形成与应用(教学课件)(共31张PPT)_高中化学苏教版选择性必修二(2019)
文档属性
| 名称 | 4.2.2配合物的形成与应用(教学课件)(共31张PPT)_高中化学苏教版选择性必修二(2019) |  | |
| 格式 | pptx | ||
| 文件大小 | 40.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-07 21:19:11 | ||
图片预览









文档简介
专题4 分子空间结构与物质性质
第二单元 配合物的形和应用
4.2.2 配合物的应用
核心素养目标
宏观辨识与微观探析:
能从宏观上观察配合物形成时颜色、溶解度、酸碱性变化等现象,从微观层面理解配合物的结构,认识配位键的形成对物质性质的影响,建立宏观现象与微观结构的联系。
证据推理与模型认知:
通过分析配合物稳定性的相关实例,如血红素与 CO、O?结合的差异,依据实验现象和数据进行推理,构建配合物稳定性与配位体性质、配位键强弱关系的认知模型
教学重难点
重点
理解配合物形成对物质颜色、溶解度、酸碱性和稳定性的影响;
掌握配合物在检验金属离子、分离物质、工业生产等方面的应用。
难点
从微观角度解释配合物稳定性与配位体性质、配位键强弱的关系;
运用配合物知识解决实际问题,如分析炼金废水处理原理、理解王水溶解金的原因等 。
同学们,在我们的生活中,常常会遇到一些有趣的化学现象。比如,大家有没有注意到,在检验食物中是否含有铁元素时,有一种神奇的试剂能让含有铁元素的溶液变成血红色。其实,这背后就隐藏着配合物的奥秘。这种试剂就是硫氰化钾(KSCN),它能与铁离子发生反应,生成一种血红色的配合物。再看这个例子,医院在检测糖尿病患者尿液中的葡萄糖含量时,会用到一种特殊的试剂 —— 新制氢氧化铜碱性悬浊液,它能与葡萄糖中的醛基反应,产生砖红色沉淀,而这个过程也涉及到配合物的知识。配合物在我们的生活、生产和科学实验中无处不在,它们有着独特的性质和广泛的应用。今天,就让我们一起走进配合物的奇妙世界
课前导入
配合物的形成对性质的影响
PART 01
【实验1】在5%的硝酸银溶液中逐滴加入2 mol·L-1氨水,直至生成的沉淀恰好全部溶解为止,制得银氨溶液。取银氨溶液5 mL于试管A中,加入2~3 mL 10%的葡萄糖溶液,将试管放在盛水的烧杯中缓慢加热,静置片刻。
实验探究
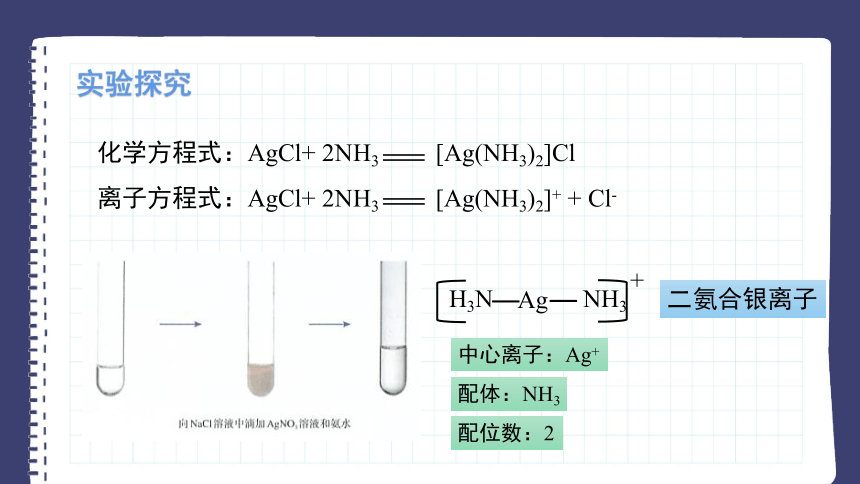
化学方程式:AgCl+ 2NH3 [Ag(NH3)2]Cl
离子方程式:AgCl+ 2NH3 [Ag(NH3)2]+ + Cl-
Ag
NH3
H3N
+
二氨合银离子
配体:NH3
中心离子:Ag+
配位数:2
【实验2】①向一支试管中加入3 mL 2%的氯化铁溶液,再滴入2~3滴2%的硫氰化钾(KSCN)溶液,观察实验现象。
实验探究
如Fe3+与SCN-在溶液中可生成配位数为1~6的配离子,这些配离子的颜色是红色的。
SCN-作为配体与Fe3+配位,显红色,用于检验Fe3+
硫氰化铁配离子的颜色
Fe3+ + SCN- ?Fe(SCN)2+
?
Fe(SCN)2+ + SCN-?????????(????????????)2 +
?
…………
????????(????????????)52? + SCN- ?????????(????????????)6 3?
?
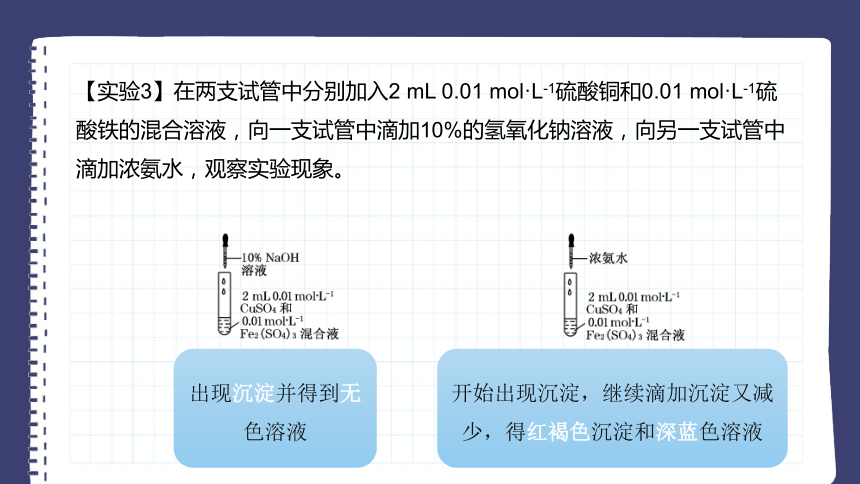
【实验3】在两支试管中分别加入2 mL 0.01 mol·L-1硫酸铜和0.01 mol·L-1硫酸铁的混合溶液,向一支试管中滴加10%的氢氧化钠溶液,向另一支试管中滴加浓氨水,观察实验现象。
出现沉淀并得到无色溶液
开始出现沉淀,继续滴加沉淀又减少,得红褐色沉淀和深蓝色溶液
实验探究
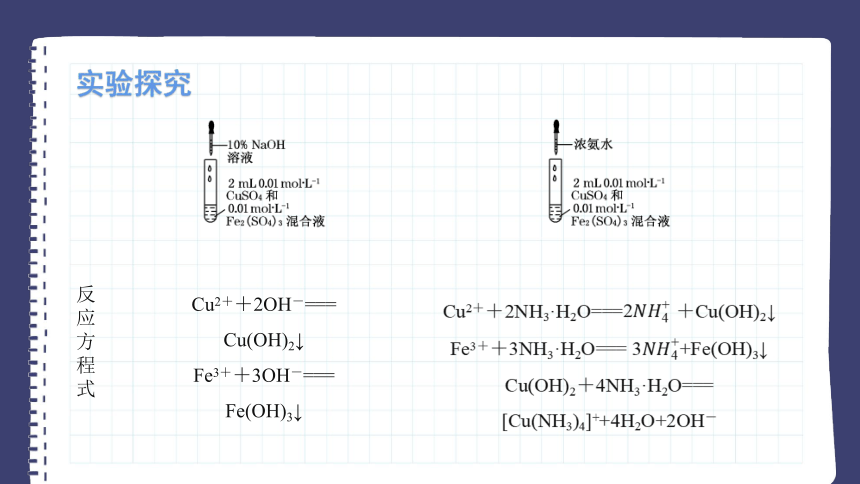
反应方程式
Cu2++2OH-=== Cu(OH)2↓
Fe3++3OH-=== Fe(OH)3↓
Cu2++2NH3·H2O===2????????4+ +Cu(OH)2↓
Fe3++3NH3·H2O=== 3????????4++Fe(OH)3↓
Cu(OH)2+4NH3·H2O=== [Cu(NH3)4]++4H2O+2OH-
?
配合物的形成对性质的影响
1.颜色的改变
当简单离子形成配离子时其性质往往有很大的差异。颜色发生变化就是一种常见的现象,据此可以判断配离子是否生成。如Fe3+与SCN-在溶液中可生成配位数为1~6的铁的硫氰酸根配离子(血红色),反应的离子方程式为
Fe3++nSCN-===[Fe(SCN)n](3-n)+
2.溶解度的改变
一些难溶于水的金属氯化物、溴化物、碘化物、氰化物可以依次溶解于过量的Cl-、Br-、I-、CN-和氨中,形成可溶性的配合物。
如难溶的AgCl可溶于过量的浓盐酸和氨水中,形成配合物,反应的离子方程式分别为
AgCl+HCl(浓)===[AgCl2]-+H+;
AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O
配合物的形成对性质的影响
配合物的形成对性质的影响
3.溶液的酸碱性强弱的改变
氢氟酸是一种弱酸,若通入BF3或SiF4气体,由于生成了HBF4、H2SiF6而使溶液成为强酸溶液。配位体与中心原子配合后,可以使其酸性或碱性增强,如Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O碱性增强。
4.稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
(1)配合物的稳定性
配合物具有一定的稳定性。配合物中的配位键越强,配合物越稳定。当作为中心原子的金属原子(或离子)相同时,配合物的稳定性与配位体的性质有关。
(2)配位键的稳定性
①电子对给予体形成配位键的能力:NH3>H2O。
②接受体形成配位键的能力:H+>过渡金属>主族金属。
③配位键越强,配合物越稳定。如Cu2+—OH-<Cu2+—NH3<H+—NH3。
配合物的稳定性
配合物的应用
PART 02
配合物的应用
配合物在许多方面有着广泛的应用。在化学分析中,人们常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成。在生产中,配合物被广泛应用于染色、电镀、硬水软化、金属冶炼领域。例如,夹心配位化合物二茂铁具有高度的热稳定性,常被用作燃料的催化剂和抗爆剂,它的节能消烟效果也非常好。
二茂铁
配位化合物在羊毛染色过程中的作用
为了使羊毛呈现不同的色彩,同时在洗涤和光照的条件下不易褪色,我们可以在染色过程中使用金属盐(如铬、铝、铁、铜盐等)对其进行处理。因羊毛和染料中都含有可与金属离子配位的基团(—NH2、—COOH),染色时,金属离子和染料及羊毛之间发生反应,生成体积较大、溶解度小的配合物,使染料坚固地附着在纤维上,从而改变羊毛的颜色。
在生命科学、抗癌药物、催化剂研制、激光材料、超导材料等许多尖端研究领域中,配合物发挥的作用也越来越大。
配合物在生命体中有着非常重要的作用。
许多酶的作用与其结构中含有形成配位键的金属离子有关。
生物体中能量的转换、传递或电荷转移,化学键的形成或断裂以及伴随这些过程出现的能量变化和分配等,常与金属离子和有机体生成的复杂配合物所起的作用有关。
能输送O2的血红素是Fe2+的卟啉配合物,铁在血红蛋白、肌红蛋白和细胞色素分子中都以Fe2+与原卟啉环形成配合物的形式存在。生物体内的许多酶都包含锌的配合物,已报道的含锌酶有80多种,如羧肽酶A和碳酸酶等。当人体缺锌时,许多酶的活性降低,引起相关代谢紊乱,可使人体发育和生长受阻。
叶绿素的结构示意图 血红素的结构示意图
药物中的配合物
有些具有治疗作用的金属离子因其毒性大、刺激性强、难吸收等缺点而不能直接应用于临床实践,但若把它们变成配合物就能降低毒性和刺激性,利于吸收。例如,顺铂(顺式二氯二氨合铂)是美国化学家罗森伯格等人于1969年发现的第一种具有抗癌活性的金属配合物。临床研究表明,它是一种有效的广谱抗癌药物,对人体的泌尿系统、生殖系统的恶性肿瘤以及甲状腺癌、食道癌、喉癌、头颈部癌等均有显著的治疗效果,但它对肾脏产生的明显伤害以及动物实验表明的致畸作用使它难以推广。20世纪80年代出现毒副作用小的第二代铂类抗癌药物,如碳铂等已用于临床。
碳铂的结构模型
药物中的配合物
将大气中游离态氮转化为化合态氮的过程叫氮的固定。常温、常压下的固氮问题是对人类智慧的一次挑战。早在1888年,科学家就发现豆科植物的根瘤菌能将大气中游离的N2转化为NH3,这一直吸引着世界范围内一大批杰出科学家的高度关注。模拟生物固氮首先要了解固氮酶的组成。化学家实现常温常压固氮的努力沿两条不同的途径进行。一条途径是设法通过模型化合物的研究,合成生物固氮酶。1992年,金和里斯成功地分离出固氮酶并给出X射线分析的结构。另一条途径是通过过渡金属的N2分子配合物活化N≡N键。我们相信,通过科学家坚持不懈的努力,人工常温常压固氮一定能实现。
?
固氮酶中Fe-Mo中心结构示意图
药物中的配合物
当具有空轨道的过渡金属原子或离子遇到可提供孤电子对的分子或离子时,它们之间就会以配位键结合形成配位化合物。配合物的中心原子、配位体的种类和数目不同,导致其结构和性质表现出多样性和复杂性。
通过研究配位化合物的结构和组成特征,人们可以发现和制备出更多具有特殊功能的配合物,以满足生产、生活的多样化需求。基于微观结构探讨物质的性质和用途,这是化学学习和研究过程中重要的科学思想。
课堂小结
PART 03
配合物的应用
化学分析
生产
尖端研究领域
生命体
配合物与生物固氮
许多酶的作用与其结构中形成配位键的金属离子有关
染色
电镀
硬水软化
金属冶炼
课堂练习
PART 04
1.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
( )
A.配合物中中心原子的电荷数和配位数均为6
B.该配合物可能是平面正方形结构
C.Cl-和NH3分子均与Pt4+配位
D.配合物中Cl-与Pt4+配位,而NH3分子与Pt4+不配位
C
2.下列过程与配合物的形成无关的是( )
A.除去Fe粉中的SiO2可用强碱溶液
B.向一定量的AgNO3溶液中加浓氨水至沉淀消失
C.向Fe3+溶液中加入KSCN溶液
D.向一定量的CuSO4溶液中加浓氨水至沉淀消失
A
C
4.已知NH3分子可与Cu2+形成配合物离子[Cu(NH3)4]2+,则除去硫酸铜溶液中的少量硫酸可选用的试剂是( )
A.NaOH ? B.NH3
C.BaCl2?? D.Cu(OH)2
D
Thanks
好好学习天天向上
第二单元 配合物的形和应用
4.2.2 配合物的应用
核心素养目标
宏观辨识与微观探析:
能从宏观上观察配合物形成时颜色、溶解度、酸碱性变化等现象,从微观层面理解配合物的结构,认识配位键的形成对物质性质的影响,建立宏观现象与微观结构的联系。
证据推理与模型认知:
通过分析配合物稳定性的相关实例,如血红素与 CO、O?结合的差异,依据实验现象和数据进行推理,构建配合物稳定性与配位体性质、配位键强弱关系的认知模型
教学重难点
重点
理解配合物形成对物质颜色、溶解度、酸碱性和稳定性的影响;
掌握配合物在检验金属离子、分离物质、工业生产等方面的应用。
难点
从微观角度解释配合物稳定性与配位体性质、配位键强弱的关系;
运用配合物知识解决实际问题,如分析炼金废水处理原理、理解王水溶解金的原因等 。
同学们,在我们的生活中,常常会遇到一些有趣的化学现象。比如,大家有没有注意到,在检验食物中是否含有铁元素时,有一种神奇的试剂能让含有铁元素的溶液变成血红色。其实,这背后就隐藏着配合物的奥秘。这种试剂就是硫氰化钾(KSCN),它能与铁离子发生反应,生成一种血红色的配合物。再看这个例子,医院在检测糖尿病患者尿液中的葡萄糖含量时,会用到一种特殊的试剂 —— 新制氢氧化铜碱性悬浊液,它能与葡萄糖中的醛基反应,产生砖红色沉淀,而这个过程也涉及到配合物的知识。配合物在我们的生活、生产和科学实验中无处不在,它们有着独特的性质和广泛的应用。今天,就让我们一起走进配合物的奇妙世界
课前导入
配合物的形成对性质的影响
PART 01
【实验1】在5%的硝酸银溶液中逐滴加入2 mol·L-1氨水,直至生成的沉淀恰好全部溶解为止,制得银氨溶液。取银氨溶液5 mL于试管A中,加入2~3 mL 10%的葡萄糖溶液,将试管放在盛水的烧杯中缓慢加热,静置片刻。
实验探究
化学方程式:AgCl+ 2NH3 [Ag(NH3)2]Cl
离子方程式:AgCl+ 2NH3 [Ag(NH3)2]+ + Cl-
Ag
NH3
H3N
+
二氨合银离子
配体:NH3
中心离子:Ag+
配位数:2
【实验2】①向一支试管中加入3 mL 2%的氯化铁溶液,再滴入2~3滴2%的硫氰化钾(KSCN)溶液,观察实验现象。
实验探究
如Fe3+与SCN-在溶液中可生成配位数为1~6的配离子,这些配离子的颜色是红色的。
SCN-作为配体与Fe3+配位,显红色,用于检验Fe3+
硫氰化铁配离子的颜色
Fe3+ + SCN- ?Fe(SCN)2+
?
Fe(SCN)2+ + SCN-?????????(????????????)2 +
?
…………
????????(????????????)52? + SCN- ?????????(????????????)6 3?
?
【实验3】在两支试管中分别加入2 mL 0.01 mol·L-1硫酸铜和0.01 mol·L-1硫酸铁的混合溶液,向一支试管中滴加10%的氢氧化钠溶液,向另一支试管中滴加浓氨水,观察实验现象。
出现沉淀并得到无色溶液
开始出现沉淀,继续滴加沉淀又减少,得红褐色沉淀和深蓝色溶液
实验探究
反应方程式
Cu2++2OH-=== Cu(OH)2↓
Fe3++3OH-=== Fe(OH)3↓
Cu2++2NH3·H2O===2????????4+ +Cu(OH)2↓
Fe3++3NH3·H2O=== 3????????4++Fe(OH)3↓
Cu(OH)2+4NH3·H2O=== [Cu(NH3)4]++4H2O+2OH-
?
配合物的形成对性质的影响
1.颜色的改变
当简单离子形成配离子时其性质往往有很大的差异。颜色发生变化就是一种常见的现象,据此可以判断配离子是否生成。如Fe3+与SCN-在溶液中可生成配位数为1~6的铁的硫氰酸根配离子(血红色),反应的离子方程式为
Fe3++nSCN-===[Fe(SCN)n](3-n)+
2.溶解度的改变
一些难溶于水的金属氯化物、溴化物、碘化物、氰化物可以依次溶解于过量的Cl-、Br-、I-、CN-和氨中,形成可溶性的配合物。
如难溶的AgCl可溶于过量的浓盐酸和氨水中,形成配合物,反应的离子方程式分别为
AgCl+HCl(浓)===[AgCl2]-+H+;
AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O
配合物的形成对性质的影响
配合物的形成对性质的影响
3.溶液的酸碱性强弱的改变
氢氟酸是一种弱酸,若通入BF3或SiF4气体,由于生成了HBF4、H2SiF6而使溶液成为强酸溶液。配位体与中心原子配合后,可以使其酸性或碱性增强,如Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O碱性增强。
4.稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
(1)配合物的稳定性
配合物具有一定的稳定性。配合物中的配位键越强,配合物越稳定。当作为中心原子的金属原子(或离子)相同时,配合物的稳定性与配位体的性质有关。
(2)配位键的稳定性
①电子对给予体形成配位键的能力:NH3>H2O。
②接受体形成配位键的能力:H+>过渡金属>主族金属。
③配位键越强,配合物越稳定。如Cu2+—OH-<Cu2+—NH3<H+—NH3。
配合物的稳定性
配合物的应用
PART 02
配合物的应用
配合物在许多方面有着广泛的应用。在化学分析中,人们常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成。在生产中,配合物被广泛应用于染色、电镀、硬水软化、金属冶炼领域。例如,夹心配位化合物二茂铁具有高度的热稳定性,常被用作燃料的催化剂和抗爆剂,它的节能消烟效果也非常好。
二茂铁
配位化合物在羊毛染色过程中的作用
为了使羊毛呈现不同的色彩,同时在洗涤和光照的条件下不易褪色,我们可以在染色过程中使用金属盐(如铬、铝、铁、铜盐等)对其进行处理。因羊毛和染料中都含有可与金属离子配位的基团(—NH2、—COOH),染色时,金属离子和染料及羊毛之间发生反应,生成体积较大、溶解度小的配合物,使染料坚固地附着在纤维上,从而改变羊毛的颜色。
在生命科学、抗癌药物、催化剂研制、激光材料、超导材料等许多尖端研究领域中,配合物发挥的作用也越来越大。
配合物在生命体中有着非常重要的作用。
许多酶的作用与其结构中含有形成配位键的金属离子有关。
生物体中能量的转换、传递或电荷转移,化学键的形成或断裂以及伴随这些过程出现的能量变化和分配等,常与金属离子和有机体生成的复杂配合物所起的作用有关。
能输送O2的血红素是Fe2+的卟啉配合物,铁在血红蛋白、肌红蛋白和细胞色素分子中都以Fe2+与原卟啉环形成配合物的形式存在。生物体内的许多酶都包含锌的配合物,已报道的含锌酶有80多种,如羧肽酶A和碳酸酶等。当人体缺锌时,许多酶的活性降低,引起相关代谢紊乱,可使人体发育和生长受阻。
叶绿素的结构示意图 血红素的结构示意图
药物中的配合物
有些具有治疗作用的金属离子因其毒性大、刺激性强、难吸收等缺点而不能直接应用于临床实践,但若把它们变成配合物就能降低毒性和刺激性,利于吸收。例如,顺铂(顺式二氯二氨合铂)是美国化学家罗森伯格等人于1969年发现的第一种具有抗癌活性的金属配合物。临床研究表明,它是一种有效的广谱抗癌药物,对人体的泌尿系统、生殖系统的恶性肿瘤以及甲状腺癌、食道癌、喉癌、头颈部癌等均有显著的治疗效果,但它对肾脏产生的明显伤害以及动物实验表明的致畸作用使它难以推广。20世纪80年代出现毒副作用小的第二代铂类抗癌药物,如碳铂等已用于临床。
碳铂的结构模型
药物中的配合物
将大气中游离态氮转化为化合态氮的过程叫氮的固定。常温、常压下的固氮问题是对人类智慧的一次挑战。早在1888年,科学家就发现豆科植物的根瘤菌能将大气中游离的N2转化为NH3,这一直吸引着世界范围内一大批杰出科学家的高度关注。模拟生物固氮首先要了解固氮酶的组成。化学家实现常温常压固氮的努力沿两条不同的途径进行。一条途径是设法通过模型化合物的研究,合成生物固氮酶。1992年,金和里斯成功地分离出固氮酶并给出X射线分析的结构。另一条途径是通过过渡金属的N2分子配合物活化N≡N键。我们相信,通过科学家坚持不懈的努力,人工常温常压固氮一定能实现。
?
固氮酶中Fe-Mo中心结构示意图
药物中的配合物
当具有空轨道的过渡金属原子或离子遇到可提供孤电子对的分子或离子时,它们之间就会以配位键结合形成配位化合物。配合物的中心原子、配位体的种类和数目不同,导致其结构和性质表现出多样性和复杂性。
通过研究配位化合物的结构和组成特征,人们可以发现和制备出更多具有特殊功能的配合物,以满足生产、生活的多样化需求。基于微观结构探讨物质的性质和用途,这是化学学习和研究过程中重要的科学思想。
课堂小结
PART 03
配合物的应用
化学分析
生产
尖端研究领域
生命体
配合物与生物固氮
许多酶的作用与其结构中形成配位键的金属离子有关
染色
电镀
硬水软化
金属冶炼
课堂练习
PART 04
1.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
( )
A.配合物中中心原子的电荷数和配位数均为6
B.该配合物可能是平面正方形结构
C.Cl-和NH3分子均与Pt4+配位
D.配合物中Cl-与Pt4+配位,而NH3分子与Pt4+不配位
C
2.下列过程与配合物的形成无关的是( )
A.除去Fe粉中的SiO2可用强碱溶液
B.向一定量的AgNO3溶液中加浓氨水至沉淀消失
C.向Fe3+溶液中加入KSCN溶液
D.向一定量的CuSO4溶液中加浓氨水至沉淀消失
A
C
4.已知NH3分子可与Cu2+形成配合物离子[Cu(NH3)4]2+,则除去硫酸铜溶液中的少量硫酸可选用的试剂是( )
A.NaOH ? B.NH3
C.BaCl2?? D.Cu(OH)2
D
Thanks
好好学习天天向上
