2.3.2化学反应的快慢和限度(教学课件)_(共27张PPT)高中化学鲁科版必修二(2019)
文档属性
| 名称 | 2.3.2化学反应的快慢和限度(教学课件)_(共27张PPT)高中化学鲁科版必修二(2019) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-07 22:35:40 | ||
图片预览







文档简介
(共27张PPT)
第二章 化学键 化学反应规律
第三节 化学反应的快慢和限度
2.3.2 化学反应的限度
核心素养目标
宏观辨识与微观探析:
能从宏观现象(如浓度变化、颜色改变)和微观本质(分子碰撞、反应速率)两个角度理解可逆反应的动态平衡特征。
变化观念与平衡思想:
认识到化学反应存在限度,理解化学平衡是相对的、动态的,外界条件改变会导致平衡移动。
科学探究与创新意识:
通过控制变量法探究温度、浓度等因素对化学平衡的影响,培养实验设计与分析能力
重点
理解可逆反应 “同时、同条件、不完全转化” 的特点
掌握平衡状态的 “逆、等、动、定、变” 五大特征,能通过速率关系和浓度变化判断平衡状态。
难点
从微观角度解释 “v (正)=v (逆)≠0” 的动态平衡本质
区分浓度、压强、平均相对分子质量等物理量是否为平衡标志的条件(如气体分子数变化的反应)
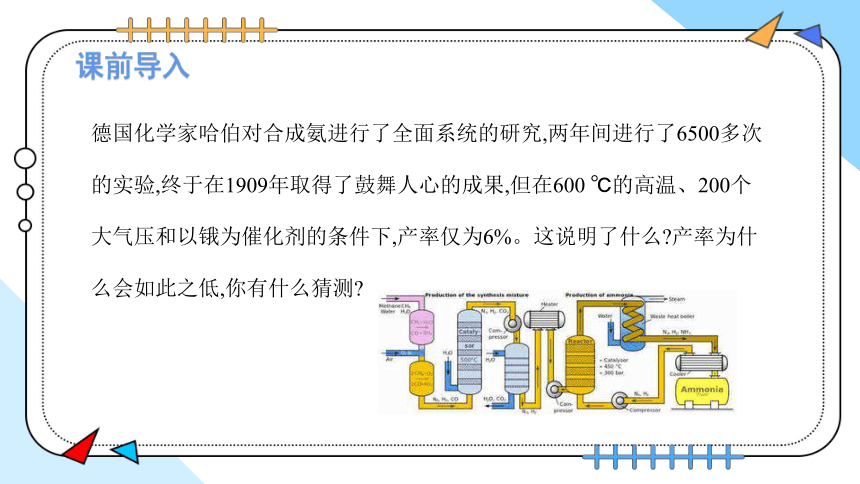
课前导入
课前导入
德国化学家哈伯对合成氨进行了全面系统的研究,两年间进行了6500多次的实验,终于在1909年取得了鼓舞人心的成果,但在600 ℃的高温、200个大气压和以锇为催化剂的条件下,产率仅为6%。这说明了什么 产率为什么会如此之低,你有什么猜测
01
可逆反应
观察·思考
向 2 mL 0.01 mol·L-1KI 溶液中加入 1 mL 0.01 mol·L-1FeCl3 溶液,再加入几滴0.1 mol·L-1 KSCN 溶液,你认为能观察到什么现象?为什么?
◆预测实验现象:
向KI溶液中滴加少量FeCl3溶液,溶液呈棕黄色(生成了碘),在滴加KSCN溶液,溶液无明显变化
◆观察到的实验现象:
向KI溶液中滴加少量FeCl3溶液,溶液呈棕黄色(生成了碘),在滴加KSCN溶液,溶液呈红色
◆实验结论:
即使KI过量,FeCl3也不可能全部转化成FeCl2,即该反应存在限度
实验现象及结论
交流·研讨
某班同学以二氧化硫与氧气生成三氧化硫的反应为例,分析为什么即使氧气过量二氧化硫也不能全部转化成三氧化硫。
信息 1 :实验发现,一定条件下向一密闭容器中充入 SO2 与 18O2,反应一段时间后,核素 18O 存在于 SO2、O2、SO3 中。
信息 2 :密闭容器中 SO2 与 O2 在一定条件下发生反应,反应过程中 SO3 的物质的量的变化趋势如图所示。
★通过实验发现,在二氧化硫与氧气的反应中,无论怎样改变反应条件都不能使二氧化硫全部转化成三氧化硫。这是因为在二氧化硫与氧气发生化合反应生成三氧化硫的同时,三氧化硫也在发生分解反应生成二氧化硫和氧气。
SO2、O2
SO3
SO2、O2和SO3
可逆反应
像这种在相同条件下同时向正、逆两个方向进行的反应称为可逆反应。氨气与水的反应、氮气与氢气生成氨气的反应都属于可逆反应。
在可逆反应的化学方程式中,用“ ”代替“=”,例如
其中,氮气与氢气生成氨气的反应称为正反应,氨气分解为氮气和氢气的反应称为逆反应。
可逆反应的特征
★可逆反应概念中“同一条件”是前提,如葡萄糖在氧气中燃烧可以生成二氧化碳和水,光合作用可将二氧化碳和水变成葡萄糖和氧气,但是两者条件不同,不互为可逆反应。
★对于可逆反应来说,在一定条件下反应物不可能全部转化成产物,反应只能进行到一定的程度,这就是该化学反应在这个条件下所能达到的限度。
★绝大多数化学反应都有一定的可逆性,但有些反应的可逆性小,可视为“不可逆”。
化学反应的限度
◆化学反应限度的概念:
对于可逆反应来说,在一定条件下反应物不可能全部转化成产物,反应只能进行到一定的程度,这就是该化学反应在这个条件下所能达到的限度。
◆对化学反应限度的理解:
①化学反应的限度决定了反应物在一定条件下的最大转化率。
②人们利用这些化学反应进行化工生产时,要同时考虑反应所能达到的限度和化学反应速率这两个方面的问题。
02
化学平衡
化学平衡状态的建立
①反应开始时:v(正)最大,v(逆)为0,原因是反应物浓度最大,生成物浓度为0。
②反应过程中:v(正)逐渐减小,v(逆)逐渐 增大原因是反应物浓度逐渐减小,生成物浓度逐渐增大。
③反应达到平衡时(t1后):v(正)=v(逆),反应物和生成物的浓度不再改变。
化学平衡状态的概念
在二氧化硫与氧气发生的可逆反应中,当反应进行到一定程度时,反应物和生成物的浓度不再随时间的延续而发生变化,反应好像“停滞”了。实际上,这时正反应和逆反应都依然在进行,只是在同一瞬间正反应生成的三氧化硫的物质的量与逆反应消耗的三氧化硫的物质的量相等而已。
在一定条件下可逆反应进行到一定程度时,反应物和生成物的浓度不再随时间的延长而发生变化,正反应速率和逆反应速率相等,这种状态称为化学平衡状态,简称化学平衡。
化学平衡状态的特征
等
v 正 = v 逆 ≠ 0
动
定
变
平衡时反应仍在不断进行,是一种动态平衡
在一定条件下的平衡体系中,各组分含量保持一定。
任一化学平衡状态均是相对的、有条件的(与浓度、压强、温度等有关)。条件改变,化学平衡可能发生改变
逆
研究对象为可逆反应
化学平衡状态的改变
将封装有二氧化氮(NO2)和四氧化二氮(N2O4)混合气体的装置两端的球形容器分别浸入热水和冷水中,观察实验现象。
二氧化氮转化为四氧化二氮的反应是放热反应,且是可逆反应。
实验分析及结论
◆实验分析:
其他条件一定,降低温度后原平衡状态被破坏,在新的条件下达到新的平衡状态,导致二氧化氮的浓度减小,四氧化二氮的浓度增大;升高温度后原平衡状态被破坏,在新的条件下达到新的平衡状态,导致二氧化氮的浓度增大,四氧化二氮的浓度减小。
◆实验结论:
温度改变,会使可逆反应2NO2(g)N2O4(g)的化学平衡被破坏,且被破坏后的可逆反应在新的条件下建立起新的化学平衡。
化学平衡移动
◆概念:
已达化学平衡的可逆反应中,当条件改变时,原来的化学平衡被破坏,并在新的条件下建立起新的化学平衡的过程。
◆影响因素:温度、浓度、压强等。
◆研究化学反应的限度在实际生产中的意义:
在生产过程中,化学反应的限度是决定原料利用率和产品产率的重要因素之一,如果能涉法提供总化学反应的限度,就能节约能源,增加产量,从而提高经济效益。因此,提高化学反应的限度具有十分重要的意义
03
课堂小结
04
课堂练习
C
1.下列有关化学反应限度的说法不正确的是( )。
A.任何可逆反应都有一定的限度
B.化学反应的限度是可以改变的
C.化学反应的限度与反应进行时间的长短有关
D.化学反应达到限度时,正、逆反应速率相等
D
2.下列反应不属于可逆反应的是( )
A.二氧化硫的催化氧化
B.氯气溶于水
C.工业合成氨
D.水电解生成H2和O2与H2在O2中的燃烧反应
C
3.一定温度下,在体积不变的密闭容器中,可逆反应X(g)+3Y(g)2Z(g)达到平衡的标志是( )。
A.气体的总质量保持不变
B.X、Y、Z的浓度都相等
C.X、Y、Z的浓度均不再发生变化
D.X、Y、Z的分子数之比为1∶3∶2
D
4.500 ℃时,将2 mol N2和2.25 mol H2充入体积为10 L的恒容密闭容器中,反应达到平衡时,NH3的浓度不可能是( )。
A.0.1 mol·L-1 B.0.12 mol·L-1
C.0.05 mol·L-1 D.0.16 mol·L-1
Thanks
好好学习天天向上
第二章 化学键 化学反应规律
第三节 化学反应的快慢和限度
2.3.2 化学反应的限度
核心素养目标
宏观辨识与微观探析:
能从宏观现象(如浓度变化、颜色改变)和微观本质(分子碰撞、反应速率)两个角度理解可逆反应的动态平衡特征。
变化观念与平衡思想:
认识到化学反应存在限度,理解化学平衡是相对的、动态的,外界条件改变会导致平衡移动。
科学探究与创新意识:
通过控制变量法探究温度、浓度等因素对化学平衡的影响,培养实验设计与分析能力
重点
理解可逆反应 “同时、同条件、不完全转化” 的特点
掌握平衡状态的 “逆、等、动、定、变” 五大特征,能通过速率关系和浓度变化判断平衡状态。
难点
从微观角度解释 “v (正)=v (逆)≠0” 的动态平衡本质
区分浓度、压强、平均相对分子质量等物理量是否为平衡标志的条件(如气体分子数变化的反应)
课前导入
课前导入
德国化学家哈伯对合成氨进行了全面系统的研究,两年间进行了6500多次的实验,终于在1909年取得了鼓舞人心的成果,但在600 ℃的高温、200个大气压和以锇为催化剂的条件下,产率仅为6%。这说明了什么 产率为什么会如此之低,你有什么猜测
01
可逆反应
观察·思考
向 2 mL 0.01 mol·L-1KI 溶液中加入 1 mL 0.01 mol·L-1FeCl3 溶液,再加入几滴0.1 mol·L-1 KSCN 溶液,你认为能观察到什么现象?为什么?
◆预测实验现象:
向KI溶液中滴加少量FeCl3溶液,溶液呈棕黄色(生成了碘),在滴加KSCN溶液,溶液无明显变化
◆观察到的实验现象:
向KI溶液中滴加少量FeCl3溶液,溶液呈棕黄色(生成了碘),在滴加KSCN溶液,溶液呈红色
◆实验结论:
即使KI过量,FeCl3也不可能全部转化成FeCl2,即该反应存在限度
实验现象及结论
交流·研讨
某班同学以二氧化硫与氧气生成三氧化硫的反应为例,分析为什么即使氧气过量二氧化硫也不能全部转化成三氧化硫。
信息 1 :实验发现,一定条件下向一密闭容器中充入 SO2 与 18O2,反应一段时间后,核素 18O 存在于 SO2、O2、SO3 中。
信息 2 :密闭容器中 SO2 与 O2 在一定条件下发生反应,反应过程中 SO3 的物质的量的变化趋势如图所示。
★通过实验发现,在二氧化硫与氧气的反应中,无论怎样改变反应条件都不能使二氧化硫全部转化成三氧化硫。这是因为在二氧化硫与氧气发生化合反应生成三氧化硫的同时,三氧化硫也在发生分解反应生成二氧化硫和氧气。
SO2、O2
SO3
SO2、O2和SO3
可逆反应
像这种在相同条件下同时向正、逆两个方向进行的反应称为可逆反应。氨气与水的反应、氮气与氢气生成氨气的反应都属于可逆反应。
在可逆反应的化学方程式中,用“ ”代替“=”,例如
其中,氮气与氢气生成氨气的反应称为正反应,氨气分解为氮气和氢气的反应称为逆反应。
可逆反应的特征
★可逆反应概念中“同一条件”是前提,如葡萄糖在氧气中燃烧可以生成二氧化碳和水,光合作用可将二氧化碳和水变成葡萄糖和氧气,但是两者条件不同,不互为可逆反应。
★对于可逆反应来说,在一定条件下反应物不可能全部转化成产物,反应只能进行到一定的程度,这就是该化学反应在这个条件下所能达到的限度。
★绝大多数化学反应都有一定的可逆性,但有些反应的可逆性小,可视为“不可逆”。
化学反应的限度
◆化学反应限度的概念:
对于可逆反应来说,在一定条件下反应物不可能全部转化成产物,反应只能进行到一定的程度,这就是该化学反应在这个条件下所能达到的限度。
◆对化学反应限度的理解:
①化学反应的限度决定了反应物在一定条件下的最大转化率。
②人们利用这些化学反应进行化工生产时,要同时考虑反应所能达到的限度和化学反应速率这两个方面的问题。
02
化学平衡
化学平衡状态的建立
①反应开始时:v(正)最大,v(逆)为0,原因是反应物浓度最大,生成物浓度为0。
②反应过程中:v(正)逐渐减小,v(逆)逐渐 增大原因是反应物浓度逐渐减小,生成物浓度逐渐增大。
③反应达到平衡时(t1后):v(正)=v(逆),反应物和生成物的浓度不再改变。
化学平衡状态的概念
在二氧化硫与氧气发生的可逆反应中,当反应进行到一定程度时,反应物和生成物的浓度不再随时间的延续而发生变化,反应好像“停滞”了。实际上,这时正反应和逆反应都依然在进行,只是在同一瞬间正反应生成的三氧化硫的物质的量与逆反应消耗的三氧化硫的物质的量相等而已。
在一定条件下可逆反应进行到一定程度时,反应物和生成物的浓度不再随时间的延长而发生变化,正反应速率和逆反应速率相等,这种状态称为化学平衡状态,简称化学平衡。
化学平衡状态的特征
等
v 正 = v 逆 ≠ 0
动
定
变
平衡时反应仍在不断进行,是一种动态平衡
在一定条件下的平衡体系中,各组分含量保持一定。
任一化学平衡状态均是相对的、有条件的(与浓度、压强、温度等有关)。条件改变,化学平衡可能发生改变
逆
研究对象为可逆反应
化学平衡状态的改变
将封装有二氧化氮(NO2)和四氧化二氮(N2O4)混合气体的装置两端的球形容器分别浸入热水和冷水中,观察实验现象。
二氧化氮转化为四氧化二氮的反应是放热反应,且是可逆反应。
实验分析及结论
◆实验分析:
其他条件一定,降低温度后原平衡状态被破坏,在新的条件下达到新的平衡状态,导致二氧化氮的浓度减小,四氧化二氮的浓度增大;升高温度后原平衡状态被破坏,在新的条件下达到新的平衡状态,导致二氧化氮的浓度增大,四氧化二氮的浓度减小。
◆实验结论:
温度改变,会使可逆反应2NO2(g)N2O4(g)的化学平衡被破坏,且被破坏后的可逆反应在新的条件下建立起新的化学平衡。
化学平衡移动
◆概念:
已达化学平衡的可逆反应中,当条件改变时,原来的化学平衡被破坏,并在新的条件下建立起新的化学平衡的过程。
◆影响因素:温度、浓度、压强等。
◆研究化学反应的限度在实际生产中的意义:
在生产过程中,化学反应的限度是决定原料利用率和产品产率的重要因素之一,如果能涉法提供总化学反应的限度,就能节约能源,增加产量,从而提高经济效益。因此,提高化学反应的限度具有十分重要的意义
03
课堂小结
04
课堂练习
C
1.下列有关化学反应限度的说法不正确的是( )。
A.任何可逆反应都有一定的限度
B.化学反应的限度是可以改变的
C.化学反应的限度与反应进行时间的长短有关
D.化学反应达到限度时,正、逆反应速率相等
D
2.下列反应不属于可逆反应的是( )
A.二氧化硫的催化氧化
B.氯气溶于水
C.工业合成氨
D.水电解生成H2和O2与H2在O2中的燃烧反应
C
3.一定温度下,在体积不变的密闭容器中,可逆反应X(g)+3Y(g)2Z(g)达到平衡的标志是( )。
A.气体的总质量保持不变
B.X、Y、Z的浓度都相等
C.X、Y、Z的浓度均不再发生变化
D.X、Y、Z的分子数之比为1∶3∶2
D
4.500 ℃时,将2 mol N2和2.25 mol H2充入体积为10 L的恒容密闭容器中,反应达到平衡时,NH3的浓度不可能是( )。
A.0.1 mol·L-1 B.0.12 mol·L-1
C.0.05 mol·L-1 D.0.16 mol·L-1
Thanks
好好学习天天向上
