1.1.2原子结构与元素性质(教学课件)(共44张PPT)_高中化学鲁科版必修二(2019)
文档属性
| 名称 | 1.1.2原子结构与元素性质(教学课件)(共44张PPT)_高中化学鲁科版必修二(2019) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-07 22:42:21 | ||
图片预览










文档简介
(共44张PPT)
第一章 原子结构元素周期律
第一节 原子结构与元素性质
1.1.2 核外电子排布
原子结构与元素原子得失电子能力
核心素养目标
宏观辨识与微观探析:
能从原子微观结构角度理解元素原子得失电子能力的差异,以及这种差异如何在宏观上体现为元素化学性质的不同,建立微观结构与宏观性质之间的联系。
证据推理与模型认知:
通过钠、镁、钾等金属与水反应的实验现象作为证据,推理元素原子失电子能力的强弱;构建原子结构影响元素原子得失电子能力的思维模型,运用模型解释和预测相关化学现象和性质。
科学探究与创新意识:
历钠、镁、铝与水反应的实验探究过程,学习科学探究的基本方法;在实验探究中培养创新意识,如思考如何改进实验以更准确地比较元素原子得失电子能力。
重点
核外电子排布规律,包括电子层与电子能量的关系、各电子层容纳电子数的规律以及核外电子排布的表示方法;
通过实验探究比较钠、镁、钾等元素原子失电子能力的强弱,理解原子结构与元素原子得失电子能力之间的关系。
难点
核外电子排布规律的综合应用,如根据核外电子排布规律确定复杂原子或离子的结构示意图,以及解释某些特殊原子的核外电子排布现;
深入理解原子结构影响元素原子得失电子能力的本质原因,能从微观角度分析和解释元素化学性质的差异。
课前导入
课前导入
物质在化学反应中的表现与组成该物质的元素的原子结构有着密切的联系,其中核外电子扮演着非常重要的角色。电子在原子内有着“广阔”的运动空间。有人把核外电子排布形象地比喻成洋葱切面,表明核外电子根据能量高低是分层排布的。核外电子的运动有自己的特点,它不像行星绕太阳旋转有固定的轨道,但却有经常出现的区域
01
核外电子排布
电子层
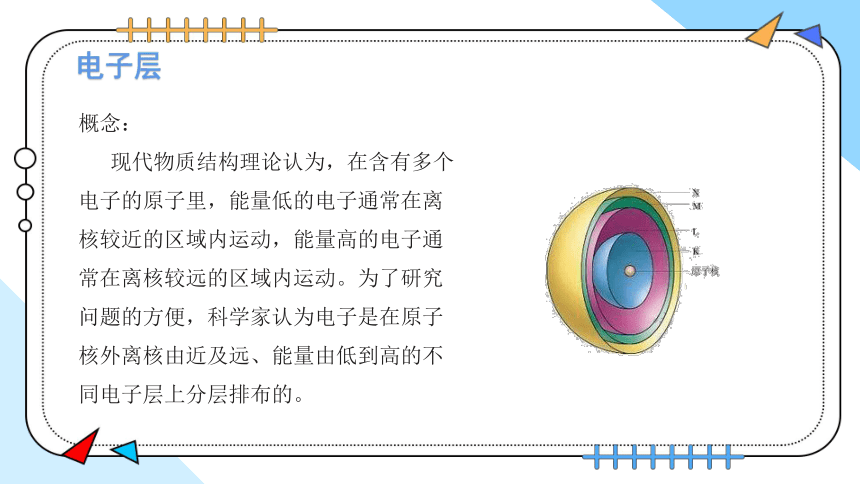
概念:
现代物质结构理论认为,在含有多个电子的原子里,能量低的电子通常在离核较近的区域内运动,能量高的电子通常在离核较远的区域内运动。为了研究问题的方便,科学家认为电子是在原子核外离核由近及远、能量由低到高的不同电子层上分层排布的。
电子层与电子能量的关系
电子层序数 一 二 三 四 五 六 七
电子层符号 K L M N O P Q
离核距离 电子能量 核外电子排布规律
★能量规律:
原子核外电子总是尽可能先排布在能量较低的电子层上,然后由内向外依次排布在能量逐渐升高的电子层上
★数量规律:
每个电子层最多能容纳 2n2(n 代表电子层数)个电子
最外层所能容纳的电子则不超过 8 个(第一层为最外层时不超过 2 个)
次外层电子不超过18个
倒数第三层电子不超过32个
核外电子排布规律
★电子层不是真实存在的,只是电子运动区域的形象化描述
★原子核外电子排布规律中的各项是相互联系、相互制约的,不能孤立的理解或应用其中的某一部分
如M层不是最外层时候,其最多容纳的电子数为18,当M层是最外层时候,其最多容纳的电子数为8
★电子不一定是排满M层才排N层,如K原子的M层排8个电子,N层排1个电子
典例解析
下列叙述中正确的是( )
A.在多电子原子中,能量高的电子通常在离核较近的区域内运动
B.核外电子总是先排在能量低的电子层上
C.两种微粒,若核外电子排布相同,则其化学性质一定相同
D.微粒的最外层只有达到8个电子才稳定
【解析】现代物质结构理论认为,在含有多个电子的原子中,能量低的电子通常在离核较近的区域内运动,电子是在原子核外离核由近及远、能量由低到高的不同电子层上分层排布的。通常把能量最低、离核最近的电子层叫作第一电子层,A项错误,B项正确。核外电子排布相同的微粒可以是阴离子、阳离子和原子,所以化学性质可能不同,C项错误。最外层有2个电子的微粒也可能是稳定结构,如He,D项错误。
B
原子结构示意图
微粒符号
原子核
核电荷数
电子层
该电子层上的电子数
原子核的电性
离子结构示意图
原子得失电子之后形成阴阳离子。原子形成离子时原子核不变,最外层电子数目发生了变化,因此原子结构示意图可以迁移应用于简单的离子结构示意图
一般情况下,非金属元素的简单阴离子与其原子的电子层数相同
一般情况下,金属元素的简单阳离子比其原子少一个电子层
原子结构与元素性质的关系
稀有气体元素
最外层电子数:8(He为2)
稳定性:稳定
原子得失电子能力:既不容易获得电子,也不容易失去电子
化合价:通常表现为0价
原子结构与元素性质的关系
金属元素
最外层电子数:一般小于4
稳定性:不稳定
原子得失电子能力:容易失去电子形成阳离子
化合价:在化合物中通常表现为正价
钠原子的最外层只有 1 个电子,原子容易失去 1 个电子形成 Na+ 而达到稳定结构,因此钠元素在化合物中呈 +1 价
原子结构与元素性质的关系
非金属元素
最外层电子数:一般大于或者等于4
稳定性:不稳定
原子得失电子能力:容易获得电子形成阴离子
化合价:在化合物中通常表现为负价
氯原子的最外层有 7 个电子,原子容易获得 1 个电子形成 Cl-而达到稳定结构,因此氯元素在氯化钠、氯化镁等氯化物中呈 -1 价。
核电荷数为1~20的原子或离子的结构特点
(1)没有中子的原子是1H
(2)最外层电子数为1的原子有H、Li、Na、K
(3)最外层电子数为2的原子有He、Be、Mg、Ca。
(4)原子最外层电子数与次外层电子数存在倍数关系:
①最外层电子数与次外层电子数相等的原子有Be、Ar
②最外层电子数是次外层电子数2倍的原子是C
③最外层电子数是次外层电子数3倍的原子是O
④最外层电子数是次外层电子数4倍的原子是Ne
⑤次外层电子数是最外层电子数2倍的原子有Li、Si
归纳总结
(5)原子最外层电子数与电子层数存在倍数关系:
①电子层数与最外层电子数相等的原子有H、Be、Al
②电子层数是最外层电子数2倍的原子有Li、Ca。
③电子层数是最外层电子数3倍的原子是Na。
④最外层电子数是电子层数2倍的原子有He、C、S
⑤最外层电子数是电子层数3倍的原子是O
(6)内层电子总数是最外层电子数2倍的原子有Li、P
(7)最外层电子数与最内层电子数相等的原子有Be、Mg、Ca。
典例解析
某元素原子的最外层电子数是次外层的a倍(a>1),则该原子的核内质子数是( )
A.2a+2 B.2a+10
C.a+2 D.2a
【解析】原子核外电子排布规律:最外层不超过8个电子,次外层不超过18个电子。某元素的最外层电子数是次外层的a倍(a>1),所以该元素的次外层只能是K层,为2个电子;最外层是L层,电子数是2a,所以该元素的核外电子数是2a+2;再根据原子核内质子数=核外电子数,所以核内质子数是2a+2。
B
常见的10电子微粒
Ne
(出发点)
Na+
Mg2+
Al3+
HF
H2O
NH3
CH4
NH4+
N3-
OH-
O2-
H3O+
F-
常见的18电子微粒
Ar
(出发点)
K+
Ca2+
F2、H2O2、N2H4、CH3OH、CH3F、NH2OH
HCl
H2S
PH3
SiH4
PH4+
N3-
HS-
S2-
Cl-
典例解析
A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是a-b,L层电子数是a+b,则A、B两元素形成化合物的化学式最可能表示为( )
A.B3A2 B.BA2 C.A3B2 D.AB2
【解析】因为B的L层电子数为a+b且有M层,所以a+b=8,又因A原子最外层电子数为a,次外层电子数为b,且满足a+b=8,所以A原子有两个电子层,且K层为2个电子,L层为6个电子,所以a=6,b=2。进而推知B的各电子层上的电子数分别为2、8、4。即A为O,B为Si。
B
易错警示
1.误认为最外层只有2个电子的元素一定是金属元素。其实不然,氦元素最外层也是2个电子。
2.误认为非金属元素只能形成阴离子。其实不然,也是非金属元素形成的。
3.误认为化合物中金属元素只显正价,非金属元素只显负价。其实不然,在金属氢化物中H显-1价,非金属元素R形成的含氧酸盐中非金属元素R显正价。
4.误认为镁失电子的数目多于钠,故镁的金属性更强。其实不然,因为钠与水反应更容易,钠的金属性要强于镁。
5.误认为不容易得电子的原子一定容易失电子。其实不然,稀有气体原子已达到稳定结构,既不容易失电子也不容易得电子。
认识核外电子的运动
电子极其微小 即使使用最先进的扫描隧道显微镜(STM),也只能观察到原子,而观察不到比原子小得多的电子。一个多世纪以来,科学家主要采用原子光谱和建立模型的方法对核外电子的运动进行研究。其中,玻尔原子模型和电子云模型对人们认识核外电子的运动起到了极大的促进作用。
玻尔原子模型 1913 年,玻尔在核式原子模型的基础上提出了新的原子模型:核外电子处在一定的轨道上绕核运行,在不同轨道上运动的电子具有不同的能量且能量是量子化的(即不是连续的);当电子从一个轨道跃迁到另一个轨道时,会辐射或吸收一定的能量;等等。现代物质结构理论保留了玻尔原子模型合理的部分,并在此基础上进一步发展。
电子云模型
宏观物体的运动都有一定的轨迹,如人造卫星按一定的轨道围绕地球运行,而在原子核外运动的电子并不遵循宏观物体的运动规律。人们不可能同时准确地测定电子在某一时刻所处的位置和运动速度,也不能描画出它们的运动轨迹,而只能描述电子在原子核外空间某处单位体积内出现的概率大小。为了形象地表示电子在原子核外空间运动的这一特征,人们常用单位体积内小点的疏密程度来表示电子在原子核外空间某处单位体积内出现概率的大小。这种形象地描述电子在原子核外空间某处单位体积内出现概率大小的模型称为“电子云模型”。
02
原子结构与元素原子得失电子的能力
比较钠、镁、钾元素原子的失电子能力
◆预测钠、镁两种元素原子失电子能力的强弱,并从原子结构的角度说明理由。
预测:Na比Mg的失电子能力强
预测的理由:
Mg与Na相比,Na、Mg的原子核外均有3个电子层,Mg的核电荷数较大,其外层电子离核较近,Mg较难失去电子
方法引导:
在多数情况下,可以通过比较元素的单质与水(或酸)反应置换出氢气的难易程度来判断元素原子失电子能力的强弱。
实验比较钠、镁元素原子的失电子能力
【实验 1】用小刀切下一小块金属钠,用滤纸吸干表面的煤油,放入盛有水并滴加有几滴酚酞溶液的烧杯中,立即盖上表面皿;
取一小段镁条,用砂纸除去表面的氧化膜,放入盛有等量水并滴加有几滴酚酞溶液的另一只烧杯中,立即盖上表面皿。分别观察现象。
实验现象及结论
实验现象:钠熔成小球,浮于水面,四处游动,有“咝咝”的响声,反应后溶液变红
实验结论:钠与冷水剧烈反应,化学方程式为2Na+2H2O2=NaOH+H2↑
实验现象:加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,溶液变为浅红色
实验结论:镁与冷水几乎不反应,能与沸水反应,化学方程式为Mg+2H2OMg(OH)2+H2↑
实验分析
元素失电子能力Na>Mg
由上述实验可知,元素原子的电子层数相同时,核电荷数越大,最外层电子离核越近,核对最外层电子的引力越大,原子越难失去电子(越容易得到电子)
比较钠、镁、钾元素原子的失电子能力
◆预测钠、钾两种元素原子失电子能力的强弱,并从原子结构的角度说明理由。
预测:
K比Na的失电子能力强
预测的理由:
Na与K相比,Na、Na的最外层电子数均为1,Na原子核外有三个电子层,K原子核外有四个电子层,K的最外层电子离核更远,K更容易失去电子
实验比较钠、钾元素原子的失电子能力
【实验 2】取两只烧杯,向其中加入等量的水并加入几滴酚酞溶液。用小刀分别切下大小相似的一小块金属钠和一小块金属钾,用滤纸吸干表面的煤油,同时将金属钠和金属钾分别放入上述两只烧杯中,立即盖上表面皿,观察现象。
实验现象及结论
实验现象:钠熔成小球,浮于水面,四处游动,有“咝咝”的响声,反应后溶液变红
实验结论:钠与冷水剧烈反应,化学方程式为2Na+2H2O2=NaOH+H2↑
实验现象:钾与水立即剧烈反应,小球浮在水面上,四周游动,有轻微爆炸声并着火燃烧,酚酞溶液变红色
实验结论:钾与水反应更剧烈,甚至可产生爆炸现象。反应的方程式:2K+2H2O=2KOH+H2↑
实验分析
元素失电子能力K>Na
由上述实验可知,元素原子的最外层电子数相同时,电子层数越多,最外层电子离核越远,核对最外层电子的引力越小,原子越容易失去电子(越难得到电子)
原子结构与元素原子得失电子能力
◆比较元素的单质与水(或酸)反应置换出氢气的难易程度。置换反应越容易发生,元素原子的失电子能力越强。
◆通常所说的元素的金属性、非金属性分别与元素原子的失电子能力和得电子能力相对应。
◆元素原子得失电子的能力与原子的最外层电子数、核电荷数和电子层数均有关系。核电荷数为1~20的元素(除He、Ne、Ar外),若原子的电子层数相同,则核电荷数越大,最外层电子离核越近,原子越难失电子、越容易得电子;若原子的最外层电子数相同,则电子层数越多,最外层电子离核越远,原子越容易失电子、越难得电子。
原子结构与元素性质和化合价的关系
原子类别 与元素性质的关系 与元素化合价的关系
稀有气体 元素原子 最外层电子数为8(He为2),结构稳定,性质不活泼 原子结构为稳定结构,常见化合价为0
金属元 素原子 最外层电子数一般小于4,较易失去电子 易失去最外层电子,达到稳定结构,其最高正价为+m(m为最外层电子数,下同)
非金属元 素原子 最外层电子数一般大于或等于4,较易获得电子,形成8电子稳定结构 得到一定数目的电子,达到稳定结构,其最低负价为m-8(H为m-2)
归纳总结——
原子结构推断与元素性质类题模型
原子结构特征
最外层电子数目与内层电子数的倍数关系
最外层电子数目与电子层数的倍数关系
最外层电子数相同或电子层数相同等关系
推断元素种类
分析元素或物质性质
03
课堂小结
04
课堂练习
1.下列是几种粒子的结构示意图,有关说法不正确的是( )。
A.①和②属于同种元素
B.②属于稀有气体元素
C.①和③的化学性质相似
D.④属于金属元素
B
2.核电荷数小于或等于18的元素中,原子的最外层电子数是其内层电子总数一半的元素种类有( )。
A.1种 B.2种
C.3种 D.4种
B
3.已知钡的金属活动性介于钾和钠之间,则下述说法中可能实现的是( )。
A.钡可从氯化钾溶液中置换出钾
B.钡可从冷水中置换出氢气
C.钡可从氯化钠溶液中置换出钠
D.在溶液中,钡离子可氧化金属锌,使之成为锌离子
B
4.根据下列叙述,写出元素名称并画出原子结构示意图。
信息 元素名称 原子结构示意图
A元素原子核外M层电子数是L层电子数的一半
B元素原子最外层电子数是次外层电子数的1.5倍
C元素呈+1价的离子的电子层排布与Ne相同
D元素原子次外层电子数是最外层电子数的1/3
硅
硼
钠
氧
Thanks
好好学习天天向上
第一章 原子结构元素周期律
第一节 原子结构与元素性质
1.1.2 核外电子排布
原子结构与元素原子得失电子能力
核心素养目标
宏观辨识与微观探析:
能从原子微观结构角度理解元素原子得失电子能力的差异,以及这种差异如何在宏观上体现为元素化学性质的不同,建立微观结构与宏观性质之间的联系。
证据推理与模型认知:
通过钠、镁、钾等金属与水反应的实验现象作为证据,推理元素原子失电子能力的强弱;构建原子结构影响元素原子得失电子能力的思维模型,运用模型解释和预测相关化学现象和性质。
科学探究与创新意识:
历钠、镁、铝与水反应的实验探究过程,学习科学探究的基本方法;在实验探究中培养创新意识,如思考如何改进实验以更准确地比较元素原子得失电子能力。
重点
核外电子排布规律,包括电子层与电子能量的关系、各电子层容纳电子数的规律以及核外电子排布的表示方法;
通过实验探究比较钠、镁、钾等元素原子失电子能力的强弱,理解原子结构与元素原子得失电子能力之间的关系。
难点
核外电子排布规律的综合应用,如根据核外电子排布规律确定复杂原子或离子的结构示意图,以及解释某些特殊原子的核外电子排布现;
深入理解原子结构影响元素原子得失电子能力的本质原因,能从微观角度分析和解释元素化学性质的差异。
课前导入
课前导入
物质在化学反应中的表现与组成该物质的元素的原子结构有着密切的联系,其中核外电子扮演着非常重要的角色。电子在原子内有着“广阔”的运动空间。有人把核外电子排布形象地比喻成洋葱切面,表明核外电子根据能量高低是分层排布的。核外电子的运动有自己的特点,它不像行星绕太阳旋转有固定的轨道,但却有经常出现的区域
01
核外电子排布
电子层
概念:
现代物质结构理论认为,在含有多个电子的原子里,能量低的电子通常在离核较近的区域内运动,能量高的电子通常在离核较远的区域内运动。为了研究问题的方便,科学家认为电子是在原子核外离核由近及远、能量由低到高的不同电子层上分层排布的。
电子层与电子能量的关系
电子层序数 一 二 三 四 五 六 七
电子层符号 K L M N O P Q
离核距离 电子能量 核外电子排布规律
★能量规律:
原子核外电子总是尽可能先排布在能量较低的电子层上,然后由内向外依次排布在能量逐渐升高的电子层上
★数量规律:
每个电子层最多能容纳 2n2(n 代表电子层数)个电子
最外层所能容纳的电子则不超过 8 个(第一层为最外层时不超过 2 个)
次外层电子不超过18个
倒数第三层电子不超过32个
核外电子排布规律
★电子层不是真实存在的,只是电子运动区域的形象化描述
★原子核外电子排布规律中的各项是相互联系、相互制约的,不能孤立的理解或应用其中的某一部分
如M层不是最外层时候,其最多容纳的电子数为18,当M层是最外层时候,其最多容纳的电子数为8
★电子不一定是排满M层才排N层,如K原子的M层排8个电子,N层排1个电子
典例解析
下列叙述中正确的是( )
A.在多电子原子中,能量高的电子通常在离核较近的区域内运动
B.核外电子总是先排在能量低的电子层上
C.两种微粒,若核外电子排布相同,则其化学性质一定相同
D.微粒的最外层只有达到8个电子才稳定
【解析】现代物质结构理论认为,在含有多个电子的原子中,能量低的电子通常在离核较近的区域内运动,电子是在原子核外离核由近及远、能量由低到高的不同电子层上分层排布的。通常把能量最低、离核最近的电子层叫作第一电子层,A项错误,B项正确。核外电子排布相同的微粒可以是阴离子、阳离子和原子,所以化学性质可能不同,C项错误。最外层有2个电子的微粒也可能是稳定结构,如He,D项错误。
B
原子结构示意图
微粒符号
原子核
核电荷数
电子层
该电子层上的电子数
原子核的电性
离子结构示意图
原子得失电子之后形成阴阳离子。原子形成离子时原子核不变,最外层电子数目发生了变化,因此原子结构示意图可以迁移应用于简单的离子结构示意图
一般情况下,非金属元素的简单阴离子与其原子的电子层数相同
一般情况下,金属元素的简单阳离子比其原子少一个电子层
原子结构与元素性质的关系
稀有气体元素
最外层电子数:8(He为2)
稳定性:稳定
原子得失电子能力:既不容易获得电子,也不容易失去电子
化合价:通常表现为0价
原子结构与元素性质的关系
金属元素
最外层电子数:一般小于4
稳定性:不稳定
原子得失电子能力:容易失去电子形成阳离子
化合价:在化合物中通常表现为正价
钠原子的最外层只有 1 个电子,原子容易失去 1 个电子形成 Na+ 而达到稳定结构,因此钠元素在化合物中呈 +1 价
原子结构与元素性质的关系
非金属元素
最外层电子数:一般大于或者等于4
稳定性:不稳定
原子得失电子能力:容易获得电子形成阴离子
化合价:在化合物中通常表现为负价
氯原子的最外层有 7 个电子,原子容易获得 1 个电子形成 Cl-而达到稳定结构,因此氯元素在氯化钠、氯化镁等氯化物中呈 -1 价。
核电荷数为1~20的原子或离子的结构特点
(1)没有中子的原子是1H
(2)最外层电子数为1的原子有H、Li、Na、K
(3)最外层电子数为2的原子有He、Be、Mg、Ca。
(4)原子最外层电子数与次外层电子数存在倍数关系:
①最外层电子数与次外层电子数相等的原子有Be、Ar
②最外层电子数是次外层电子数2倍的原子是C
③最外层电子数是次外层电子数3倍的原子是O
④最外层电子数是次外层电子数4倍的原子是Ne
⑤次外层电子数是最外层电子数2倍的原子有Li、Si
归纳总结
(5)原子最外层电子数与电子层数存在倍数关系:
①电子层数与最外层电子数相等的原子有H、Be、Al
②电子层数是最外层电子数2倍的原子有Li、Ca。
③电子层数是最外层电子数3倍的原子是Na。
④最外层电子数是电子层数2倍的原子有He、C、S
⑤最外层电子数是电子层数3倍的原子是O
(6)内层电子总数是最外层电子数2倍的原子有Li、P
(7)最外层电子数与最内层电子数相等的原子有Be、Mg、Ca。
典例解析
某元素原子的最外层电子数是次外层的a倍(a>1),则该原子的核内质子数是( )
A.2a+2 B.2a+10
C.a+2 D.2a
【解析】原子核外电子排布规律:最外层不超过8个电子,次外层不超过18个电子。某元素的最外层电子数是次外层的a倍(a>1),所以该元素的次外层只能是K层,为2个电子;最外层是L层,电子数是2a,所以该元素的核外电子数是2a+2;再根据原子核内质子数=核外电子数,所以核内质子数是2a+2。
B
常见的10电子微粒
Ne
(出发点)
Na+
Mg2+
Al3+
HF
H2O
NH3
CH4
NH4+
N3-
OH-
O2-
H3O+
F-
常见的18电子微粒
Ar
(出发点)
K+
Ca2+
F2、H2O2、N2H4、CH3OH、CH3F、NH2OH
HCl
H2S
PH3
SiH4
PH4+
N3-
HS-
S2-
Cl-
典例解析
A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是a-b,L层电子数是a+b,则A、B两元素形成化合物的化学式最可能表示为( )
A.B3A2 B.BA2 C.A3B2 D.AB2
【解析】因为B的L层电子数为a+b且有M层,所以a+b=8,又因A原子最外层电子数为a,次外层电子数为b,且满足a+b=8,所以A原子有两个电子层,且K层为2个电子,L层为6个电子,所以a=6,b=2。进而推知B的各电子层上的电子数分别为2、8、4。即A为O,B为Si。
B
易错警示
1.误认为最外层只有2个电子的元素一定是金属元素。其实不然,氦元素最外层也是2个电子。
2.误认为非金属元素只能形成阴离子。其实不然,也是非金属元素形成的。
3.误认为化合物中金属元素只显正价,非金属元素只显负价。其实不然,在金属氢化物中H显-1价,非金属元素R形成的含氧酸盐中非金属元素R显正价。
4.误认为镁失电子的数目多于钠,故镁的金属性更强。其实不然,因为钠与水反应更容易,钠的金属性要强于镁。
5.误认为不容易得电子的原子一定容易失电子。其实不然,稀有气体原子已达到稳定结构,既不容易失电子也不容易得电子。
认识核外电子的运动
电子极其微小 即使使用最先进的扫描隧道显微镜(STM),也只能观察到原子,而观察不到比原子小得多的电子。一个多世纪以来,科学家主要采用原子光谱和建立模型的方法对核外电子的运动进行研究。其中,玻尔原子模型和电子云模型对人们认识核外电子的运动起到了极大的促进作用。
玻尔原子模型 1913 年,玻尔在核式原子模型的基础上提出了新的原子模型:核外电子处在一定的轨道上绕核运行,在不同轨道上运动的电子具有不同的能量且能量是量子化的(即不是连续的);当电子从一个轨道跃迁到另一个轨道时,会辐射或吸收一定的能量;等等。现代物质结构理论保留了玻尔原子模型合理的部分,并在此基础上进一步发展。
电子云模型
宏观物体的运动都有一定的轨迹,如人造卫星按一定的轨道围绕地球运行,而在原子核外运动的电子并不遵循宏观物体的运动规律。人们不可能同时准确地测定电子在某一时刻所处的位置和运动速度,也不能描画出它们的运动轨迹,而只能描述电子在原子核外空间某处单位体积内出现的概率大小。为了形象地表示电子在原子核外空间运动的这一特征,人们常用单位体积内小点的疏密程度来表示电子在原子核外空间某处单位体积内出现概率的大小。这种形象地描述电子在原子核外空间某处单位体积内出现概率大小的模型称为“电子云模型”。
02
原子结构与元素原子得失电子的能力
比较钠、镁、钾元素原子的失电子能力
◆预测钠、镁两种元素原子失电子能力的强弱,并从原子结构的角度说明理由。
预测:Na比Mg的失电子能力强
预测的理由:
Mg与Na相比,Na、Mg的原子核外均有3个电子层,Mg的核电荷数较大,其外层电子离核较近,Mg较难失去电子
方法引导:
在多数情况下,可以通过比较元素的单质与水(或酸)反应置换出氢气的难易程度来判断元素原子失电子能力的强弱。
实验比较钠、镁元素原子的失电子能力
【实验 1】用小刀切下一小块金属钠,用滤纸吸干表面的煤油,放入盛有水并滴加有几滴酚酞溶液的烧杯中,立即盖上表面皿;
取一小段镁条,用砂纸除去表面的氧化膜,放入盛有等量水并滴加有几滴酚酞溶液的另一只烧杯中,立即盖上表面皿。分别观察现象。
实验现象及结论
实验现象:钠熔成小球,浮于水面,四处游动,有“咝咝”的响声,反应后溶液变红
实验结论:钠与冷水剧烈反应,化学方程式为2Na+2H2O2=NaOH+H2↑
实验现象:加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,溶液变为浅红色
实验结论:镁与冷水几乎不反应,能与沸水反应,化学方程式为Mg+2H2OMg(OH)2+H2↑
实验分析
元素失电子能力Na>Mg
由上述实验可知,元素原子的电子层数相同时,核电荷数越大,最外层电子离核越近,核对最外层电子的引力越大,原子越难失去电子(越容易得到电子)
比较钠、镁、钾元素原子的失电子能力
◆预测钠、钾两种元素原子失电子能力的强弱,并从原子结构的角度说明理由。
预测:
K比Na的失电子能力强
预测的理由:
Na与K相比,Na、Na的最外层电子数均为1,Na原子核外有三个电子层,K原子核外有四个电子层,K的最外层电子离核更远,K更容易失去电子
实验比较钠、钾元素原子的失电子能力
【实验 2】取两只烧杯,向其中加入等量的水并加入几滴酚酞溶液。用小刀分别切下大小相似的一小块金属钠和一小块金属钾,用滤纸吸干表面的煤油,同时将金属钠和金属钾分别放入上述两只烧杯中,立即盖上表面皿,观察现象。
实验现象及结论
实验现象:钠熔成小球,浮于水面,四处游动,有“咝咝”的响声,反应后溶液变红
实验结论:钠与冷水剧烈反应,化学方程式为2Na+2H2O2=NaOH+H2↑
实验现象:钾与水立即剧烈反应,小球浮在水面上,四周游动,有轻微爆炸声并着火燃烧,酚酞溶液变红色
实验结论:钾与水反应更剧烈,甚至可产生爆炸现象。反应的方程式:2K+2H2O=2KOH+H2↑
实验分析
元素失电子能力K>Na
由上述实验可知,元素原子的最外层电子数相同时,电子层数越多,最外层电子离核越远,核对最外层电子的引力越小,原子越容易失去电子(越难得到电子)
原子结构与元素原子得失电子能力
◆比较元素的单质与水(或酸)反应置换出氢气的难易程度。置换反应越容易发生,元素原子的失电子能力越强。
◆通常所说的元素的金属性、非金属性分别与元素原子的失电子能力和得电子能力相对应。
◆元素原子得失电子的能力与原子的最外层电子数、核电荷数和电子层数均有关系。核电荷数为1~20的元素(除He、Ne、Ar外),若原子的电子层数相同,则核电荷数越大,最外层电子离核越近,原子越难失电子、越容易得电子;若原子的最外层电子数相同,则电子层数越多,最外层电子离核越远,原子越容易失电子、越难得电子。
原子结构与元素性质和化合价的关系
原子类别 与元素性质的关系 与元素化合价的关系
稀有气体 元素原子 最外层电子数为8(He为2),结构稳定,性质不活泼 原子结构为稳定结构,常见化合价为0
金属元 素原子 最外层电子数一般小于4,较易失去电子 易失去最外层电子,达到稳定结构,其最高正价为+m(m为最外层电子数,下同)
非金属元 素原子 最外层电子数一般大于或等于4,较易获得电子,形成8电子稳定结构 得到一定数目的电子,达到稳定结构,其最低负价为m-8(H为m-2)
归纳总结——
原子结构推断与元素性质类题模型
原子结构特征
最外层电子数目与内层电子数的倍数关系
最外层电子数目与电子层数的倍数关系
最外层电子数相同或电子层数相同等关系
推断元素种类
分析元素或物质性质
03
课堂小结
04
课堂练习
1.下列是几种粒子的结构示意图,有关说法不正确的是( )。
A.①和②属于同种元素
B.②属于稀有气体元素
C.①和③的化学性质相似
D.④属于金属元素
B
2.核电荷数小于或等于18的元素中,原子的最外层电子数是其内层电子总数一半的元素种类有( )。
A.1种 B.2种
C.3种 D.4种
B
3.已知钡的金属活动性介于钾和钠之间,则下述说法中可能实现的是( )。
A.钡可从氯化钾溶液中置换出钾
B.钡可从冷水中置换出氢气
C.钡可从氯化钠溶液中置换出钠
D.在溶液中,钡离子可氧化金属锌,使之成为锌离子
B
4.根据下列叙述,写出元素名称并画出原子结构示意图。
信息 元素名称 原子结构示意图
A元素原子核外M层电子数是L层电子数的一半
B元素原子最外层电子数是次外层电子数的1.5倍
C元素呈+1价的离子的电子层排布与Ne相同
D元素原子次外层电子数是最外层电子数的1/3
硅
硼
钠
氧
Thanks
好好学习天天向上
