1.2.2元素周期律与元素周期表(教学课件)(共27张PPT)_高中化学鲁科版必修二(2019)
文档属性
| 名称 | 1.2.2元素周期律与元素周期表(教学课件)(共27张PPT)_高中化学鲁科版必修二(2019) |  | |
| 格式 | pptx | ||
| 文件大小 | 33.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-07 22:49:31 | ||
图片预览




文档简介
(共27张PPT)
第一章 原子结构元素周期律
第二节 元素周期律和元素周期表
1.2.2 元素周期表
核心素养目标
宏观辨识与微观探析:
能从元素周期表的宏观结构出发,认识周期、族的排列规律;从微观角度理解原子结构(电子层数、最外层电子数等)与元素在周期表中位置的关系,建立起宏观元素性质与微观原子结构之间的联系,如通过原子结构推断元素在周期表中的位置,进而预测元素的性质。
证据推理与模型认知:
基于元素周期表中同周期、同主族元素原子序数的变化规律等证据,推理元素的位置、原子结构和性质之间的关系;构建 “位 - 构 - 性” 的思维模型,运用该模型解决元素推断、性质比较等问题,提升逻辑推理能力。
重点
掌握周期序数与电子层数、主族序数与最外层电子数的对应关系;学会运用 “0 族定位法” 等方法确定元素在周期表中的位置;能根据元素在周期表中的位置推断原子结构。理解同主族元素性质的相似性和递变性;能运用元素周期表和元素周期律预测元素的性质
难点
将元素在周期表中的位置、原子结构和元素性质三者紧密联系起来,形成完整的知识体系;运用 “位 - 构 - 性” 关系解决复杂的元素推断问题,如根据元素间的位置关系和性质关系推断未知元素的相关信息;在实际问题情境中,灵活运用元素周期表和周期律进行分析和推理。
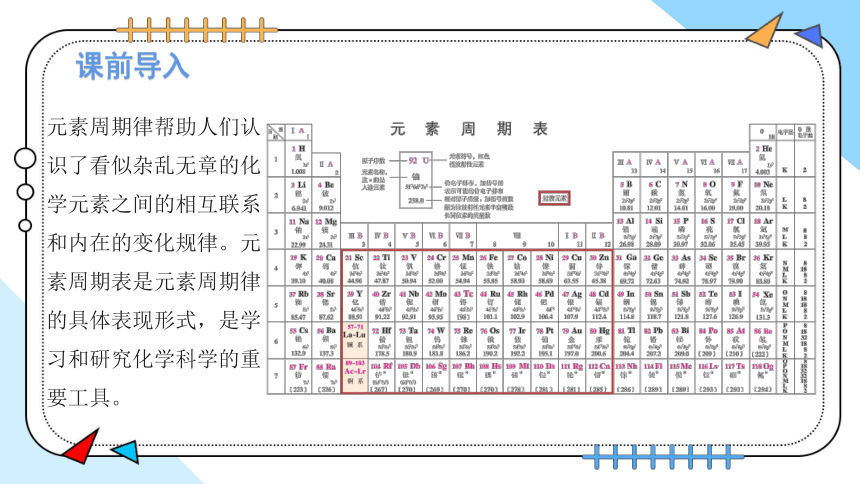
课前导入
课前导入
元素周期律帮助人们认识了看似杂乱无章的化学元素之间的相互联系和内在的变化规律。元素周期表是元素周期律的具体表现形式,是学习和研究化学科学的重要工具。
01
元素周期表的结构
元素周期表的意义
元素周期律帮助人们认识了看似杂乱无章的化学元素之间的相互联系和内在的变化规律。元素周期表是元素周期律的具体表现形式,是学习和研究化学科学的重要工具。通过元素周期表,我们可以了解某种元素的名称、元素符号、相对原子质量、原子序数等信息。
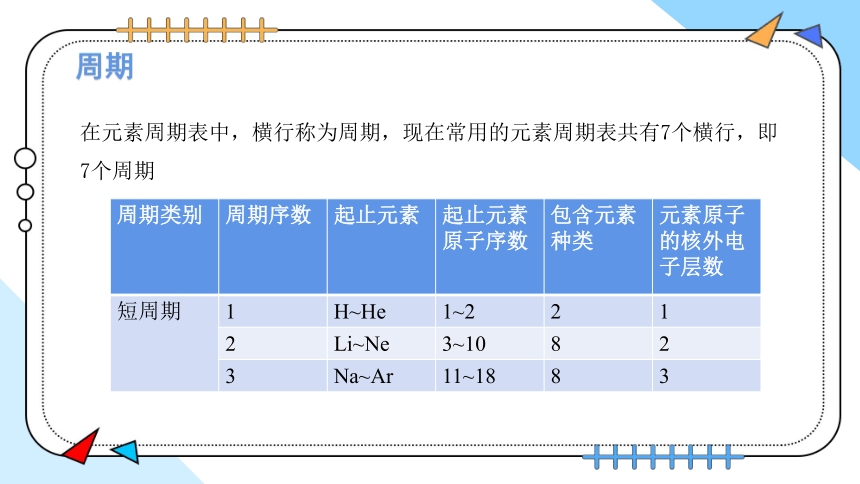
周期
在元素周期表中,横行称为周期,现在常用的元素周期表共有7个横行,即7个周期
周期类别 周期序数 起止元素 起止元素原子序数 包含元素种类 元素原子的核外电子层数
短周期 1 H~He 1~2 2 1
2 Li~Ne 3~10 8 2
3 Na~Ar 11~18 8 3
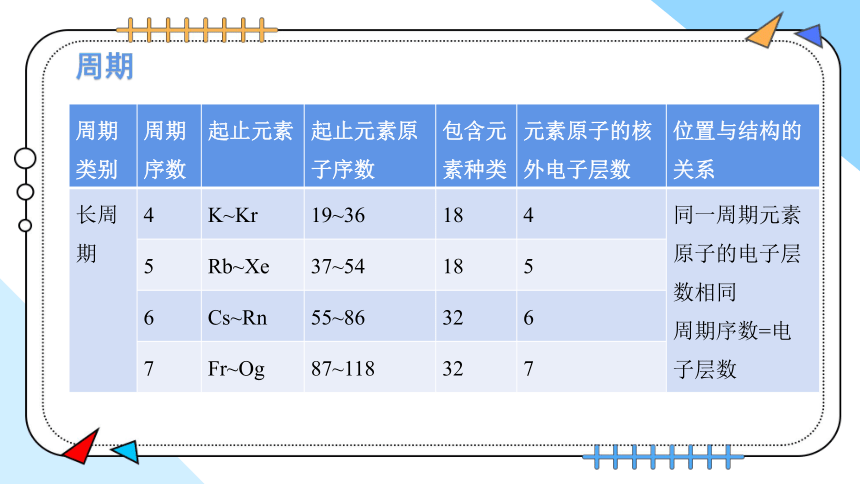
周期
周期类别 周期序数 起止元素 起止元素原子序数 包含元素种类 元素原子的核外电子层数 位置与结构的关系
长周期 4 K~Kr 19~36 18 4 同一周期元素原子的电子层数相同
周期序数=电子层数
5 Rb~Xe 37~54 18 5 6 Cs~Rn 55~86 32 6 7 Fr~Og 87~118 32 7 族
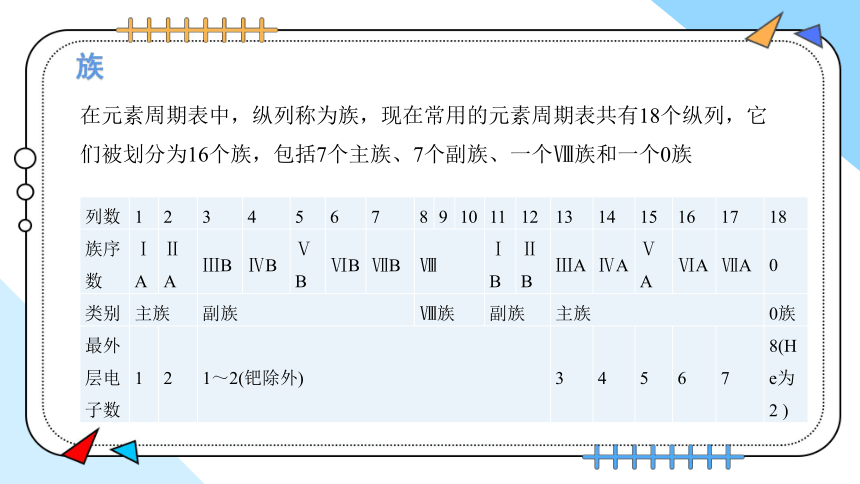
在元素周期表中,纵列称为族,现在常用的元素周期表共有18个纵列,它们被划分为16个族,包括7个主族、7个副族、一个Ⅷ族和一个0族
列数 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
族序数 ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0
类别 主族 副族 Ⅷ族 副族 主族 0族
最外层电子数 1 2 1~2(钯除外) 3 4 5 6 7 8(He为2 )
镧系元素和锕系元素
在元素周期表第 6 周期中,从 57 号元素镧(La)到 71 号元素镥(Lu),原子的最外层和次外层电子层结构以及元素的化学性质十分相似,这 15 种元素总称为镧系元素。类似地,第7 周期中的 89 号元素锕(Ac)到 103 号元素铹(Lr),这 15 种元素总称为锕系元素。为了使元素周期表的结构紧凑,科学家将镧系元素和锕系元素分别放在第 6 周期和第 7 周期的同一格内,并按原子序数递增的顺序,把它们分两行单独列在元素周期表的下方。
稀土元素
稀土元素是元素周期表中ⅢB 族钪、钇和镧系元素的统称。从 1794 年芬兰人加多林发现钇到 1947 年美国人马林斯基等制得钷,稀土元素陆续被发现,前后历时 150 多年。稀土元素的原子结构相似,离子半径相近,在自然界密切共生。稀土元素的单质都是很活泼的金属,性质极为相似。稀土元素的常见化合价为 +3 价,其水合离子大多有颜色,易形成稳定的配位化合物。稀土金属一般采用电解法制取。
稀土资源是不可再生的重要自然资源,因其独特的物理性质和化学性质,广泛应用于新能源、新材料、节能环保、航空航天、电子信息等领域。
我国是稀土资源较为丰富的国家之一,资源类型较多,探明的储量约占世界总储量的23%,这为我国稀土工业的发展提供了坚实的基础。
02
ⅡA族、ⅤA族与过渡元素的性质
ⅡA族、ⅤA族与过渡元素的性质
例如,ⅡA 族包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra)等元素,人们称它们为碱土金属元素。这些元素的原子,最外层都有 2 个电子,容易失去 2 个电子达到稳定结构,因此这些元素性质活泼,在自然界中都以化合态存在。该主族中的每一种金属元素的单质都呈亮白色,而且具有良好的导电性。含钙、锶、钡等元素的物质灼烧时会产生绚丽的颜色,因此含有这些元素的化合物可用于制造焰火。
焰色试验
多种金属或其化合物在灼烧时能使火焰呈现特殊的颜色,这在化学上叫作焰色试验,亦称焰色反应。
焰色试验操作步骤及应用
◆洗:将铂丝用稀盐酸冲洗
◆烧:将稀盐酸冲洗过的铂丝在无色火焰上灼烧至无色
◆蘸:用红色的铂丝蘸取试样
◆烧:将蘸取试样的铂丝在无色火焰上灼烧,观察焰色
◆洗:将铂丝用稀盐酸冲洗干净备用
节日烟花
检验金属元素的存在
ⅤA族元素(氮族元素)的性质
ⅤA 族包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)等元素,人们又称它们为氮族元素。这些元素原子的最外层都有 5 个电子,所以它们在最高价氧化物中的化合价为 +5 价。氮族元素中,氮和磷是典型的非金属元素;砷虽然是非金属元素,但已表现出一些金属元素的性质,如单质砷具有金属光泽;锑、铋则是金属元素;115 号元素镆是人工合成的放射性元素。
过渡元素的性质
副族也有类似的情况。元素周期表中第 3 ~ 12 列中的元素称为过渡元素。过渡元素包括了大部分金属元素,如铁、铜、镍、银和金等。大部分过渡元素的单质既坚硬又有光泽,金、铜等单质具有独特的色泽。所有过渡元素的单质都具有良好的导电性。多数过渡元素的单质比较稳定,与空气和水反应缓慢或根本不能反应。例如,古金币虽历经上千年的风雨侵蚀,仍保持着原有的光泽,上面的各种花纹也依然清晰可见。
形式不同的元素周期表
自 1869 年门捷列夫制作出第一张元素周期表以来,至少已经出现了几百种不同形式的元素周期表。人们根据研究的侧重点的不同,给出了不同形式的元素周期表,例如:短式元素周期表 元素周期表有短表和长表之分。门捷列夫起初制作的元素周期表是最原始的短式元素周期表。20 世纪前半叶广泛使用的是短表, 给出的就是一种短式元素周期表。
一种短式元素周期表
长式元素周期表 我们现在经常使用的就是一种长式元素周期表。1930 年以后广泛使用的长式元素周期表有很多种形式,图给出的三角形元素周期表也是一种长 式元素周期表,它能直观地展现出元素性质的周期性变化。
03
课堂小结
04
课堂练习
1.原子序数为x的元素位于元素周期表中的ⅡA族,则原子序数为(x+1)的元素不可能处在元素周期表的( )。
A.ⅢA族 B.ⅠA族 C.镧系 D.ⅢB族
2.坦桑石是一种被世界公认的新兴宝石,其组成为Ca2Al3(SiO4)3(OH),该成分中所含的元素不属于短周期元素的是( )。
A.Ca B.Al C.Si D.O
B
A
3.M2+有2个电子层,则M在元素周期表中的位置是( )。
A.第2周期0族
B.第2周期Ⅷ族
C.第2周期ⅡA族
D.第3周期ⅡA族
D
4.下列关于元素周期表的说法中正确的是( )。
A.元素周期表共有7个周期、18个族
B.非金属元素均位于元素周期表右侧
C.38号元素位于第5周期ⅡA族
D.第6周期共计有18种元素
C
5.焰色试验过程操作如图所示,下列说法正确的是( )。
A.铂丝一般用稀硫酸来清洗
B.某溶液进行焰色试验时火焰呈黄色,则表明待测液为钠盐溶液
C.Ba元素的焰色是黄绿色
D.蓝色钴玻璃的主要作用是滤去紫色
C
Thanks
好好学习天天向上
第一章 原子结构元素周期律
第二节 元素周期律和元素周期表
1.2.2 元素周期表
核心素养目标
宏观辨识与微观探析:
能从元素周期表的宏观结构出发,认识周期、族的排列规律;从微观角度理解原子结构(电子层数、最外层电子数等)与元素在周期表中位置的关系,建立起宏观元素性质与微观原子结构之间的联系,如通过原子结构推断元素在周期表中的位置,进而预测元素的性质。
证据推理与模型认知:
基于元素周期表中同周期、同主族元素原子序数的变化规律等证据,推理元素的位置、原子结构和性质之间的关系;构建 “位 - 构 - 性” 的思维模型,运用该模型解决元素推断、性质比较等问题,提升逻辑推理能力。
重点
掌握周期序数与电子层数、主族序数与最外层电子数的对应关系;学会运用 “0 族定位法” 等方法确定元素在周期表中的位置;能根据元素在周期表中的位置推断原子结构。理解同主族元素性质的相似性和递变性;能运用元素周期表和元素周期律预测元素的性质
难点
将元素在周期表中的位置、原子结构和元素性质三者紧密联系起来,形成完整的知识体系;运用 “位 - 构 - 性” 关系解决复杂的元素推断问题,如根据元素间的位置关系和性质关系推断未知元素的相关信息;在实际问题情境中,灵活运用元素周期表和周期律进行分析和推理。
课前导入
课前导入
元素周期律帮助人们认识了看似杂乱无章的化学元素之间的相互联系和内在的变化规律。元素周期表是元素周期律的具体表现形式,是学习和研究化学科学的重要工具。
01
元素周期表的结构
元素周期表的意义
元素周期律帮助人们认识了看似杂乱无章的化学元素之间的相互联系和内在的变化规律。元素周期表是元素周期律的具体表现形式,是学习和研究化学科学的重要工具。通过元素周期表,我们可以了解某种元素的名称、元素符号、相对原子质量、原子序数等信息。
周期
在元素周期表中,横行称为周期,现在常用的元素周期表共有7个横行,即7个周期
周期类别 周期序数 起止元素 起止元素原子序数 包含元素种类 元素原子的核外电子层数
短周期 1 H~He 1~2 2 1
2 Li~Ne 3~10 8 2
3 Na~Ar 11~18 8 3
周期
周期类别 周期序数 起止元素 起止元素原子序数 包含元素种类 元素原子的核外电子层数 位置与结构的关系
长周期 4 K~Kr 19~36 18 4 同一周期元素原子的电子层数相同
周期序数=电子层数
5 Rb~Xe 37~54 18 5 6 Cs~Rn 55~86 32 6 7 Fr~Og 87~118 32 7 族
在元素周期表中,纵列称为族,现在常用的元素周期表共有18个纵列,它们被划分为16个族,包括7个主族、7个副族、一个Ⅷ族和一个0族
列数 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
族序数 ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0
类别 主族 副族 Ⅷ族 副族 主族 0族
最外层电子数 1 2 1~2(钯除外) 3 4 5 6 7 8(He为2 )
镧系元素和锕系元素
在元素周期表第 6 周期中,从 57 号元素镧(La)到 71 号元素镥(Lu),原子的最外层和次外层电子层结构以及元素的化学性质十分相似,这 15 种元素总称为镧系元素。类似地,第7 周期中的 89 号元素锕(Ac)到 103 号元素铹(Lr),这 15 种元素总称为锕系元素。为了使元素周期表的结构紧凑,科学家将镧系元素和锕系元素分别放在第 6 周期和第 7 周期的同一格内,并按原子序数递增的顺序,把它们分两行单独列在元素周期表的下方。
稀土元素
稀土元素是元素周期表中ⅢB 族钪、钇和镧系元素的统称。从 1794 年芬兰人加多林发现钇到 1947 年美国人马林斯基等制得钷,稀土元素陆续被发现,前后历时 150 多年。稀土元素的原子结构相似,离子半径相近,在自然界密切共生。稀土元素的单质都是很活泼的金属,性质极为相似。稀土元素的常见化合价为 +3 价,其水合离子大多有颜色,易形成稳定的配位化合物。稀土金属一般采用电解法制取。
稀土资源是不可再生的重要自然资源,因其独特的物理性质和化学性质,广泛应用于新能源、新材料、节能环保、航空航天、电子信息等领域。
我国是稀土资源较为丰富的国家之一,资源类型较多,探明的储量约占世界总储量的23%,这为我国稀土工业的发展提供了坚实的基础。
02
ⅡA族、ⅤA族与过渡元素的性质
ⅡA族、ⅤA族与过渡元素的性质
例如,ⅡA 族包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra)等元素,人们称它们为碱土金属元素。这些元素的原子,最外层都有 2 个电子,容易失去 2 个电子达到稳定结构,因此这些元素性质活泼,在自然界中都以化合态存在。该主族中的每一种金属元素的单质都呈亮白色,而且具有良好的导电性。含钙、锶、钡等元素的物质灼烧时会产生绚丽的颜色,因此含有这些元素的化合物可用于制造焰火。
焰色试验
多种金属或其化合物在灼烧时能使火焰呈现特殊的颜色,这在化学上叫作焰色试验,亦称焰色反应。
焰色试验操作步骤及应用
◆洗:将铂丝用稀盐酸冲洗
◆烧:将稀盐酸冲洗过的铂丝在无色火焰上灼烧至无色
◆蘸:用红色的铂丝蘸取试样
◆烧:将蘸取试样的铂丝在无色火焰上灼烧,观察焰色
◆洗:将铂丝用稀盐酸冲洗干净备用
节日烟花
检验金属元素的存在
ⅤA族元素(氮族元素)的性质
ⅤA 族包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)等元素,人们又称它们为氮族元素。这些元素原子的最外层都有 5 个电子,所以它们在最高价氧化物中的化合价为 +5 价。氮族元素中,氮和磷是典型的非金属元素;砷虽然是非金属元素,但已表现出一些金属元素的性质,如单质砷具有金属光泽;锑、铋则是金属元素;115 号元素镆是人工合成的放射性元素。
过渡元素的性质
副族也有类似的情况。元素周期表中第 3 ~ 12 列中的元素称为过渡元素。过渡元素包括了大部分金属元素,如铁、铜、镍、银和金等。大部分过渡元素的单质既坚硬又有光泽,金、铜等单质具有独特的色泽。所有过渡元素的单质都具有良好的导电性。多数过渡元素的单质比较稳定,与空气和水反应缓慢或根本不能反应。例如,古金币虽历经上千年的风雨侵蚀,仍保持着原有的光泽,上面的各种花纹也依然清晰可见。
形式不同的元素周期表
自 1869 年门捷列夫制作出第一张元素周期表以来,至少已经出现了几百种不同形式的元素周期表。人们根据研究的侧重点的不同,给出了不同形式的元素周期表,例如:短式元素周期表 元素周期表有短表和长表之分。门捷列夫起初制作的元素周期表是最原始的短式元素周期表。20 世纪前半叶广泛使用的是短表, 给出的就是一种短式元素周期表。
一种短式元素周期表
长式元素周期表 我们现在经常使用的就是一种长式元素周期表。1930 年以后广泛使用的长式元素周期表有很多种形式,图给出的三角形元素周期表也是一种长 式元素周期表,它能直观地展现出元素性质的周期性变化。
03
课堂小结
04
课堂练习
1.原子序数为x的元素位于元素周期表中的ⅡA族,则原子序数为(x+1)的元素不可能处在元素周期表的( )。
A.ⅢA族 B.ⅠA族 C.镧系 D.ⅢB族
2.坦桑石是一种被世界公认的新兴宝石,其组成为Ca2Al3(SiO4)3(OH),该成分中所含的元素不属于短周期元素的是( )。
A.Ca B.Al C.Si D.O
B
A
3.M2+有2个电子层,则M在元素周期表中的位置是( )。
A.第2周期0族
B.第2周期Ⅷ族
C.第2周期ⅡA族
D.第3周期ⅡA族
D
4.下列关于元素周期表的说法中正确的是( )。
A.元素周期表共有7个周期、18个族
B.非金属元素均位于元素周期表右侧
C.38号元素位于第5周期ⅡA族
D.第6周期共计有18种元素
C
5.焰色试验过程操作如图所示,下列说法正确的是( )。
A.铂丝一般用稀硫酸来清洗
B.某溶液进行焰色试验时火焰呈黄色,则表明待测液为钠盐溶液
C.Ba元素的焰色是黄绿色
D.蓝色钴玻璃的主要作用是滤去紫色
C
Thanks
好好学习天天向上
