鲁科版高中化学必修二第二章第一节化学键与物质构成第一课时教学课件(共25张PPT)
文档属性
| 名称 | 鲁科版高中化学必修二第二章第一节化学键与物质构成第一课时教学课件(共25张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-09 19:04:38 | ||
图片预览







文档简介
(共25张PPT)
必修2第2章第1节
化学键与物质构成 化学键
第1课时
一、知识回顾
1.物质由元素组成。
2.物质由分子、原子、离子构成。
3.氧气、氢气、氯化氢、水等物质由分子构成;金刚石、石墨、铁、铜等物质由原子构成;氯化钠、氢氧化钠等物质由离子构成。
二、情景引入
到目前为止,已经发现的元素只有一百多种,而这些元素组成的物质却有数千万种,那么为数不多的元素的原子是通过什么作用形成种类繁多的物质的呢?物质中原子为什么总是按照一定数目相结合?人类对构成物质的微粒之间的结合方式也再不断的进行探索。
三、联想·质疑
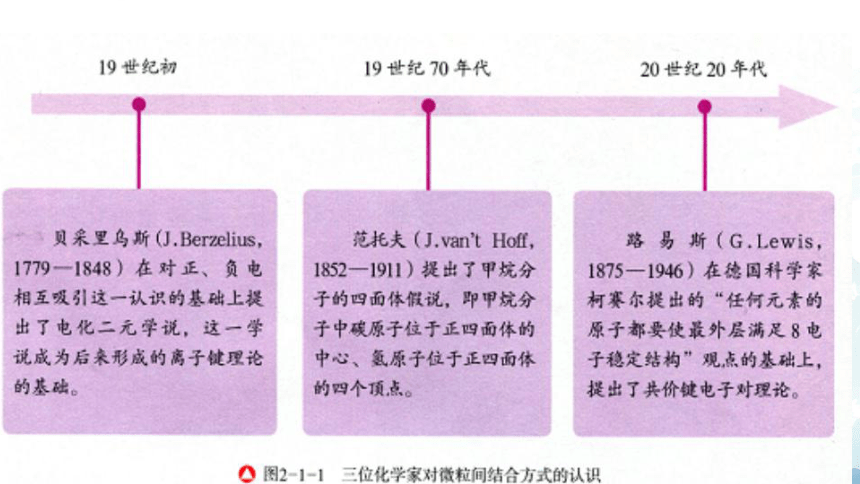
人类对构成物质的微粒之间的结合方式的认识源远流长。以下是历史上三位化学家对微粒间结合方式的认识。根据他们的观点,你认为氯原子是如何形成氯分子的?钠离子和氯离子是怎样形成的,又是如何结合成氯化钠的?
四、交流·研讨
1.加热至100℃时,水会沸腾变成水蒸气。这一变化过程中,外界提供的能量的作用是什么?
2.加热至2200℃以上时,水会分解。在这一过程中,外界提供的能量的作用是什么?
3.为什么使水分解需要加热到2200℃以上,而使水沸腾只需要加热到100℃?
小结:
1.水分子之间存在相互作用,加热提供能量用来破坏水分子之间的作用力。
2.水分子内H和O之间也存在相互作用,加热提供能量用来破坏这种作用力使水分解。
3.水分子内H和O之间的作用力,远远大于水分子之间的作用力。这种作用力称为化学键。
五、化学键
1.什么是化学键?
相邻原子之间的强相互作用称为化学键
2.注意
(1)首先必须相邻。不相邻一般就不强烈
(2)只相邻但不强烈,也不叫化学键
(3)水分子之间的作用力不是化学键,其作用力比化学键弱。
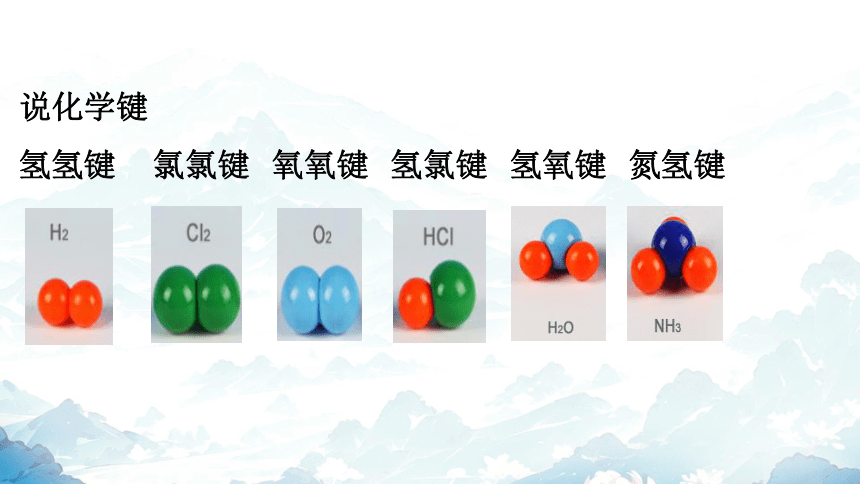
说化学键
氢氢键 氯氯键 氧氧键 氢氯键 氢氧键 氮氢键
思考:
分析下表列出的各反应中化学键变化的情况,写出各反应中断裂的化学键和形成的化学键。
化学反应 断裂的化学键 形成的化学键
2H2+02 == 2H2O
H2+Cl2 == 2H2O
N2+3H2 2NH3
点燃
点燃
高温,高压
催化剂
迁移
上述讨论对你认识化学反应的实质有哪些新的启示?
根据分析化学反应的实质是什么?
化学反应的实质是旧化学键断裂和新化学键形成。化学键断裂和形成伴随着能量的变化。旧化学键的断裂需要吸收能量 新化学键的形成会释放能量。
六、离子键、共价键
金属钠在氯气中燃烧能够生成氯化钠,氢气在氯气中燃烧能够生成氯化氢。那么,氯原子与钠原子是如何形成氯化钠的,氯原子与氢原子又是如何形成氯化氢的?二者的形成过程有什么不同,又为什么会有不同?
在氯化钠形成的过程中,钠原子最外层的1个电子转移到氯原子的最外层上,形成带正电荷的钠离子和带负电荷的氯离子,二者的最外层均达到稳定结构。带相反电荷的两种离子通过静电作用形成稳定的化合物----氯化钠。
思考:离子键的表示方法是什么?
1.离子键
①定义:阴阳离子之间通过静电作用形成的化学键
②形成条件:活泼金属元素原子与活泼非金属元素原子之间
③表示方法:电子式(一种由元素符号和用于表示该元素原子最外层电子的“·”或“×”组成的式子。)
NaCl离子键的形成过程
箭头含义:
箭头表示电子转移方向
氯化氢的形成过程
在氯化氢分子形成的过程中,氯原子和氢原子各提供一个电子组成一对共用电子,使二者的最外层都达到稳定结构,并使二者产生强烈的相互作用,从而形成氯化氢分子。
思考:共价键的表示方法是什么?
2.共价键
①定义:原子间通过共用电子形成的化学键
②形成条件:非金属元素原子之间
③表示:
HCl共价键的形成过程
④有共价键形成的分子具有一定的空间构型。
七、离子化合物、共价化合物
1.离子化合物:由阳离子和阴离子构成的化合物
2.共价化合物:由原子通过共价键构成的化合物
化合物 形成化学键的微粒 化学键类型 化合物类型
水
氨气
氢氧化钠
氯化钾
氯化钙
拓展
1.含有离子键的物质一定是离子化合物。
2.含有金属元素的化合物不一定是离子化合物,如氯化铝。
3.离子化合物中不一定含有金属元素,如氯化铵。
4.含有共价键的物质不一定是共价化合物,如氢气。
5.离子化合物中可能含有共价键,如氢氧化钠。
6.共价化合物中一定不含离子键。
7.共价键和离子键的实质相同,都属于电性作用。成键原因都是原子都有使自己的最外层达到稳定结构状态的趋势。(稀有气体原子的最外层都已达到稳定结构,因此稀有气体分子都是单原子分子,分子内不形成化学键)
八、极性键、非极性键
元素原子在形成形形色色的物质时,是通过化学键的作用结合到一起的,那么,化学键对物质的性质有什么影响呢 同种元素形成的共价键和不同种元素形成的共价键有什么区别呢?有兴趣的同学可以自学教材后的“拓展视野”栏目。
非极性键:同种原子形成的共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,因此成键原子不显电性
极性键:不同种原子形成的共价键,共用电子对偏向吸引电子能力较强的原子,因此吸引电子能力较强的一方显负电性,另一方显正电性
拓展:电子式书写
1.原子的电子式:写出元素符号,点出最外层电子
H × Na × ×Mg×
2. 离子的电子式:阴离子有[ ],标出所带电荷,点出该离子最外层电子;金属阳离子只需要写出离子符号
Mg2+
3.离子化合物的电子式 将阴阳离子的电子式写在一起,相同离子不合并,尽量对称
AB型
A2B型
AB2型
S
2-
Na
Na
常见分子的电子式:
H2 H2O CH4 CO2
必修2第2章第1节
化学键与物质构成 化学键
第1课时
一、知识回顾
1.物质由元素组成。
2.物质由分子、原子、离子构成。
3.氧气、氢气、氯化氢、水等物质由分子构成;金刚石、石墨、铁、铜等物质由原子构成;氯化钠、氢氧化钠等物质由离子构成。
二、情景引入
到目前为止,已经发现的元素只有一百多种,而这些元素组成的物质却有数千万种,那么为数不多的元素的原子是通过什么作用形成种类繁多的物质的呢?物质中原子为什么总是按照一定数目相结合?人类对构成物质的微粒之间的结合方式也再不断的进行探索。
三、联想·质疑
人类对构成物质的微粒之间的结合方式的认识源远流长。以下是历史上三位化学家对微粒间结合方式的认识。根据他们的观点,你认为氯原子是如何形成氯分子的?钠离子和氯离子是怎样形成的,又是如何结合成氯化钠的?
四、交流·研讨
1.加热至100℃时,水会沸腾变成水蒸气。这一变化过程中,外界提供的能量的作用是什么?
2.加热至2200℃以上时,水会分解。在这一过程中,外界提供的能量的作用是什么?
3.为什么使水分解需要加热到2200℃以上,而使水沸腾只需要加热到100℃?
小结:
1.水分子之间存在相互作用,加热提供能量用来破坏水分子之间的作用力。
2.水分子内H和O之间也存在相互作用,加热提供能量用来破坏这种作用力使水分解。
3.水分子内H和O之间的作用力,远远大于水分子之间的作用力。这种作用力称为化学键。
五、化学键
1.什么是化学键?
相邻原子之间的强相互作用称为化学键
2.注意
(1)首先必须相邻。不相邻一般就不强烈
(2)只相邻但不强烈,也不叫化学键
(3)水分子之间的作用力不是化学键,其作用力比化学键弱。
说化学键
氢氢键 氯氯键 氧氧键 氢氯键 氢氧键 氮氢键
思考:
分析下表列出的各反应中化学键变化的情况,写出各反应中断裂的化学键和形成的化学键。
化学反应 断裂的化学键 形成的化学键
2H2+02 == 2H2O
H2+Cl2 == 2H2O
N2+3H2 2NH3
点燃
点燃
高温,高压
催化剂
迁移
上述讨论对你认识化学反应的实质有哪些新的启示?
根据分析化学反应的实质是什么?
化学反应的实质是旧化学键断裂和新化学键形成。化学键断裂和形成伴随着能量的变化。旧化学键的断裂需要吸收能量 新化学键的形成会释放能量。
六、离子键、共价键
金属钠在氯气中燃烧能够生成氯化钠,氢气在氯气中燃烧能够生成氯化氢。那么,氯原子与钠原子是如何形成氯化钠的,氯原子与氢原子又是如何形成氯化氢的?二者的形成过程有什么不同,又为什么会有不同?
在氯化钠形成的过程中,钠原子最外层的1个电子转移到氯原子的最外层上,形成带正电荷的钠离子和带负电荷的氯离子,二者的最外层均达到稳定结构。带相反电荷的两种离子通过静电作用形成稳定的化合物----氯化钠。
思考:离子键的表示方法是什么?
1.离子键
①定义:阴阳离子之间通过静电作用形成的化学键
②形成条件:活泼金属元素原子与活泼非金属元素原子之间
③表示方法:电子式(一种由元素符号和用于表示该元素原子最外层电子的“·”或“×”组成的式子。)
NaCl离子键的形成过程
箭头含义:
箭头表示电子转移方向
氯化氢的形成过程
在氯化氢分子形成的过程中,氯原子和氢原子各提供一个电子组成一对共用电子,使二者的最外层都达到稳定结构,并使二者产生强烈的相互作用,从而形成氯化氢分子。
思考:共价键的表示方法是什么?
2.共价键
①定义:原子间通过共用电子形成的化学键
②形成条件:非金属元素原子之间
③表示:
HCl共价键的形成过程
④有共价键形成的分子具有一定的空间构型。
七、离子化合物、共价化合物
1.离子化合物:由阳离子和阴离子构成的化合物
2.共价化合物:由原子通过共价键构成的化合物
化合物 形成化学键的微粒 化学键类型 化合物类型
水
氨气
氢氧化钠
氯化钾
氯化钙
拓展
1.含有离子键的物质一定是离子化合物。
2.含有金属元素的化合物不一定是离子化合物,如氯化铝。
3.离子化合物中不一定含有金属元素,如氯化铵。
4.含有共价键的物质不一定是共价化合物,如氢气。
5.离子化合物中可能含有共价键,如氢氧化钠。
6.共价化合物中一定不含离子键。
7.共价键和离子键的实质相同,都属于电性作用。成键原因都是原子都有使自己的最外层达到稳定结构状态的趋势。(稀有气体原子的最外层都已达到稳定结构,因此稀有气体分子都是单原子分子,分子内不形成化学键)
八、极性键、非极性键
元素原子在形成形形色色的物质时,是通过化学键的作用结合到一起的,那么,化学键对物质的性质有什么影响呢 同种元素形成的共价键和不同种元素形成的共价键有什么区别呢?有兴趣的同学可以自学教材后的“拓展视野”栏目。
非极性键:同种原子形成的共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,因此成键原子不显电性
极性键:不同种原子形成的共价键,共用电子对偏向吸引电子能力较强的原子,因此吸引电子能力较强的一方显负电性,另一方显正电性
拓展:电子式书写
1.原子的电子式:写出元素符号,点出最外层电子
H × Na × ×Mg×
2. 离子的电子式:阴离子有[ ],标出所带电荷,点出该离子最外层电子;金属阳离子只需要写出离子符号
Mg2+
3.离子化合物的电子式 将阴阳离子的电子式写在一起,相同离子不合并,尽量对称
AB型
A2B型
AB2型
S
2-
Na
Na
常见分子的电子式:
H2 H2O CH4 CO2
