苏教版高中化学选择性必修1化学反应原理专题1第二单元基础课时7电解原理的应用课件(共65张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1化学反应原理专题1第二单元基础课时7电解原理的应用课件(共65张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-09 19:16:23 | ||
图片预览










文档简介
(共65张PPT)
基础课时7 电解原理的应用
专题1 化学反应与能量变化
第二单元 化学能与电能的转化
学习任务 1.通过对氯碱工业、电镀、电解精炼铜等原理的分析,认识电能与化学能之间的能量转化,培养变化观念与平衡思想的化学核心素养。
2.通过建立电解应用问题的分析思维模型和电解相关计算的思维模型,加深对电解原理的理解和应用,培养证据推理与模型认知的化学核心素养。
必备知识 自主预习储备
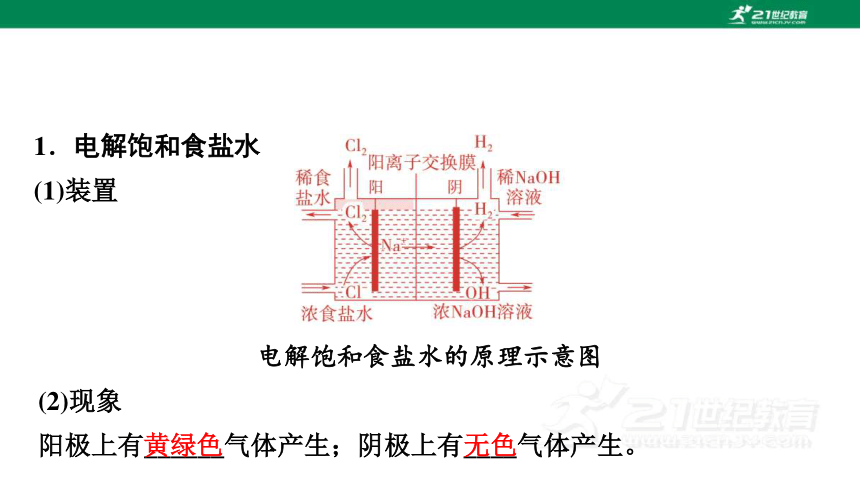
1.电解饱和食盐水
(1)装置
电解饱和食盐水的原理示意图
(2)现象
阳极上有______气体产生;阴极上有____气体产生。
黄绿色
无色
(3)原理分析及电极反应
电解时,__________移向阳极,_________移向阴极。
①阳极离子放电顺序:__________,电极反应式:_________________
(____反应)。
②阴极离子放电顺序:_________,电极反应式:__________________
_______(____反应)。
Cl-、OH-
H+、Na+
Cl->OH-
2Cl--2e-===Cl2↑
氧化
H+>Na+
2H2O+2e-===2OH-
+H2↑
还原
③电解反应
化学方程式:___________________________________________,
离子方程式:___________________________________________。
【特别提醒】 阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过。既能防止阴极产生的H2和阳极产生的Cl2混合而引起爆炸,又能避免Cl2和NaOH反应影响烧碱质量。
判一判 (正确的打“√”,错误的打“×”)
(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑。 ( )
(2)氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区。 ( )
(3)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)。 ( )
(4)利用电解饱和食盐水可制得“84消毒液”。 ( )
×
×
×
√
2.铜的电解精炼
(1)铜的电解精炼示意图
铜的电解精炼示意图
(2)粗铜中往往含有铁、锌、银、金等多种杂质,常用电解的方法进行精炼。电解池的构成是用_____作阳极,用_____作阴极,用___________作电解质溶液。
粗铜
纯铜
硫酸铜溶液
(3)阳极反应式为Cu-2e-===Cu2+、Zn-2e-===Zn2+、Fe-2e-===Fe2+等;阴极反应式为Cu2++2e-===Cu。
(4)电解精炼铜的原理:粗铜中比铜活泼的金属如_________等,失去电子形成阳离子而溶解(残留在溶液中);比铜不活泼的金属如________等,以金属单质的形式沉积在电解槽的底部(形成阳极泥);溶液中的铜离子在纯铜上得电子析出。
锌、铁
银、金
判一判 (正确的打“√”,错误的打“×”)
(1)电解精炼铜和电镀铜,电解质溶液中的c(Cu2+)均保持不变。 ( )
(2)电解精炼时,阳极泥可以作为提炼贵重金属的原料。 ( )
(3)电解精炼铜和电镀铜过程中,阳极质量的减少与阴极质量的增加都相等。 ( )
(4)电解精炼铜时,粗铜作阳极,活泼性比Cu弱的杂质金属成为阳极泥沉在阳极区。 ( )
×
√
×
√
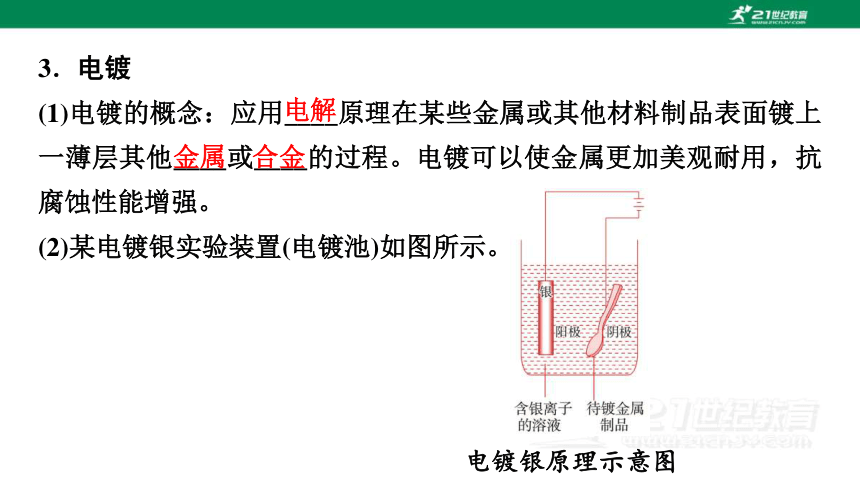
3.电镀
(1)电镀的概念:应用____原理在某些金属或其他材料制品表面镀上一薄层其他____或____的过程。电镀可以使金属更加美观耐用,抗腐蚀性能增强。
(2)某电镀银实验装置(电镀池)如图所示。
电镀银原理示意图
电解
金属
合金
请回答下列问题:
①银为____金属,与直流电源的____相连,作阳极;待镀金属与直流电源的____相连,作阴极;含银离子溶液为______,含有镀层金属离子。
②阳极反应式为Ag-e-===Ag+(氧化反应)
阴极反应式为Ag++e-===Ag(还原反应)
③可观察到的现象是待镀金属表面________________,银________。
④含银离子溶液浓度的变化是____。
(3)电镀的特点是阳极参与电极反应,电镀过程中相关离子的浓度、溶液pH等保持不变。
镀层
正极
负极
电镀液
镀上一层光亮的银
不断溶解
不变
判一判 (正确的打“√”,错误的打“×”)
(1)在Fe上镀Ag,应用Fe作阳极,Ag作阴极,用AgNO3溶液作电镀液。 ( )
(2)在镀件上电镀铜时,镀件应连接电源的正极。 ( )
(3)电镀过程中相关离子的浓度、溶液pH基本不变。 ( )
×
×
√
关键能力 情境探究达成
电镀及铜的电解精炼
[情境素材]
电镀就是利用电解原理在某些金属表面上镀上一薄层其他金属或合金的过程,是利用电解作用使金属或其他材料制品的表面附着一层金属膜的工艺,从而起到防止金属氧化(如锈蚀),提高耐磨性、导电性、反光性、抗腐蚀性(硫酸铜等)及增进美观等作用。不少硬币的外层亦为电镀。
[问题探究]
[问题1] 电镀池应该具备什么条件?电镀过程中电镀液的浓度如何变化?
提示:条件:镀层金属作阳极,镀件作阴极,含镀层金属离子的盐溶液作电解质溶液。电镀过程中电镀液的浓度不变。
[问题2] 在铁上镀锌时,溶液中的阳离子有两种,为什么在阴极是锌离子得电子而不是氢离子得电子被还原?
提示:因为锌离子浓度远大于氢离子浓度,所以是锌离子得电子。
[问题3] 粗铜中含有锌、铁、镍、银、金等金属杂质,在精炼铜的过程中,杂质金属为什么不在阴极析出?精炼铜的过程中溶液中Cu2+的浓度是否有变化?
提示:因氧化性Cu2+大于Fe2+、Zn2+、Ni2+,故在阴极上Cu2+得到电子析出单质铜,比铜活泼的金属锌、铁、镍被氧化,比铜活泼性弱的金属Ag、Au形成阳极泥。电解精炼铜时,阳极产生锌离子、亚铁离子、镍离子、铜离子,但阴极只消耗铜离子,所以电解质溶液中Cu2+浓度会减小。
[归纳总结]
电镀与铜的电解精炼的比较
电镀 铜的电解精炼
定义 应用电解原理在某些金属或其他材料制品表面镀上一薄层其他金属或合金的过程 利用电解原理提纯铜
装置
举例
电镀 铜的电解精炼
形成
条件 ①镀层金属作阳极接直流电源正极,镀件作阴极接直流电源负极
②电镀液必须是含有镀层金属离子的盐溶液
③形成闭合回路 ①粗铜作阳极,纯铜作阴极
②含Cu2+的盐溶液作电解质溶液
③直流电源
④形成闭合回路
电镀 铜的电解精炼
电极
反应 (以铁上镀锌为例) 阳极:Zn-2e-===Zn2+
阴极:Zn2++2e-===Zn 阳极:Cu(粗铜)-2e-===Cu2+
(主要)
阴极:Cu2++2e-===Cu(纯铜)
电解(镀)液浓度 不变 减小
联系 电镀池和电解精炼池是特定条件下的电解池
(1)离子的放电顺序不仅与离子本身的性质有关,还与离子浓度、装置特点等有关,铁上镀锌时,溶液中的H+不放电。
(2)在金属的电解精炼中,比被提炼的金属活泼的金属首先放电,比其不活泼的金属则最终成为阳极泥。
[能力达成]
1.在铁制品上镀上一定厚度的锌层,以下电镀方案中正确的是 ( )
A.锌作阳极,镀件作阴极,溶液中含Fe2+
B.锌作阴极,镀件作阳极,溶液中含Zn2+
C.锌作阴极,镀件作阳极,溶液中含Fe3+
D.锌作阳极,镀件作阴极,溶液中含Zn2+
D [在电镀池中,镀件作阴极,镀层金属作阳极,含镀层金属阳离子的溶液作电镀液。]
√
必备知识
关键能力
学习效果
基础课时固基练
基础课时7 电解原理的应用
2.关于电镀铜和电解精炼铜,下列说法中正确的是( )
A.都用粗铜作阳极、纯铜作阴极
B.电解(镀)液的成分都保持不变
C.阳极反应都只有Cu-2e-===Cu2+
D.阴极反应都只有Cu2++2e-===Cu
D [A项电镀时镀件作阴极;B项电解精炼铜时电解液成分改变;C项电解精炼铜时,若有比铜活泼的金属杂质如锌,则阳极还会发生Zn-2e-===Zn2+的反应等。]
√
电解的有关计算
[问题探究]
[问题1] 上述电解过程中共转移多少摩尔电子?电解得到Cu的质量为多少?
提示:两极都收集到22.4 L气体(标准状况),气体物质的量均为1 mol,阳极反应为4OH--4e-===2H2O+O2↑,可知电解过程中参加电极反应的OH-为4 mol,转移4 mol电子,两电极转移电子的物质的量相同;阴极反应为Cu2++2e-===Cu和2H++2e-===H2↑;其中生成
1 mol H2转移2 mol电子,则被还原的Cu2+也为1 mol,因此电解得到Cu的质量为64 g。
[问题2] 怎样使溶液恢复到原来的成分和浓度?
提示:根据原理知道电解得到的是Cu、氢气和氧气,电解质复原:出什么加什么,所以应该加入氢氧化铜,根据问题1的分析可知析出的Cu、氢气和氧气分别为1 mol、1 mol、1 mol,因此需要加入1 mol氢氧化铜,才能使溶液恢复到原来的成分和浓度。
[问题3] 电解后溶液中H+的物质的量浓度是多少?
[归纳总结]
电化学综合计算的三种常用方法
(1)根据总反应式计算。
先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
(2)根据得失电子守恒计算。
①用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
②用于混合溶液中电解的分阶段计算。
[能力达成]
1.有三个烧杯,分别盛有氯化铜、氯化钾和硝酸银三种溶液,均以Pt作电极,将它们串联在一起电解一定时间,测得电极增重总和2.8 g,这时产生的有色气体与无色气体的物质的量之比为( )
A.4∶1 B.1∶1
C.4∶3 D.3∶4
√
C [串联电路中,相同时间内各电极得电子或失电子的物质的量相同,各电极上放出气体的物质的量之比为定值。不必注意电极增重是多少,只要判断出生成何种气体及生成该气体一定物质的量所得失电子的物质的量,就可以通过得失电子守恒,判断气体物质的量之比,第一个烧杯中放出Cl2,第二个烧杯中放出Cl2和H2,第三个烧杯中放出O2。在有1 mol电子转移时,生成的气体的物质的量分别是0.5 mol、0.5 mol、0.5 mol和0.25 mol。所以共放出有色气体(Cl2)0.5 mol+0.5 mol=1 mol,无色气体(O2和H2)0.5 mol+0.25 mol=0.75 mol。]
(1)Ag是电解池的_________极,写出此电极的电极反应式:_______________。
(2)A中发生反应的化学方程式为_________________________。
阳
Ag-e-===Ag+
(3)B中观察到的现象是___________________________________。
(4)室温下,若电解一段时间后测得电路中通过的电子的物质的量为0.2 mol,电解过程中,B中析出物质是________g,A中阳极收集到的气体体积为________(标准状况)。
Ag棒变细,Fe棒上有银白色物质析出
21.6
1.12 L
学习效果 随堂评估自测
2
4
3
题号
1
√
2
4
3
题号
1
C [由图看出①处为电解池阳极产生氯气,②处为电解池阴极产生氢气,A对;该离子交换膜只能让阳离子通过,不能让阴离子和气体通过,能防止氯气与碱反应,且在阴极区得到浓度较高的烧碱溶液,B对;电解饱和食盐水有烧碱生成且H2O应写化学式,C错;电解装置是将电能转化为化学能的装置,D对。]
2
3
题号
1
4
√
2.金属镍有广泛的用途。粗镍中含有少量铁、锌、铜、铂等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性:Fe2+A.阳极发生还原反应,其电极反应式:Ni2++2e-===Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中有铜和铂,没有锌、铁、镍
2
3
题号
1
4
D [电解精炼镍时,粗镍作阳极,纯镍作阴极,电解质溶液中含有Ni2+,则阳极发生氧化反应,电极反应式为Zn-2e-===Zn2+,Fe-2e-===Fe2+,Ni-2e-===Ni2+,阴极电极反应式为Ni2++2e-===Ni,因此,电解过程中阳极减少的质量不一定等于阴极增加的质量,电解后,溶液中存在的金属阳离子有Fe2+、Ni2+、Zn2+,电解槽底部的阳极泥中只有铜和铂,没有锌、铁、镍。]
2
3
题号
4
1
√
2
3
题号
4
1
2
4
3
题号
1
4.如图所示,甲、乙为相互串联的两个电解池。
甲 乙
(1)甲池若为用电解原理精炼铜的装置,则A极为________极,电极材料是__________,电极反应式为________________,电解质溶液可以是______________________。
阴
纯铜
Cu2++2e-===Cu
CuSO4溶液(合理即可)
2
4
3
题号
1
(2)乙池中铁极的电极反应式为__________________。
(3)若将乙池中的石墨电极改为银电极,则乙池为______________装置,电解一段时间后,溶液的浓度________。
[解析] (1)由题图可知,甲池中A极为阴极,B极为阳极,在电解精炼铜时,粗铜作阳极,纯铜作阴极,故A为纯铜,电极反应式为Cu2++2e-===Cu。电解质溶液应为含有Cu2+的盐溶液,如CuSO4溶液等。(2)由题图可知,乙池中铁极作阴极,石墨作阳极,故铁极的电极反应式为Ag++e-===Ag。(3)若将乙池中的石墨电极改为银电极,则乙池为电镀池,电镀过程中电解质溶液的浓度不变。
Ag++e-===Ag
电镀
不变
题号
基础课时固基练(7) 电解原理的应用
1
3
5
2
4
6
8
7
9
10
11
12
√
1.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
13
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
A [电解池的阳极发生失电子的氧化反应、阴极发生得电子的还原反应。电解熔融的Al2O3制Al时,若用Fe作阳极,会发生反应Fe-2e-===Fe2+,Fe2+移动到阴极上发生反应Fe2++2e-===Fe,使得到的Al不纯。]
题号
2
1
3
4
5
6
8
7
9
10
11
12
2.关于电解NaCl溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.电解一段时间后,将全部电解质转移到烧杯中充分搅拌后溶液呈中性
√
13
题号
2
1
3
4
5
6
8
7
9
10
11
12
13
题号
3
2
4
5
6
8
7
9
10
11
12
1
√
3.中学阶段介绍的应用电解法制备物质主要有三种:一是铝的工业制备,二是氯碱工业,三是金属钠的制备。下列关于这三种工业生产的描述中正确的是( )
A.电解法制金属钠时,阳极反应式:Na++e-===Na
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是Cl-失电子
13
题号
3
2
4
5
6
8
7
9
10
11
12
1
13
题号
4
2
3
5
6
8
7
9
10
11
12
1
√
13
4.利用如图所示装置模拟电解原理在工业生产中
的应用。下列说法正确的是( )
A.氯碱工业中,X电极上的反应式是4OH--4e-===2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度不变
C.在铁片上镀铜时,Y是纯铜
D.制取金属镁时,Z是熔融的氯化镁
题号
4
2
3
5
6
8
7
9
10
11
12
1
13
D [X电极连接电源正极是阳极,Y电极连接电源负极是阴极。氯碱工业中阳极是Cl-放电生成Cl2,A错误;电解精炼铜时阳极粗铜溶解,阴极Cu2+放电析出Cu,但是粗铜中含有锌、铁、镍等杂质,使得溶液中Cu2+浓度变小,B项错误;铁片上镀铜时,阴极应该是铁片,阳极是纯铜,C项错误;镁是活泼金属,冶炼金属镁应该电解熔融氯化镁,D项正确。 ]
题号
2
4
5
3
6
8
7
9
10
11
12
1
√
13
5.如图甲为锌铜原电池装置,
乙为电解熔融氯化钠装置。则
下列说法正确的是( )
甲 乙
题号
2
4
5
3
6
8
7
9
10
11
12
1
13
B [甲装置为原电池,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,A错误;乙装置中铁为阴极,反应式为2Na++2e-===2Na,石墨为阳极,反应式为2Cl--2e-===Cl2↑,A是Cl2出口,B是Na出口,C、D错误。]
题号
2
4
5
3
6
8
7
9
10
11
12
1
√
13
6.用石墨作电极电解1 000 mL硝酸钾和硝酸铜的混合溶液,当通电一段时间后,两极都收集到112 mL气体(标准状况),假定电解后溶液体积仍为1 000 mL,则电解后溶液的pH为( )
A.4 B.3 C.2 D.1
题号
2
4
5
3
7
6
8
9
10
11
12
1
√
7.21世纪是钛的世纪,在800~1 000 ℃时电解TiO2可制得钛,装置如图所示,下列叙述正确的是( )
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为TiO2+4e-===Ti+2O2-
D.每生成0.1 mol Ti,转移0.2 mol电子
13
C [由O2-的移动方向可知,b为电源正极,A错误;石墨电极作阳极,发生氧化反应,B错误;每生成0.1 mol Ti,转移0.4 mol电子,D错误。]
题号
2
4
5
3
8
6
7
9
10
11
12
1
8.某同学设计了一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
13
甲 乙 丙
题号
2
4
5
3
8
6
7
9
10
11
12
1
根据要求回答相关问题:
(1)通入氢气的电极为________(填“正极”或“负极”),负极的电极反应式为__________________________。
(2)石墨电极为________(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液变红。
13
负极
H2-2e-+2OH-===2H2O
阳极
铁极
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为__________________。
减小
Cu2++2e-===Cu
题号
2
4
5
3
8
6
7
9
10
11
12
1
[解析] (1)通入氢气的电极为负极;由于电解质溶液是碱性的,所以该电极反应式为H2-2e-+2OH-===2H2O。
(2)由于铁电极与电源的负极连接,所以铁电极为阴极,石墨电极为阳极;反应一段时间后,在乙装置中滴入酚酞溶液,溶液中的H+在阴极(Fe电极)放电,破坏了附近的水的电离平衡,该区域的溶液显碱性,因此铁极区的溶液变红。
(3)因为粗铜中的锌等活动性比Cu强的杂质金属优先失去电子,而得到电子的只有Cu2+,所以丙装置中反应一段时间,硫酸铜溶液浓度会减小;精铜电极上的电极反应式为Cu2++2e-===Cu。
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
√
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
√
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
√
13
11.四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],其工作原理如图所示(a、b为石墨电极,c、d、e为离子交换膜),下列说法不正确的是( )
A.N为正极
B.标准状况下制备0.75NA (CH3)4NOH,
a、b两极共产生16.8 L气体
C.c、e均为阳离子交换膜
D.b极电极反应式:4OH--4e-===O2↑+2H2O
题号
9
2
4
5
3
8
6
7
10
11
12
1
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
√
13
12.下列有关2个电化
学装置的叙述不正确的
是( )
A.图Ⅰ,在不改变总反应的前提下,可用Na2SO4 替换 ZnSO4,用石墨替换Cu棒
B.图Ⅰ,电流形成的完整过程是:负极Zn-2e-===Zn2+,电子经导线流向正极,正极Cu2++2e-===Cu
C.图Ⅱ,通电后向两极滴加酚酞溶液,左侧变红
D.图Ⅰ,盐桥中Cl-向左侧移动,图Ⅱ,溶液中 Cl-向右侧移动
图Ⅰ
图Ⅱ
题号
9
2
4
5
3
8
6
7
10
11
12
1
B [A.将图Ⅰ中的ZnSO4替换为Na2SO4,对左侧区反应无影响,将Cu棒替换为石墨棒,仍然锌为负极,Cu为正极,故并不改变总反应,故A正确;B.图Ⅰ中电流形成的完整过程是:负极Zn-2e-===Zn2+,外电路中电子经导线流向正极,正极Cu2++2e-===Cu,内电路的盐桥中的阴离子移向负极,阳离子移向正极,故B错误;C.图Ⅱ中左侧区时阴极,电极反应为2H2O+2e-===H2↑+2OH- ,故阴极区显碱性,滴加酚酞溶液后溶液变红,故C正确;D.图Ⅰ中左侧为负极,故盐桥中Cl-向左侧移动,图Ⅱ中右侧时阳极,故溶液中Cl-向右侧移动,故D正确。]
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
13.常温下用惰性电极电解200 mL 氯化钠、硫酸铜的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
(1)曲线________(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。
(2)氯化钠的物质的量浓度为_______________,
硫酸铜的物质的量浓度为_____________。
(3)t2时所得溶液的pH为________。
13
Ⅱ
0.1 mol·L-1
0.1 mol·L-1
1
题号
9
2
4
5
3
8
6
7
10
11
12
1
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
13
基础课时7 电解原理的应用
专题1 化学反应与能量变化
第二单元 化学能与电能的转化
学习任务 1.通过对氯碱工业、电镀、电解精炼铜等原理的分析,认识电能与化学能之间的能量转化,培养变化观念与平衡思想的化学核心素养。
2.通过建立电解应用问题的分析思维模型和电解相关计算的思维模型,加深对电解原理的理解和应用,培养证据推理与模型认知的化学核心素养。
必备知识 自主预习储备
1.电解饱和食盐水
(1)装置
电解饱和食盐水的原理示意图
(2)现象
阳极上有______气体产生;阴极上有____气体产生。
黄绿色
无色
(3)原理分析及电极反应
电解时,__________移向阳极,_________移向阴极。
①阳极离子放电顺序:__________,电极反应式:_________________
(____反应)。
②阴极离子放电顺序:_________,电极反应式:__________________
_______(____反应)。
Cl-、OH-
H+、Na+
Cl->OH-
2Cl--2e-===Cl2↑
氧化
H+>Na+
2H2O+2e-===2OH-
+H2↑
还原
③电解反应
化学方程式:___________________________________________,
离子方程式:___________________________________________。
【特别提醒】 阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过。既能防止阴极产生的H2和阳极产生的Cl2混合而引起爆炸,又能避免Cl2和NaOH反应影响烧碱质量。
判一判 (正确的打“√”,错误的打“×”)
(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑。 ( )
(2)氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区。 ( )
(3)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)。 ( )
(4)利用电解饱和食盐水可制得“84消毒液”。 ( )
×
×
×
√
2.铜的电解精炼
(1)铜的电解精炼示意图
铜的电解精炼示意图
(2)粗铜中往往含有铁、锌、银、金等多种杂质,常用电解的方法进行精炼。电解池的构成是用_____作阳极,用_____作阴极,用___________作电解质溶液。
粗铜
纯铜
硫酸铜溶液
(3)阳极反应式为Cu-2e-===Cu2+、Zn-2e-===Zn2+、Fe-2e-===Fe2+等;阴极反应式为Cu2++2e-===Cu。
(4)电解精炼铜的原理:粗铜中比铜活泼的金属如_________等,失去电子形成阳离子而溶解(残留在溶液中);比铜不活泼的金属如________等,以金属单质的形式沉积在电解槽的底部(形成阳极泥);溶液中的铜离子在纯铜上得电子析出。
锌、铁
银、金
判一判 (正确的打“√”,错误的打“×”)
(1)电解精炼铜和电镀铜,电解质溶液中的c(Cu2+)均保持不变。 ( )
(2)电解精炼时,阳极泥可以作为提炼贵重金属的原料。 ( )
(3)电解精炼铜和电镀铜过程中,阳极质量的减少与阴极质量的增加都相等。 ( )
(4)电解精炼铜时,粗铜作阳极,活泼性比Cu弱的杂质金属成为阳极泥沉在阳极区。 ( )
×
√
×
√
3.电镀
(1)电镀的概念:应用____原理在某些金属或其他材料制品表面镀上一薄层其他____或____的过程。电镀可以使金属更加美观耐用,抗腐蚀性能增强。
(2)某电镀银实验装置(电镀池)如图所示。
电镀银原理示意图
电解
金属
合金
请回答下列问题:
①银为____金属,与直流电源的____相连,作阳极;待镀金属与直流电源的____相连,作阴极;含银离子溶液为______,含有镀层金属离子。
②阳极反应式为Ag-e-===Ag+(氧化反应)
阴极反应式为Ag++e-===Ag(还原反应)
③可观察到的现象是待镀金属表面________________,银________。
④含银离子溶液浓度的变化是____。
(3)电镀的特点是阳极参与电极反应,电镀过程中相关离子的浓度、溶液pH等保持不变。
镀层
正极
负极
电镀液
镀上一层光亮的银
不断溶解
不变
判一判 (正确的打“√”,错误的打“×”)
(1)在Fe上镀Ag,应用Fe作阳极,Ag作阴极,用AgNO3溶液作电镀液。 ( )
(2)在镀件上电镀铜时,镀件应连接电源的正极。 ( )
(3)电镀过程中相关离子的浓度、溶液pH基本不变。 ( )
×
×
√
关键能力 情境探究达成
电镀及铜的电解精炼
[情境素材]
电镀就是利用电解原理在某些金属表面上镀上一薄层其他金属或合金的过程,是利用电解作用使金属或其他材料制品的表面附着一层金属膜的工艺,从而起到防止金属氧化(如锈蚀),提高耐磨性、导电性、反光性、抗腐蚀性(硫酸铜等)及增进美观等作用。不少硬币的外层亦为电镀。
[问题探究]
[问题1] 电镀池应该具备什么条件?电镀过程中电镀液的浓度如何变化?
提示:条件:镀层金属作阳极,镀件作阴极,含镀层金属离子的盐溶液作电解质溶液。电镀过程中电镀液的浓度不变。
[问题2] 在铁上镀锌时,溶液中的阳离子有两种,为什么在阴极是锌离子得电子而不是氢离子得电子被还原?
提示:因为锌离子浓度远大于氢离子浓度,所以是锌离子得电子。
[问题3] 粗铜中含有锌、铁、镍、银、金等金属杂质,在精炼铜的过程中,杂质金属为什么不在阴极析出?精炼铜的过程中溶液中Cu2+的浓度是否有变化?
提示:因氧化性Cu2+大于Fe2+、Zn2+、Ni2+,故在阴极上Cu2+得到电子析出单质铜,比铜活泼的金属锌、铁、镍被氧化,比铜活泼性弱的金属Ag、Au形成阳极泥。电解精炼铜时,阳极产生锌离子、亚铁离子、镍离子、铜离子,但阴极只消耗铜离子,所以电解质溶液中Cu2+浓度会减小。
[归纳总结]
电镀与铜的电解精炼的比较
电镀 铜的电解精炼
定义 应用电解原理在某些金属或其他材料制品表面镀上一薄层其他金属或合金的过程 利用电解原理提纯铜
装置
举例
电镀 铜的电解精炼
形成
条件 ①镀层金属作阳极接直流电源正极,镀件作阴极接直流电源负极
②电镀液必须是含有镀层金属离子的盐溶液
③形成闭合回路 ①粗铜作阳极,纯铜作阴极
②含Cu2+的盐溶液作电解质溶液
③直流电源
④形成闭合回路
电镀 铜的电解精炼
电极
反应 (以铁上镀锌为例) 阳极:Zn-2e-===Zn2+
阴极:Zn2++2e-===Zn 阳极:Cu(粗铜)-2e-===Cu2+
(主要)
阴极:Cu2++2e-===Cu(纯铜)
电解(镀)液浓度 不变 减小
联系 电镀池和电解精炼池是特定条件下的电解池
(1)离子的放电顺序不仅与离子本身的性质有关,还与离子浓度、装置特点等有关,铁上镀锌时,溶液中的H+不放电。
(2)在金属的电解精炼中,比被提炼的金属活泼的金属首先放电,比其不活泼的金属则最终成为阳极泥。
[能力达成]
1.在铁制品上镀上一定厚度的锌层,以下电镀方案中正确的是 ( )
A.锌作阳极,镀件作阴极,溶液中含Fe2+
B.锌作阴极,镀件作阳极,溶液中含Zn2+
C.锌作阴极,镀件作阳极,溶液中含Fe3+
D.锌作阳极,镀件作阴极,溶液中含Zn2+
D [在电镀池中,镀件作阴极,镀层金属作阳极,含镀层金属阳离子的溶液作电镀液。]
√
必备知识
关键能力
学习效果
基础课时固基练
基础课时7 电解原理的应用
2.关于电镀铜和电解精炼铜,下列说法中正确的是( )
A.都用粗铜作阳极、纯铜作阴极
B.电解(镀)液的成分都保持不变
C.阳极反应都只有Cu-2e-===Cu2+
D.阴极反应都只有Cu2++2e-===Cu
D [A项电镀时镀件作阴极;B项电解精炼铜时电解液成分改变;C项电解精炼铜时,若有比铜活泼的金属杂质如锌,则阳极还会发生Zn-2e-===Zn2+的反应等。]
√
电解的有关计算
[问题探究]
[问题1] 上述电解过程中共转移多少摩尔电子?电解得到Cu的质量为多少?
提示:两极都收集到22.4 L气体(标准状况),气体物质的量均为1 mol,阳极反应为4OH--4e-===2H2O+O2↑,可知电解过程中参加电极反应的OH-为4 mol,转移4 mol电子,两电极转移电子的物质的量相同;阴极反应为Cu2++2e-===Cu和2H++2e-===H2↑;其中生成
1 mol H2转移2 mol电子,则被还原的Cu2+也为1 mol,因此电解得到Cu的质量为64 g。
[问题2] 怎样使溶液恢复到原来的成分和浓度?
提示:根据原理知道电解得到的是Cu、氢气和氧气,电解质复原:出什么加什么,所以应该加入氢氧化铜,根据问题1的分析可知析出的Cu、氢气和氧气分别为1 mol、1 mol、1 mol,因此需要加入1 mol氢氧化铜,才能使溶液恢复到原来的成分和浓度。
[问题3] 电解后溶液中H+的物质的量浓度是多少?
[归纳总结]
电化学综合计算的三种常用方法
(1)根据总反应式计算。
先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
(2)根据得失电子守恒计算。
①用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
②用于混合溶液中电解的分阶段计算。
[能力达成]
1.有三个烧杯,分别盛有氯化铜、氯化钾和硝酸银三种溶液,均以Pt作电极,将它们串联在一起电解一定时间,测得电极增重总和2.8 g,这时产生的有色气体与无色气体的物质的量之比为( )
A.4∶1 B.1∶1
C.4∶3 D.3∶4
√
C [串联电路中,相同时间内各电极得电子或失电子的物质的量相同,各电极上放出气体的物质的量之比为定值。不必注意电极增重是多少,只要判断出生成何种气体及生成该气体一定物质的量所得失电子的物质的量,就可以通过得失电子守恒,判断气体物质的量之比,第一个烧杯中放出Cl2,第二个烧杯中放出Cl2和H2,第三个烧杯中放出O2。在有1 mol电子转移时,生成的气体的物质的量分别是0.5 mol、0.5 mol、0.5 mol和0.25 mol。所以共放出有色气体(Cl2)0.5 mol+0.5 mol=1 mol,无色气体(O2和H2)0.5 mol+0.25 mol=0.75 mol。]
(1)Ag是电解池的_________极,写出此电极的电极反应式:_______________。
(2)A中发生反应的化学方程式为_________________________。
阳
Ag-e-===Ag+
(3)B中观察到的现象是___________________________________。
(4)室温下,若电解一段时间后测得电路中通过的电子的物质的量为0.2 mol,电解过程中,B中析出物质是________g,A中阳极收集到的气体体积为________(标准状况)。
Ag棒变细,Fe棒上有银白色物质析出
21.6
1.12 L
学习效果 随堂评估自测
2
4
3
题号
1
√
2
4
3
题号
1
C [由图看出①处为电解池阳极产生氯气,②处为电解池阴极产生氢气,A对;该离子交换膜只能让阳离子通过,不能让阴离子和气体通过,能防止氯气与碱反应,且在阴极区得到浓度较高的烧碱溶液,B对;电解饱和食盐水有烧碱生成且H2O应写化学式,C错;电解装置是将电能转化为化学能的装置,D对。]
2
3
题号
1
4
√
2.金属镍有广泛的用途。粗镍中含有少量铁、锌、铜、铂等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性:Fe2+
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中有铜和铂,没有锌、铁、镍
2
3
题号
1
4
D [电解精炼镍时,粗镍作阳极,纯镍作阴极,电解质溶液中含有Ni2+,则阳极发生氧化反应,电极反应式为Zn-2e-===Zn2+,Fe-2e-===Fe2+,Ni-2e-===Ni2+,阴极电极反应式为Ni2++2e-===Ni,因此,电解过程中阳极减少的质量不一定等于阴极增加的质量,电解后,溶液中存在的金属阳离子有Fe2+、Ni2+、Zn2+,电解槽底部的阳极泥中只有铜和铂,没有锌、铁、镍。]
2
3
题号
4
1
√
2
3
题号
4
1
2
4
3
题号
1
4.如图所示,甲、乙为相互串联的两个电解池。
甲 乙
(1)甲池若为用电解原理精炼铜的装置,则A极为________极,电极材料是__________,电极反应式为________________,电解质溶液可以是______________________。
阴
纯铜
Cu2++2e-===Cu
CuSO4溶液(合理即可)
2
4
3
题号
1
(2)乙池中铁极的电极反应式为__________________。
(3)若将乙池中的石墨电极改为银电极,则乙池为______________装置,电解一段时间后,溶液的浓度________。
[解析] (1)由题图可知,甲池中A极为阴极,B极为阳极,在电解精炼铜时,粗铜作阳极,纯铜作阴极,故A为纯铜,电极反应式为Cu2++2e-===Cu。电解质溶液应为含有Cu2+的盐溶液,如CuSO4溶液等。(2)由题图可知,乙池中铁极作阴极,石墨作阳极,故铁极的电极反应式为Ag++e-===Ag。(3)若将乙池中的石墨电极改为银电极,则乙池为电镀池,电镀过程中电解质溶液的浓度不变。
Ag++e-===Ag
电镀
不变
题号
基础课时固基练(7) 电解原理的应用
1
3
5
2
4
6
8
7
9
10
11
12
√
1.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
13
题号
1
3
5
2
4
6
8
7
9
10
11
12
13
A [电解池的阳极发生失电子的氧化反应、阴极发生得电子的还原反应。电解熔融的Al2O3制Al时,若用Fe作阳极,会发生反应Fe-2e-===Fe2+,Fe2+移动到阴极上发生反应Fe2++2e-===Fe,使得到的Al不纯。]
题号
2
1
3
4
5
6
8
7
9
10
11
12
2.关于电解NaCl溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.电解一段时间后,将全部电解质转移到烧杯中充分搅拌后溶液呈中性
√
13
题号
2
1
3
4
5
6
8
7
9
10
11
12
13
题号
3
2
4
5
6
8
7
9
10
11
12
1
√
3.中学阶段介绍的应用电解法制备物质主要有三种:一是铝的工业制备,二是氯碱工业,三是金属钠的制备。下列关于这三种工业生产的描述中正确的是( )
A.电解法制金属钠时,阳极反应式:Na++e-===Na
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是Cl-失电子
13
题号
3
2
4
5
6
8
7
9
10
11
12
1
13
题号
4
2
3
5
6
8
7
9
10
11
12
1
√
13
4.利用如图所示装置模拟电解原理在工业生产中
的应用。下列说法正确的是( )
A.氯碱工业中,X电极上的反应式是4OH--4e-===2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度不变
C.在铁片上镀铜时,Y是纯铜
D.制取金属镁时,Z是熔融的氯化镁
题号
4
2
3
5
6
8
7
9
10
11
12
1
13
D [X电极连接电源正极是阳极,Y电极连接电源负极是阴极。氯碱工业中阳极是Cl-放电生成Cl2,A错误;电解精炼铜时阳极粗铜溶解,阴极Cu2+放电析出Cu,但是粗铜中含有锌、铁、镍等杂质,使得溶液中Cu2+浓度变小,B项错误;铁片上镀铜时,阴极应该是铁片,阳极是纯铜,C项错误;镁是活泼金属,冶炼金属镁应该电解熔融氯化镁,D项正确。 ]
题号
2
4
5
3
6
8
7
9
10
11
12
1
√
13
5.如图甲为锌铜原电池装置,
乙为电解熔融氯化钠装置。则
下列说法正确的是( )
甲 乙
题号
2
4
5
3
6
8
7
9
10
11
12
1
13
B [甲装置为原电池,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,A错误;乙装置中铁为阴极,反应式为2Na++2e-===2Na,石墨为阳极,反应式为2Cl--2e-===Cl2↑,A是Cl2出口,B是Na出口,C、D错误。]
题号
2
4
5
3
6
8
7
9
10
11
12
1
√
13
6.用石墨作电极电解1 000 mL硝酸钾和硝酸铜的混合溶液,当通电一段时间后,两极都收集到112 mL气体(标准状况),假定电解后溶液体积仍为1 000 mL,则电解后溶液的pH为( )
A.4 B.3 C.2 D.1
题号
2
4
5
3
7
6
8
9
10
11
12
1
√
7.21世纪是钛的世纪,在800~1 000 ℃时电解TiO2可制得钛,装置如图所示,下列叙述正确的是( )
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为TiO2+4e-===Ti+2O2-
D.每生成0.1 mol Ti,转移0.2 mol电子
13
C [由O2-的移动方向可知,b为电源正极,A错误;石墨电极作阳极,发生氧化反应,B错误;每生成0.1 mol Ti,转移0.4 mol电子,D错误。]
题号
2
4
5
3
8
6
7
9
10
11
12
1
8.某同学设计了一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
13
甲 乙 丙
题号
2
4
5
3
8
6
7
9
10
11
12
1
根据要求回答相关问题:
(1)通入氢气的电极为________(填“正极”或“负极”),负极的电极反应式为__________________________。
(2)石墨电极为________(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液变红。
13
负极
H2-2e-+2OH-===2H2O
阳极
铁极
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为__________________。
减小
Cu2++2e-===Cu
题号
2
4
5
3
8
6
7
9
10
11
12
1
[解析] (1)通入氢气的电极为负极;由于电解质溶液是碱性的,所以该电极反应式为H2-2e-+2OH-===2H2O。
(2)由于铁电极与电源的负极连接,所以铁电极为阴极,石墨电极为阳极;反应一段时间后,在乙装置中滴入酚酞溶液,溶液中的H+在阴极(Fe电极)放电,破坏了附近的水的电离平衡,该区域的溶液显碱性,因此铁极区的溶液变红。
(3)因为粗铜中的锌等活动性比Cu强的杂质金属优先失去电子,而得到电子的只有Cu2+,所以丙装置中反应一段时间,硫酸铜溶液浓度会减小;精铜电极上的电极反应式为Cu2++2e-===Cu。
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
√
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
√
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
√
13
11.四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],其工作原理如图所示(a、b为石墨电极,c、d、e为离子交换膜),下列说法不正确的是( )
A.N为正极
B.标准状况下制备0.75NA (CH3)4NOH,
a、b两极共产生16.8 L气体
C.c、e均为阳离子交换膜
D.b极电极反应式:4OH--4e-===O2↑+2H2O
题号
9
2
4
5
3
8
6
7
10
11
12
1
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
√
13
12.下列有关2个电化
学装置的叙述不正确的
是( )
A.图Ⅰ,在不改变总反应的前提下,可用Na2SO4 替换 ZnSO4,用石墨替换Cu棒
B.图Ⅰ,电流形成的完整过程是:负极Zn-2e-===Zn2+,电子经导线流向正极,正极Cu2++2e-===Cu
C.图Ⅱ,通电后向两极滴加酚酞溶液,左侧变红
D.图Ⅰ,盐桥中Cl-向左侧移动,图Ⅱ,溶液中 Cl-向右侧移动
图Ⅰ
图Ⅱ
题号
9
2
4
5
3
8
6
7
10
11
12
1
B [A.将图Ⅰ中的ZnSO4替换为Na2SO4,对左侧区反应无影响,将Cu棒替换为石墨棒,仍然锌为负极,Cu为正极,故并不改变总反应,故A正确;B.图Ⅰ中电流形成的完整过程是:负极Zn-2e-===Zn2+,外电路中电子经导线流向正极,正极Cu2++2e-===Cu,内电路的盐桥中的阴离子移向负极,阳离子移向正极,故B错误;C.图Ⅱ中左侧区时阴极,电极反应为2H2O+2e-===H2↑+2OH- ,故阴极区显碱性,滴加酚酞溶液后溶液变红,故C正确;D.图Ⅰ中左侧为负极,故盐桥中Cl-向左侧移动,图Ⅱ中右侧时阳极,故溶液中Cl-向右侧移动,故D正确。]
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
13.常温下用惰性电极电解200 mL 氯化钠、硫酸铜的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
(1)曲线________(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。
(2)氯化钠的物质的量浓度为_______________,
硫酸铜的物质的量浓度为_____________。
(3)t2时所得溶液的pH为________。
13
Ⅱ
0.1 mol·L-1
0.1 mol·L-1
1
题号
9
2
4
5
3
8
6
7
10
11
12
1
13
题号
9
2
4
5
3
8
6
7
10
11
12
1
13
