苏教版高中化学选择性必修1化学反应原理专题1第一单元基础课时1化学反应的焓变课件(共65张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1化学反应原理专题1第一单元基础课时1化学反应的焓变课件(共65张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-09 00:00:00 | ||
图片预览











文档简介
(共65张PPT)
基础课时1 化学反应的焓变
专题1 化学反应与能量变化
第一单元 化学反应的热效应
学习
任务 1.通过宏观和微观的角度理解化学反应中能量变化的本质,正确认识和判断放热反应和吸热反应,培养宏观辨识与微观探析的化学核心素养。
2.通过辨识化学反应中的能量转化形式,形成能量可以相互转化的观念,正确理解反应热和焓变的概念,培养变化观念与平衡思想的化学核心素养。
3.通过从定性到定量描述化学反应中的能量变化的思维模型,能正确书写热化学方程式,培养证据推理与模型认知的化学核心素养。
必备知识 自主预习储备
一、反应热 焓变
1.体系与环境
被研究的物质系统称为____,体系以外的其他部分称为_____或____。
2.内能
内能是体系内物质的各种能量的总和,受温度、压强、物质的________和组成的影响。
3.反应热
在化学反应过程中,当反应物和生成物具有相同____时,__________的热称为化学反应的______,也称______。
体系
环境
外界
聚集状态
温度
吸收或释放
热效应
反应热
4.焓、焓变
(1)焓。
焓是与____有关的物理量,用符号H表示。
(2)焓变。
在恒压的条件下,化学反应过程中__________的热即为反应的____,用____表示,单位常采用__________。
【特别提醒】 (1)焓变为恒压条件下的反应热。(2)反应热、焓变的单位均为kJ·mol-1,热量的单位为kJ。
内能
吸收或释放
焓变
ΔH
kJ·mol-1
5.焓变(ΔH)与吸热反应和放热反应的关系
(1)化学反应过程中的能量变化。
一个化学反应是吸收能量还是释放能量,取决于____________和____________之间的相对大小。若反应物的总能量____生成物的总能量,则反应过程中________;若反应物的总能量____生成物的总能量,则反应过程中________。
反应物总能量
生成物总能量
小于
吸收能量
大于
释放能量
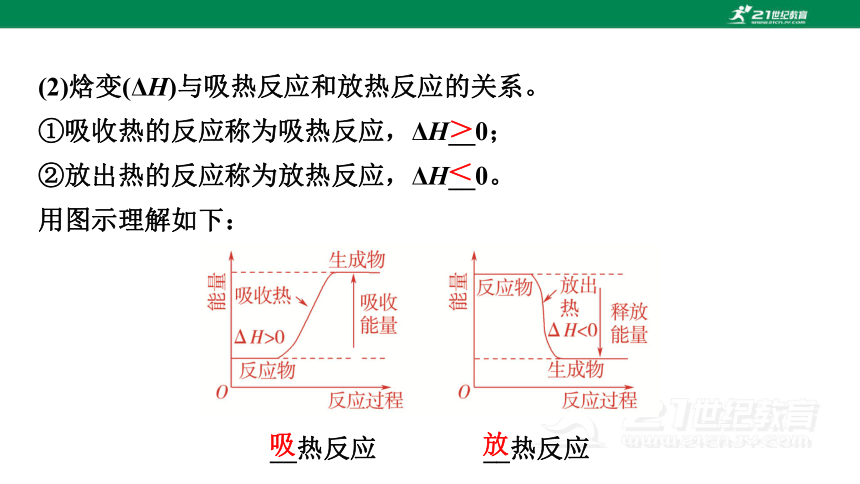
(2)焓变(ΔH)与吸热反应和放热反应的关系。
①吸收热的反应称为吸热反应,ΔH__0;
②放出热的反应称为放热反应,ΔH__0。
用图示理解如下:
__热反应 __热反应
>
<
吸
放
判一判 (正确的打“√”,错误的打“×”)
(1)反应热的单位与热量相同。 ( )
(2)恒压条件下化学反应的反应热就是该反应的焓变。 ( )
(3)一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH<0。 ( )
×
√
√
二、热化学方程式
1.概念
能够表示______的化学方程式叫做____________。
2.意义
不仅表示化学反应中的____变化,也表明了化学反应中的____变化。
实例:已知25 ℃、101 kPa下,热化学方程式为2H2(g)+O2(g)===
2H2O(l) ΔH=-571.6 kJ·mol-1,其表示在25 ℃、101 kPa下,______________与__________________完全反应生成_____________时____的热量是________。
反应热
热化学方程式
物质
能量
2 mol H2(氢气)
1 mol O2(氧气)
2 mol 液态水
放出
571.6 kJ
3.热化学方程式的书写方法
(1)写出相应的化学方程式。
热化学方程式中各物质化学式前的化学计量数表示其________,可以是整数或简单分数表示。
(2)标注反应的____和____。
没有特殊说明是在25 ℃(即298 K)、101 kPa条件下的焓变。不用标明反应条件(如“加热”“高温”“催化剂”等)。
物质的量
温度
压强
(3)标注各物质的________。
在物质后面用括号标注各物质的聚集状态:气体用“_”,液体用“_”,固体用“_”,水溶液用“___”。
(4)标注ΔH的正负。
热化学方程式后面空一格标注ΔH,若为放热反应,ΔH为“__”;若为吸热反应,ΔH为“__”。
(5)计算ΔH的数值。
根据化学方程式中的化学计量数计算写出ΔH的数值。ΔH单位是__________。
聚集状态
g
l
s
aq
-
+
kJ·mol-1
【特别提醒】 ΔH的单位中“mol-1”的含义
对一个热化学反应,ΔH的单位中“mol-1”不是指每摩尔具体物质,而是指“每摩尔反应”。因此ΔH必须与热化学方程式一一对应。
判一判 (正确的打“√”,错误的打“×”)
(1)一个化学反应的热化学方程式只有一个。 ( )
(2)若H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1,则2HCl(g)===H2(g)+Cl2(g) ΔH=+184.6 kJ·mol-1。 ( )
(3)2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
ΔH=-571.6 kJ·mol-1的含义是每摩尔该反应所放出的热量为571.6 kJ。 ( )
×
√
√
三、化学反应过程中能量变化的原因
1.实例
以N2(g)+O2(g)===2NO(g)反应的能量变化为例说明,如图所示:
由图可知:1 mol N2分子中的化学键断裂吸收的能量是_________,
1 mol O2分子中的化学键断裂吸收的能量是_______,2 mol NO分子中的化学键形成释放的能量是________,则N2(g)+O2(g)===2NO(g)的反应吸收的热量为_______________。
2.结论
化学反应中能量变化的本质:化学键的____和____是化学反应过程中伴随能量变化的根本原因。
946 kJ
498 kJ
1 264 kJ
180 kJ·mol-1
断裂
形成
判一判 (正确的打“√”,错误的打“×”)
(1)化学反应中必然存在化学键的变化。 ( )
(2)反应放热和吸热与化学键的断裂和形成有关。 ( )
(3)化学反应的焓变等于生成物的键能总和与反应物的键能总和之差。 ( )
√
√
×
关键能力 情境探究达成
化学反应吸热与放热反应的判断
[情境素材]
N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g)
[问题探究]
[问题1] N2与H2反应生成NH3的过程经历了几个阶段?每一阶段的能量变化如何?
提示:4个阶段;Ⅰ、吸热;Ⅱ、放热;Ⅲ、放热;Ⅳ、放热。
[问题2] N2(g)+3H2(g) 2NH3(g)的反应是放热反应还是吸热反应?
提示:放热反应。
[问题3] 根据上图分析化学反应中为什么会有能量变化?
提示:化学反应中反应物断裂化学键需要吸收的能量与生成物形成化学键需要释放的能量不同,是产生能量变化的原因,即化学键的断裂和形成是化学反应过程中伴随能量变化的根本原因。
[归纳总结]
类型
定义 放出热量的化学反应 吸收热量的化学反应
宏观
辨识 反应物具有的总能量大于生成物具有的总能量(E反>E生) 反应物具有的总能量小于生成物具有的总能量(E反<E生)
类型
定义 放出热量的化学反应 吸收热量的化学反应
微观探析
类型
定义 放出热量的化学反应 吸收热量的化学反应
与键能的关系 反应物的键能总和>生成物的键能总和,吸收热量
反应物的键能总和<生成物的键能总和,放出热量
ΔH的计算方法 ΔH=反应物的键能总和-生成物的键能总和
焓变 ΔH<0 ΔH>0
类型
定义 放出热量的化学反应 吸收热量的化学反应
图示
能量变化 体系的能量降低 体系的能量升高
ΔH的计算方法 ΔH=生成物具有的总能量-反应物具有的总能量
类型
定义 放出热量的化学反应 吸收热量的化学反应
常见反
应类型 常见的放热反应:
①可燃物的燃烧;
②酸碱中和反应;
③大多数化合反应;
④金属与(水)酸的置换反应;
⑤铝热反应 常见的吸热反应:
①大多数分解反应;
②盐的水解和弱电解质的电离;
③Ba(OH)2·8H2O与NH4Cl的反应;
④碳和水、C和CO2的反应
(1)任何化学反应都有反应热。
(2)放热反应和吸热反应是针对化学反应而言,物质三态之间的变化、物质的溶解等有能量的变化,但属于物理变化,故不属于放热反应或吸热反应。
(3)放热反应和吸热反应取决于反应物和生成物总能量的相对大小,与反应条件并无必然的关系。
(4)物质的能量越高,越不稳定。
[能力达成]
1.下列图示变化为吸热反应的是( )
√
A [A.反应物总能量小于生成物总能量,该化学反应为吸热反应,故A正确;B.反应物总能量大于生成物总能量,该化学反应为放热反应,故B错误;C.浓硫酸溶于水放热,此过程为放热过程,故C错误;D.活泼金属与酸的反应,该化学反应为放热反应,故D错误。]
A B
C D
2.CO(g)与H2O(g)反应的能量变化如图所示,
下列有关两者反应的说法正确的是( )
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)具有的总能量
大于1 mol CO2(g)和1 mol H2(g)具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量
√
B [由能量变化示意图可知,生成物的总能量比反应物的总能量低,该反应为放热反应,但并不是不需要加热;当1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)时,要吸收41 kJ热量。]
[情境素材]
发射卫星时可用肼(N2H4)作燃料,已知在298 K、101 kPa时1 g液态肼燃烧生成氮气和液态水,释放19.44 kJ的热量。与肼燃烧有关的化学方程式可表示如下:
(1)N2H4+O2===N2+2H2O
ΔH=-622.08 kJ·mol-1
(2)N2H4(l)+O2(g)===N2(g)+2H2O(l)
ΔH=622.08 kJ·mol-1
热化学方程式的书写与正误判断
[问题探究]
[问题1] 以上4个化学方程式中,哪几个不属于热化学方程式?热化学方程式中的“g”、“l”代表什么?固态和水溶液如何表示?
提示:(1)不属于热化学方程式;“g”表示物质的状态为气态,“l”表示物质的状态为液态,固态和水溶液分别用“s”和“aq”表示。
[问题3] 由热化学方程式(3)可得到N2(g)+2H2O(l)===N2H4(l)+O2(g)的ΔH为多少?
提示:ΔH=+622.08 kJ·mol-1。
[归纳总结]
热化学方程式书写的注意事项
(1)注意标明物质的聚集状态:热化学方程式中每种物质的化学式后面用括号注明物质的聚集状态(g、l、s),不用标“↑”或“↓”,水溶液用“aq”表示。
(2)注意注明必要的反应条件:焓变与温度和压强等测定条件有关,所以书写时必须在ΔH后指明反应的温度和压强(298 K、101 kPa时,可不注明)。
(3)注意明确化学计量数的含义:化学计量数只表示该物质的物质的量,不表示分子个数或原子个数,因此热化学方程式中化学计量数也可以是简单分数。
(4)注意ΔH的单位及符号:ΔH的单位常采用kJ·mol-1,ΔH只能写在化学方程式的右边,表示正向反应的焓变。ΔH<0表示为放热反应;ΔH>0表示为吸热反应。
(5)注意同一反应中化学计量数与ΔH数值的对应关系:化学方程式中各物质的化学计量数加倍,则ΔH的数值也加倍;若反应逆向进行,则ΔH的符号改变,但数值不变。
(6)可逆反应的ΔH表示的是当反应物按化学计量数完全反应时产生的热效应,实际反应中,若按化学计量数放入反应物,产生的热量偏小,如2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1,若2 mol SO2(g)与1 mol O2(g)反应,放出的热量小于196.6 kJ。
[能力达成]
1.下列热化学方程式正确的是( )
A.C2H5OH+3O2===2CO2+3H2O ΔH=-1 367.0 kJ·mol-1
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=57.3 kJ·mol-1
C.S(s)+O2(g)===SO2(g) ΔH=-a kJ·mol-1(a>0)
D.2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ
C [A项未标明各物质的聚集状态,B项NaOH和HCl的反应为放热反应,ΔH<0,D项中ΔH的单位是“kJ·mol-1”而不是“kJ”。]
√
2.根据所给信息完成下列热化学方程式:
(1)0.1 mol硫黄完全燃烧时放出的热量为29.6 kJ,请写出该反应的热化学方程式:_____________________________________________。
(2)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量:________________________________________________________________________________________________________________。
S(s)+O2(g)===SO2(g) ΔH =-296 kJ·mol-1
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=-906.8 kJ·mol-1
(3)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,请写出1 mol NH3分解对应的热化学方程式:________________________
_______________________。
(4)已知一些化学键的键能数据如表所示:
化学键 C—H C—F H—F F—F
键能/kJ·mol-1 414 489 565 155
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:_________________________________________________
__________________________。
CH4(g)+4F2(g)===CF4(g)+4HF(g)
(4)首先根据反应物和生成物写出化学方程式,注明各物质的状态,化学反应的反应热等于断裂旧化学键吸收的能量和形成新化学键放出的能量的差,根据键能数据可知,所求反应的反应热ΔH=414 kJ·mol-1×4+155 kJ·mol-1×4-489 kJ·mol-1×4-565 kJ·mol-1×4=-1 940 kJ·mol-1。
学习效果 随堂评估自测
2
4
3
题号
1
√
1.下列有关焓变与反应热的说法,正确的是( )
A.反应热和焓变的单位都是kJ
B.如果反应是在恒压条件下进行的,可认为此时的反应热和焓变相等
C.如果反应是在恒温恒容条件下进行的,可认为此时的反应热与焓变相等
D.有些化学反应不存在反应热,即焓变可以为“0”
2
4
3
题号
1
B [反应热和焓变的单位都是kJ·mol-1,A错误;恒压时的反应热与焓变相等,B正确、C错误;任何化学反应都有反应热,即ΔH≠0,D错误。 ]
2
3
题号
1
4
√
2.下列说法正确的是( )
A.反应热就是反应中放出的热量
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为正数
2
3
题号
1
4
C [反应热也指反应中吸收的热量,A错;在反应中,生成物比反应物所具有的总能量小,反应就放热,反之就吸热,C对;化学反应的实质是旧化学键的断裂和新化学键的形成,断键时吸收能量即反应物总键能,成键时放出能量即生成物总键能,后者大,则反应为放热反应,ΔH为“-”,D错。]
2
3
题号
4
1
√
必备知识
关键能力
学习效果
基础课时固基练
基础课时1 化学反应的焓变
2
3
题号
4
1
2
4
3
题号
1
4.写出下列反应的热化学方程式:
(1)1 mol C2H2(g)在O2中完全燃烧生成CO2和液态水,放出1 299.6 kJ热量。
________________________________________________________。
(2)23 g C2H5OH(l)在O2中完全燃烧生成CO2和液态水,放出683.4 kJ热量。
_______________________________________________________。
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 599.2 kJ·mol-1
C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 366.8 kJ·mol-1
2
4
3
题号
1
[解析] (1)1 mol C2H2(g)在氧气中完全燃烧生成CO2和液态水放出1 299.6 kJ热量,所以2 mol C2H2(g)在氧气中完全燃烧生成CO2和液态水放出热量2 599.2 kJ,则热化学方程式为2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 599.2 kJ·mol-1。
(2)23 g乙醇(l)完全燃烧生成CO2和液态水时放出683.4 kJ热量,则1 mol乙醇(l)质量为46 g,完全燃烧生成稳定的氧化物放出的热量为2×683.4 kJ=1 366.8 kJ,热化学方程式为C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 366.8 kJ·mol-1。
题号
基础课时固基练(1) 化学反应的焓变
1
3
5
2
4
6
8
7
√
1.下列说法中正确的是( )
A.化学反应中的能量变化都表现为热量变化
B.焓变是指1 mol物质参加反应时的能量变化
C.在一个确定的化学反应关系中,反应物的总焓与生成物的总焓一定不同
D.在一个确定的化学反应关系中,反应物的总焓总是高于生成物的总焓
C [化学反应的能量变化可以表现为很多方面,如转化为热能、电能、光能等;在一个确定的化学反应关系中,反应物的总焓不一定高于生成物的总焓,但总是不同;焓变是指在一定条件下化学反应的反应热,不仅是指 1 mol 物质参加反应时的能量变化。]
题号
1
3
5
2
4
6
8
7
题号
2
1
3
4
5
6
8
7
2.下列图像分别表示有关反应的反应过程与能量变化的关系。
Ⅰ Ⅱ
Ⅲ Ⅳ
题号
2
1
3
4
5
6
8
7
据此判断下列说法中正确的是( )
A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C.S(g)+O2(g)===SO2(g) ΔH1
S(s)+O2(g)===SO2(g) ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0
√
题号
2
1
3
4
5
6
8
7
A [由图像可知石墨的能量比金刚石的低,因此由石墨转变为金刚石是吸热反应,正确;白磷具有的能量比红磷的高,根据能量越低越稳定的原理,红磷比白磷稳定,错误;|ΔH1|>|ΔH2|,由于ΔH1、ΔH2均小于零,故ΔH1<ΔH2,错误;反应CO(g)+H2O(g)===CO2(g)+H2(g)为放热反应,ΔH<0,错误。]
题号
3
2
4
5
6
8
7
1
√
3.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。已知a>b>0,则下列有关叙述正确的是( )
A.每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
题号
3
2
4
5
6
8
7
1
B [根据图像可知,反应物的总能量低于生成物的总能量,该反应是吸热反应,每生成2 mol AB(g)吸收(a-b) kJ热量,A、C项错误;根据反应热等于生成物总能量与反应物总能量的差值可知,该反应热ΔH=(a-b) kJ·mol-1,B项正确;化学键断裂吸收能量,D项错误。]
题号
4
2
3
5
6
8
7
1
√
题号
4
2
3
5
6
8
7
1
D [根据题中所给数据,可以计算出2 mol H2(g)和1 mol O2(g)完全反应生成2 mol H2O(g)产生的焓变是436 kJ·mol-1×2+495 kJ·mol-1-463 kJ·mol-1×4=-485 kJ·mol-1,所以该过程的热化学方程式为2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1,D正确。]
题号
2
4
5
3
6
8
7
1
√
5.溴与氢气在一定条件下反应的热化学方程式如下。
①Br2(g)+H2(g) 2HBr(g) ΔH=-Q1 kJ·mol-1
②Br2(l)+H2(g) 2HBr(g) ΔH=-Q2 kJ·mol-1
下列说法正确的是( )
A.Q1<Q2
B.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量
C.相同条件下,Cl2(g)+H2(g) 2HCl(g) ΔH=-Q1 kJ·mol-1
D.向1 mol Br2(g)中加入1 mol H2(g),在该条件下充分反应,放出Q1 kJ热量
题号
2
4
5
3
6
8
7
1
B [由于溴蒸气变成液溴的过程放热,将热化学方程式①和②相减得到Br2(g) Br2(l) ΔH=Q2-Q1<0,则Q1>Q2,A项错误;物质由气态变为液态要放出热量,所以1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量,B项正确;因为Cl2比Br2活泼,则相同物质的量的Cl2(g)比Br2(g)具有的能量高,相同物质的量的HCl(g)比HBr(g)具有的能量低,Cl2(g)+H2(g) 2HCl(g) ΔH=-Q1 kJ·mol-1,C项错误;由于溴蒸气和氢气的反应为可逆反应,故向1 mol Br2(g)中加入1 mol H2(g)反应生成的HBr(g)的物质的量小于2 mol,放出的热量小于Q1 kJ,D项错误。]
题号
2
4
5
3
6
8
7
1
6.(易错题)Na2CO3(aq)与盐酸反应过程中的能量变化示意图如图所示,下列选项不正确的是( )
题号
2
4
5
3
6
8
7
1
√
题号
2
4
5
3
6
8
7
1
题号
2
4
5
3
7
6
8
1
√
7.(素养题)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:
则下列说法错误的是( )
A.生成CH3COOH总反应是化合反应
B.①→②过程形成了C—C键
C.CH4→CH3COOH过程中,没有C—H键发生断裂
D.①→②放出能量
题号
2
4
5
3
7
6
8
1
C [据图可知,甲烷和二氧化碳反应生成乙酸,总反应的原子利用率为100%,所以总反应是化合反应,故A正确;据图可知,①→②的过程有C—C键形成,故B正确;由图中变化可知甲烷在催化剂作用下经过选择性活化,其中甲烷分子中碳原子会与催化剂形成一个新的共价键,必有C—H键发生断裂,故C错误;据图可知,①→②的过程中焓值降低,该过程放出能量,故D正确。]
题号
2
4
5
3
8
6
7
1
154
题号
2
4
5
3
8
6
7
1
(2)H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,试写出H2S和SO2反应生成H2O(g)的热化学方程式:_______________________________________________________。
2H2S(g)+SO2(g)===3S(s)+2H2O(g) ΔH=-66 kJ·mol-1
基础课时1 化学反应的焓变
专题1 化学反应与能量变化
第一单元 化学反应的热效应
学习
任务 1.通过宏观和微观的角度理解化学反应中能量变化的本质,正确认识和判断放热反应和吸热反应,培养宏观辨识与微观探析的化学核心素养。
2.通过辨识化学反应中的能量转化形式,形成能量可以相互转化的观念,正确理解反应热和焓变的概念,培养变化观念与平衡思想的化学核心素养。
3.通过从定性到定量描述化学反应中的能量变化的思维模型,能正确书写热化学方程式,培养证据推理与模型认知的化学核心素养。
必备知识 自主预习储备
一、反应热 焓变
1.体系与环境
被研究的物质系统称为____,体系以外的其他部分称为_____或____。
2.内能
内能是体系内物质的各种能量的总和,受温度、压强、物质的________和组成的影响。
3.反应热
在化学反应过程中,当反应物和生成物具有相同____时,__________的热称为化学反应的______,也称______。
体系
环境
外界
聚集状态
温度
吸收或释放
热效应
反应热
4.焓、焓变
(1)焓。
焓是与____有关的物理量,用符号H表示。
(2)焓变。
在恒压的条件下,化学反应过程中__________的热即为反应的____,用____表示,单位常采用__________。
【特别提醒】 (1)焓变为恒压条件下的反应热。(2)反应热、焓变的单位均为kJ·mol-1,热量的单位为kJ。
内能
吸收或释放
焓变
ΔH
kJ·mol-1
5.焓变(ΔH)与吸热反应和放热反应的关系
(1)化学反应过程中的能量变化。
一个化学反应是吸收能量还是释放能量,取决于____________和____________之间的相对大小。若反应物的总能量____生成物的总能量,则反应过程中________;若反应物的总能量____生成物的总能量,则反应过程中________。
反应物总能量
生成物总能量
小于
吸收能量
大于
释放能量
(2)焓变(ΔH)与吸热反应和放热反应的关系。
①吸收热的反应称为吸热反应,ΔH__0;
②放出热的反应称为放热反应,ΔH__0。
用图示理解如下:
__热反应 __热反应
>
<
吸
放
判一判 (正确的打“√”,错误的打“×”)
(1)反应热的单位与热量相同。 ( )
(2)恒压条件下化学反应的反应热就是该反应的焓变。 ( )
(3)一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH<0。 ( )
×
√
√
二、热化学方程式
1.概念
能够表示______的化学方程式叫做____________。
2.意义
不仅表示化学反应中的____变化,也表明了化学反应中的____变化。
实例:已知25 ℃、101 kPa下,热化学方程式为2H2(g)+O2(g)===
2H2O(l) ΔH=-571.6 kJ·mol-1,其表示在25 ℃、101 kPa下,______________与__________________完全反应生成_____________时____的热量是________。
反应热
热化学方程式
物质
能量
2 mol H2(氢气)
1 mol O2(氧气)
2 mol 液态水
放出
571.6 kJ
3.热化学方程式的书写方法
(1)写出相应的化学方程式。
热化学方程式中各物质化学式前的化学计量数表示其________,可以是整数或简单分数表示。
(2)标注反应的____和____。
没有特殊说明是在25 ℃(即298 K)、101 kPa条件下的焓变。不用标明反应条件(如“加热”“高温”“催化剂”等)。
物质的量
温度
压强
(3)标注各物质的________。
在物质后面用括号标注各物质的聚集状态:气体用“_”,液体用“_”,固体用“_”,水溶液用“___”。
(4)标注ΔH的正负。
热化学方程式后面空一格标注ΔH,若为放热反应,ΔH为“__”;若为吸热反应,ΔH为“__”。
(5)计算ΔH的数值。
根据化学方程式中的化学计量数计算写出ΔH的数值。ΔH单位是__________。
聚集状态
g
l
s
aq
-
+
kJ·mol-1
【特别提醒】 ΔH的单位中“mol-1”的含义
对一个热化学反应,ΔH的单位中“mol-1”不是指每摩尔具体物质,而是指“每摩尔反应”。因此ΔH必须与热化学方程式一一对应。
判一判 (正确的打“√”,错误的打“×”)
(1)一个化学反应的热化学方程式只有一个。 ( )
(2)若H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1,则2HCl(g)===H2(g)+Cl2(g) ΔH=+184.6 kJ·mol-1。 ( )
(3)2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
ΔH=-571.6 kJ·mol-1的含义是每摩尔该反应所放出的热量为571.6 kJ。 ( )
×
√
√
三、化学反应过程中能量变化的原因
1.实例
以N2(g)+O2(g)===2NO(g)反应的能量变化为例说明,如图所示:
由图可知:1 mol N2分子中的化学键断裂吸收的能量是_________,
1 mol O2分子中的化学键断裂吸收的能量是_______,2 mol NO分子中的化学键形成释放的能量是________,则N2(g)+O2(g)===2NO(g)的反应吸收的热量为_______________。
2.结论
化学反应中能量变化的本质:化学键的____和____是化学反应过程中伴随能量变化的根本原因。
946 kJ
498 kJ
1 264 kJ
180 kJ·mol-1
断裂
形成
判一判 (正确的打“√”,错误的打“×”)
(1)化学反应中必然存在化学键的变化。 ( )
(2)反应放热和吸热与化学键的断裂和形成有关。 ( )
(3)化学反应的焓变等于生成物的键能总和与反应物的键能总和之差。 ( )
√
√
×
关键能力 情境探究达成
化学反应吸热与放热反应的判断
[情境素材]
N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g)
[问题探究]
[问题1] N2与H2反应生成NH3的过程经历了几个阶段?每一阶段的能量变化如何?
提示:4个阶段;Ⅰ、吸热;Ⅱ、放热;Ⅲ、放热;Ⅳ、放热。
[问题2] N2(g)+3H2(g) 2NH3(g)的反应是放热反应还是吸热反应?
提示:放热反应。
[问题3] 根据上图分析化学反应中为什么会有能量变化?
提示:化学反应中反应物断裂化学键需要吸收的能量与生成物形成化学键需要释放的能量不同,是产生能量变化的原因,即化学键的断裂和形成是化学反应过程中伴随能量变化的根本原因。
[归纳总结]
类型
定义 放出热量的化学反应 吸收热量的化学反应
宏观
辨识 反应物具有的总能量大于生成物具有的总能量(E反>E生) 反应物具有的总能量小于生成物具有的总能量(E反<E生)
类型
定义 放出热量的化学反应 吸收热量的化学反应
微观探析
类型
定义 放出热量的化学反应 吸收热量的化学反应
与键能的关系 反应物的键能总和>生成物的键能总和,吸收热量
反应物的键能总和<生成物的键能总和,放出热量
ΔH的计算方法 ΔH=反应物的键能总和-生成物的键能总和
焓变 ΔH<0 ΔH>0
类型
定义 放出热量的化学反应 吸收热量的化学反应
图示
能量变化 体系的能量降低 体系的能量升高
ΔH的计算方法 ΔH=生成物具有的总能量-反应物具有的总能量
类型
定义 放出热量的化学反应 吸收热量的化学反应
常见反
应类型 常见的放热反应:
①可燃物的燃烧;
②酸碱中和反应;
③大多数化合反应;
④金属与(水)酸的置换反应;
⑤铝热反应 常见的吸热反应:
①大多数分解反应;
②盐的水解和弱电解质的电离;
③Ba(OH)2·8H2O与NH4Cl的反应;
④碳和水、C和CO2的反应
(1)任何化学反应都有反应热。
(2)放热反应和吸热反应是针对化学反应而言,物质三态之间的变化、物质的溶解等有能量的变化,但属于物理变化,故不属于放热反应或吸热反应。
(3)放热反应和吸热反应取决于反应物和生成物总能量的相对大小,与反应条件并无必然的关系。
(4)物质的能量越高,越不稳定。
[能力达成]
1.下列图示变化为吸热反应的是( )
√
A [A.反应物总能量小于生成物总能量,该化学反应为吸热反应,故A正确;B.反应物总能量大于生成物总能量,该化学反应为放热反应,故B错误;C.浓硫酸溶于水放热,此过程为放热过程,故C错误;D.活泼金属与酸的反应,该化学反应为放热反应,故D错误。]
A B
C D
2.CO(g)与H2O(g)反应的能量变化如图所示,
下列有关两者反应的说法正确的是( )
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)具有的总能量
大于1 mol CO2(g)和1 mol H2(g)具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量
√
B [由能量变化示意图可知,生成物的总能量比反应物的总能量低,该反应为放热反应,但并不是不需要加热;当1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)时,要吸收41 kJ热量。]
[情境素材]
发射卫星时可用肼(N2H4)作燃料,已知在298 K、101 kPa时1 g液态肼燃烧生成氮气和液态水,释放19.44 kJ的热量。与肼燃烧有关的化学方程式可表示如下:
(1)N2H4+O2===N2+2H2O
ΔH=-622.08 kJ·mol-1
(2)N2H4(l)+O2(g)===N2(g)+2H2O(l)
ΔH=622.08 kJ·mol-1
热化学方程式的书写与正误判断
[问题探究]
[问题1] 以上4个化学方程式中,哪几个不属于热化学方程式?热化学方程式中的“g”、“l”代表什么?固态和水溶液如何表示?
提示:(1)不属于热化学方程式;“g”表示物质的状态为气态,“l”表示物质的状态为液态,固态和水溶液分别用“s”和“aq”表示。
[问题3] 由热化学方程式(3)可得到N2(g)+2H2O(l)===N2H4(l)+O2(g)的ΔH为多少?
提示:ΔH=+622.08 kJ·mol-1。
[归纳总结]
热化学方程式书写的注意事项
(1)注意标明物质的聚集状态:热化学方程式中每种物质的化学式后面用括号注明物质的聚集状态(g、l、s),不用标“↑”或“↓”,水溶液用“aq”表示。
(2)注意注明必要的反应条件:焓变与温度和压强等测定条件有关,所以书写时必须在ΔH后指明反应的温度和压强(298 K、101 kPa时,可不注明)。
(3)注意明确化学计量数的含义:化学计量数只表示该物质的物质的量,不表示分子个数或原子个数,因此热化学方程式中化学计量数也可以是简单分数。
(4)注意ΔH的单位及符号:ΔH的单位常采用kJ·mol-1,ΔH只能写在化学方程式的右边,表示正向反应的焓变。ΔH<0表示为放热反应;ΔH>0表示为吸热反应。
(5)注意同一反应中化学计量数与ΔH数值的对应关系:化学方程式中各物质的化学计量数加倍,则ΔH的数值也加倍;若反应逆向进行,则ΔH的符号改变,但数值不变。
(6)可逆反应的ΔH表示的是当反应物按化学计量数完全反应时产生的热效应,实际反应中,若按化学计量数放入反应物,产生的热量偏小,如2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1,若2 mol SO2(g)与1 mol O2(g)反应,放出的热量小于196.6 kJ。
[能力达成]
1.下列热化学方程式正确的是( )
A.C2H5OH+3O2===2CO2+3H2O ΔH=-1 367.0 kJ·mol-1
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=57.3 kJ·mol-1
C.S(s)+O2(g)===SO2(g) ΔH=-a kJ·mol-1(a>0)
D.2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ
C [A项未标明各物质的聚集状态,B项NaOH和HCl的反应为放热反应,ΔH<0,D项中ΔH的单位是“kJ·mol-1”而不是“kJ”。]
√
2.根据所给信息完成下列热化学方程式:
(1)0.1 mol硫黄完全燃烧时放出的热量为29.6 kJ,请写出该反应的热化学方程式:_____________________________________________。
(2)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量:________________________________________________________________________________________________________________。
S(s)+O2(g)===SO2(g) ΔH =-296 kJ·mol-1
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=-906.8 kJ·mol-1
(3)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,请写出1 mol NH3分解对应的热化学方程式:________________________
_______________________。
(4)已知一些化学键的键能数据如表所示:
化学键 C—H C—F H—F F—F
键能/kJ·mol-1 414 489 565 155
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:_________________________________________________
__________________________。
CH4(g)+4F2(g)===CF4(g)+4HF(g)
(4)首先根据反应物和生成物写出化学方程式,注明各物质的状态,化学反应的反应热等于断裂旧化学键吸收的能量和形成新化学键放出的能量的差,根据键能数据可知,所求反应的反应热ΔH=414 kJ·mol-1×4+155 kJ·mol-1×4-489 kJ·mol-1×4-565 kJ·mol-1×4=-1 940 kJ·mol-1。
学习效果 随堂评估自测
2
4
3
题号
1
√
1.下列有关焓变与反应热的说法,正确的是( )
A.反应热和焓变的单位都是kJ
B.如果反应是在恒压条件下进行的,可认为此时的反应热和焓变相等
C.如果反应是在恒温恒容条件下进行的,可认为此时的反应热与焓变相等
D.有些化学反应不存在反应热,即焓变可以为“0”
2
4
3
题号
1
B [反应热和焓变的单位都是kJ·mol-1,A错误;恒压时的反应热与焓变相等,B正确、C错误;任何化学反应都有反应热,即ΔH≠0,D错误。 ]
2
3
题号
1
4
√
2.下列说法正确的是( )
A.反应热就是反应中放出的热量
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为正数
2
3
题号
1
4
C [反应热也指反应中吸收的热量,A错;在反应中,生成物比反应物所具有的总能量小,反应就放热,反之就吸热,C对;化学反应的实质是旧化学键的断裂和新化学键的形成,断键时吸收能量即反应物总键能,成键时放出能量即生成物总键能,后者大,则反应为放热反应,ΔH为“-”,D错。]
2
3
题号
4
1
√
必备知识
关键能力
学习效果
基础课时固基练
基础课时1 化学反应的焓变
2
3
题号
4
1
2
4
3
题号
1
4.写出下列反应的热化学方程式:
(1)1 mol C2H2(g)在O2中完全燃烧生成CO2和液态水,放出1 299.6 kJ热量。
________________________________________________________。
(2)23 g C2H5OH(l)在O2中完全燃烧生成CO2和液态水,放出683.4 kJ热量。
_______________________________________________________。
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 599.2 kJ·mol-1
C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 366.8 kJ·mol-1
2
4
3
题号
1
[解析] (1)1 mol C2H2(g)在氧气中完全燃烧生成CO2和液态水放出1 299.6 kJ热量,所以2 mol C2H2(g)在氧气中完全燃烧生成CO2和液态水放出热量2 599.2 kJ,则热化学方程式为2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 599.2 kJ·mol-1。
(2)23 g乙醇(l)完全燃烧生成CO2和液态水时放出683.4 kJ热量,则1 mol乙醇(l)质量为46 g,完全燃烧生成稳定的氧化物放出的热量为2×683.4 kJ=1 366.8 kJ,热化学方程式为C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 366.8 kJ·mol-1。
题号
基础课时固基练(1) 化学反应的焓变
1
3
5
2
4
6
8
7
√
1.下列说法中正确的是( )
A.化学反应中的能量变化都表现为热量变化
B.焓变是指1 mol物质参加反应时的能量变化
C.在一个确定的化学反应关系中,反应物的总焓与生成物的总焓一定不同
D.在一个确定的化学反应关系中,反应物的总焓总是高于生成物的总焓
C [化学反应的能量变化可以表现为很多方面,如转化为热能、电能、光能等;在一个确定的化学反应关系中,反应物的总焓不一定高于生成物的总焓,但总是不同;焓变是指在一定条件下化学反应的反应热,不仅是指 1 mol 物质参加反应时的能量变化。]
题号
1
3
5
2
4
6
8
7
题号
2
1
3
4
5
6
8
7
2.下列图像分别表示有关反应的反应过程与能量变化的关系。
Ⅰ Ⅱ
Ⅲ Ⅳ
题号
2
1
3
4
5
6
8
7
据此判断下列说法中正确的是( )
A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C.S(g)+O2(g)===SO2(g) ΔH1
S(s)+O2(g)===SO2(g) ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0
√
题号
2
1
3
4
5
6
8
7
A [由图像可知石墨的能量比金刚石的低,因此由石墨转变为金刚石是吸热反应,正确;白磷具有的能量比红磷的高,根据能量越低越稳定的原理,红磷比白磷稳定,错误;|ΔH1|>|ΔH2|,由于ΔH1、ΔH2均小于零,故ΔH1<ΔH2,错误;反应CO(g)+H2O(g)===CO2(g)+H2(g)为放热反应,ΔH<0,错误。]
题号
3
2
4
5
6
8
7
1
√
3.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。已知a>b>0,则下列有关叙述正确的是( )
A.每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
题号
3
2
4
5
6
8
7
1
B [根据图像可知,反应物的总能量低于生成物的总能量,该反应是吸热反应,每生成2 mol AB(g)吸收(a-b) kJ热量,A、C项错误;根据反应热等于生成物总能量与反应物总能量的差值可知,该反应热ΔH=(a-b) kJ·mol-1,B项正确;化学键断裂吸收能量,D项错误。]
题号
4
2
3
5
6
8
7
1
√
题号
4
2
3
5
6
8
7
1
D [根据题中所给数据,可以计算出2 mol H2(g)和1 mol O2(g)完全反应生成2 mol H2O(g)产生的焓变是436 kJ·mol-1×2+495 kJ·mol-1-463 kJ·mol-1×4=-485 kJ·mol-1,所以该过程的热化学方程式为2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1,D正确。]
题号
2
4
5
3
6
8
7
1
√
5.溴与氢气在一定条件下反应的热化学方程式如下。
①Br2(g)+H2(g) 2HBr(g) ΔH=-Q1 kJ·mol-1
②Br2(l)+H2(g) 2HBr(g) ΔH=-Q2 kJ·mol-1
下列说法正确的是( )
A.Q1<Q2
B.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量
C.相同条件下,Cl2(g)+H2(g) 2HCl(g) ΔH=-Q1 kJ·mol-1
D.向1 mol Br2(g)中加入1 mol H2(g),在该条件下充分反应,放出Q1 kJ热量
题号
2
4
5
3
6
8
7
1
B [由于溴蒸气变成液溴的过程放热,将热化学方程式①和②相减得到Br2(g) Br2(l) ΔH=Q2-Q1<0,则Q1>Q2,A项错误;物质由气态变为液态要放出热量,所以1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量,B项正确;因为Cl2比Br2活泼,则相同物质的量的Cl2(g)比Br2(g)具有的能量高,相同物质的量的HCl(g)比HBr(g)具有的能量低,Cl2(g)+H2(g) 2HCl(g) ΔH=-Q1 kJ·mol-1,C项错误;由于溴蒸气和氢气的反应为可逆反应,故向1 mol Br2(g)中加入1 mol H2(g)反应生成的HBr(g)的物质的量小于2 mol,放出的热量小于Q1 kJ,D项错误。]
题号
2
4
5
3
6
8
7
1
6.(易错题)Na2CO3(aq)与盐酸反应过程中的能量变化示意图如图所示,下列选项不正确的是( )
题号
2
4
5
3
6
8
7
1
√
题号
2
4
5
3
6
8
7
1
题号
2
4
5
3
7
6
8
1
√
7.(素养题)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:
则下列说法错误的是( )
A.生成CH3COOH总反应是化合反应
B.①→②过程形成了C—C键
C.CH4→CH3COOH过程中,没有C—H键发生断裂
D.①→②放出能量
题号
2
4
5
3
7
6
8
1
C [据图可知,甲烷和二氧化碳反应生成乙酸,总反应的原子利用率为100%,所以总反应是化合反应,故A正确;据图可知,①→②的过程有C—C键形成,故B正确;由图中变化可知甲烷在催化剂作用下经过选择性活化,其中甲烷分子中碳原子会与催化剂形成一个新的共价键,必有C—H键发生断裂,故C错误;据图可知,①→②的过程中焓值降低,该过程放出能量,故D正确。]
题号
2
4
5
3
8
6
7
1
154
题号
2
4
5
3
8
6
7
1
(2)H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,试写出H2S和SO2反应生成H2O(g)的热化学方程式:_______________________________________________________。
2H2S(g)+SO2(g)===3S(s)+2H2O(g) ΔH=-66 kJ·mol-1
