苏教版高中化学选择性必修1化学反应原理专题1第一单元基础课时3能源的充分利用标准燃烧热课件(共35张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1化学反应原理专题1第一单元基础课时3能源的充分利用标准燃烧热课件(共35张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-09 19:19:47 | ||
图片预览










文档简介
(共35张PPT)
基础课时3 能源的充分利用 标准燃烧热
专题1 化学反应与能量变化
第一单元 化学反应的热效应
学习任务 1.通过了解化学在解决能源危机中的重要作用,培养科学态度与社会责任的化学核心素养。
2.通过在理解反应热的基础上,从宏观上理解辨识标准燃烧热的概念,学会关于标准燃烧热的相关计算,培养宏观辨识与微观探析的化学核心素养。
3.通过学习反应热大小的比较方法,培养证据推理与模型认知的化学核心素养。
必备知识 自主预习储备
一、能源的充分利用
1.能源定义:能提供____的自然资源。
2.分类
3.我国目前使用的主要能源是________。
4.新能源的特点:资源丰富、可再生、无污染或少污染。
能量
煤
石油
化石燃料
判一判 (正确的打“√”,错误的打“×”)
(1)太阳能是可再生的新能源。 ( )
(2)现在家庭使用的天然气是清洁的新能源。 ( )
(3)我国目前使用的主要能源是新能源。 ( )
(4)化石燃料包括氢能、石油、天然气。 ( )
√
×
×
×
二、标准燃烧热和热值
1.标准燃烧热
(1)概念。
在_______下,_____物质____燃烧的______叫作该物质的标准燃烧热。
(2)完全燃烧的标准。
N→_______、H→________、C→________。
(3)单位。
标准燃烧热是反应热的一种,单位为____________________。
【特别提醒】 标准燃烧热是反应热的一种类型,标准燃烧热规定可燃物必须是1 mol,生成物必须是稳定产物。
101 kPa
1 mol
完全
反应热
N2(g)
H2O(l)
CO2(g)
kJ·mol-1或kJ/mol
2.热值
___物质完全燃烧的反应热叫作该物质的热值。
3.标准燃烧热和热值的意义
标准燃烧热或热值可以衡量燃料燃烧放出热量的大小。
1 g
判一判 (正确的打“√”,错误的打“×”)
(1)在101 kPa下,1 mol纯物质完全燃烧所放出的热量就是其标准燃烧热。 ( )
(2)1 mol H2完全燃烧生成1 mol水蒸气时放出的热量为H2的标准燃烧热。 ( )
(3)表示标准燃烧热的热化学方程式可以有无数个。 ( )
(4)标准燃烧热的数值与参与反应的可燃物的物质的量成正比。 ( )
(5)所有物质的标准燃烧热其ΔH均小于0。 ( )
×
×
×
×
√
关键能力 情境探究达成
[情境素材]
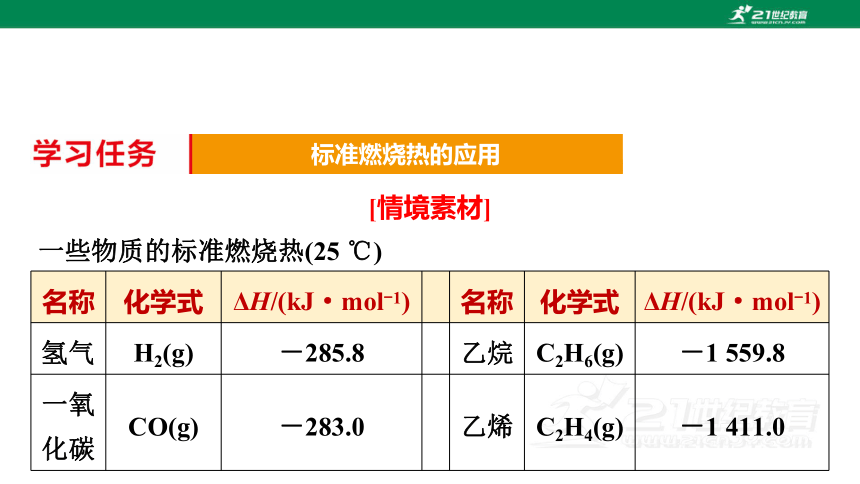
一些物质的标准燃烧热(25 ℃)
标准燃烧热的应用
名称 化学式 ΔH/(kJ·mol-1) 名称 化学式 ΔH/(kJ·mol-1)
氢气 H2(g) -285.8 乙烷 C2H6(g) -1 559.8
一氧化碳 CO(g) -283.0 乙烯 C2H4(g) -1 411.0
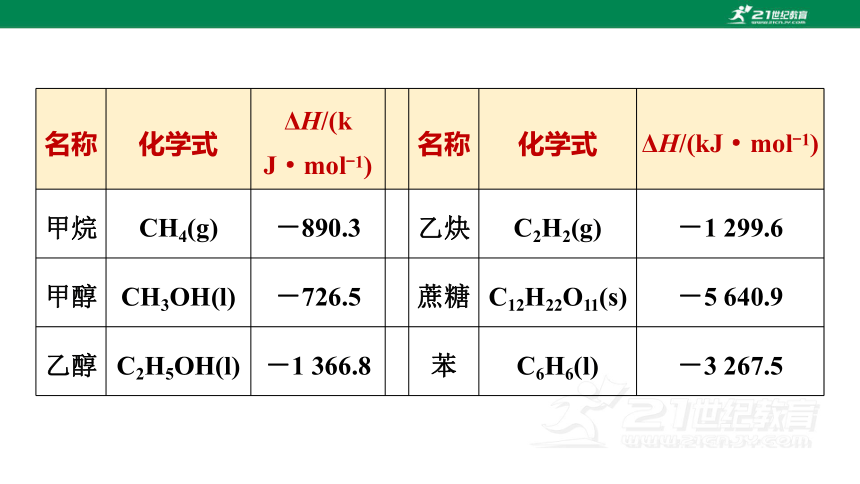
名称 化学式 ΔH/(kJ·mol-1) 名称 化学式 ΔH/(kJ·mol-1)
甲烷 CH4(g) -890.3 乙炔 C2H2(g) -1 299.6
甲醇 CH3OH(l) -726.5 蔗糖 C12H22O11(s) -5 640.9
乙醇 C2H5OH(l) -1 366.8 苯 C6H6(l) -3 267.5
[问题探究]
[问题1] 由上述表中数据可知甲烷的标准燃烧热为多少?意义是什么?
提示:甲烷的标准燃烧热为890.3 kJ·mol-1,或ΔH=-890.3 kJ·
mol-1,它表示25 ℃、101 kPa时,1 mol甲烷完全燃烧生成1 mol CO2(g)和2 mol H2O(l)时放出890.3 kJ的热量。
[问题2] 以H2为例,写出表示H2标准燃烧热的热化学方程式,表示标准燃烧热的热化学方程式与一般热化学方程式有什么不同?
[问题3] 利用表中数据,计算1 kg CH4在25 ℃、101 kPa时充分燃烧生成液态水放出的热量约为多少?
提示:1 kg甲烷的物质的量为62.5 mol,甲烷的标准燃烧热为890.3 kJ·mol-1,说明1 mol CH4在25 ℃、101 kPa时充分燃烧生成液态水放出的热量为890.3 kJ,则62.5 mol甲烷在25 ℃、101 kPa时充分燃烧生成液态水放出的热量为890.3 kJ·mol-1×62.5 mol≈5.56×104 kJ。
[归纳总结]
1.利用标准燃烧热可计算一定量燃料燃烧能放出多少热量,Q=n(燃料)×标准燃烧热
2.标准燃烧热和中和热的比较
标准燃烧热 中和热
相同点 能量变化ΔH及其单位 放热反应
ΔH<0,单位均为kJ·mol-1
标准燃烧热 中和热
不同点 反应物
的量 1 mol 不一定为1 mol
生成物
的量 不确定 生成液态水的量为1 mol
表示方法 标准燃烧热为a kJ·mol-1或ΔH=-a kJ·mol-1 中和热为57.3 kJ·mol-1或ΔH=-57.3 kJ·mol-1
[能力达成]
1.下列说法正确的是( )
A.1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热
B.25 ℃、101 kPa时,1 mol S和2 mol S的标准燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101 kPa时,1 mol碳燃烧所放出的热量为碳的标准燃烧热
√
B [A项,1 mol H2SO4与1 mol Ba(OH)2反应生成2 mol H2O(l),同时还有BaSO4沉淀生成,不符合中和热的定义;B项,标准燃烧热与可燃物的物质的量无关;C项,CO的燃烧属于放热反应;D项,1 mol碳燃烧不一定生成1 mol CO2。]
√
D [根据标准燃烧热的定义,碳的燃烧产物应是CO2(g);氢气燃烧是放热反应(ΔH<0)且生成液态水;25 ℃时甲烷的燃烧产物是CO2(g)和H2O(l)。]
学习效果 随堂评估自测
2
4
3
题号
1
√
1.如图为“能源分类相关图”,四组能源选项中全部符合图中阴影部分的是( )
A.煤炭、石油、潮汐能
B.水能、生物质能、天然气
C.太阳能、风能、沼气
D.地热能、海洋能、核能
C [太阳能、风能、沼气这三种能源既是新能源、可再生能源,又是来自太阳的能源。]
2
3
题号
1
4
√
2
3
题号
1
4
A [标准燃烧热是指在25 ℃、101 kPa时,1 mol物质完全燃烧的反应热。因此正丁烷完全燃烧产物应为CO2(g)和H2O(l),所以正丁烷的标准燃烧热为ΔH=-2 878 kJ·mol-1。]
2
3
题号
4
1
√
2
3
题号
4
1
2
4
3
题号
1
285.8 kJ·mol-1
2 220 kJ·mol-1
4 725.8 kJ
3∶1
2
4
3
题号
1
基础课时固基练(3) 能源的充分利用 标准燃烧热
√
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②太阳能 ③风能 ④石油 ⑤煤 ⑥生物质能 ⑦核能 ⑧氢能
A.①②③④ B.②③⑥⑧
C.①②⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
2
3
题号
4
1
5
B [煤、石油、天然气是化石能源,不是新能源,常见新能源有:太阳能、地热能、潮汐能、风能、氢能、生物质能等。]
2.燃烧是人们利用热能的重要方式。下列有关标准燃烧热的说法正确的是( )
A.标准燃烧热所指的燃烧产物一定是相应元素的最高价氧化物
B.含碳物质燃烧生成1 mol CO2时所放出的热量是标准燃烧热
C.实验测定H2的标准燃烧热时与所用H2量的多少无关
D.1 mol C燃烧生成CO2时放出的热量是生成CO时放出的热量的2倍
2
3
题号
4
1
5
√
C [A.标准燃烧热所指的燃烧产物是指25 ℃,101 kPa下稳定的物质,不一定是相应元素的最高价氧化物,如S元素的燃烧产物为SO2,故A错误;B.标准燃烧热是指在101 kPa下,1 mol物质完全燃烧的反应热,而不是生成1 mol CO2时所放出的热量,故B错误;C.实验测定H2的标准燃烧热时与所用氢气量的多少无关,最终要换算成1 mol氢气完全燃烧放出的能量,故C正确;D.1 mol C燃烧生成CO2时放出的热量与生成CO时放出的热量无法得出2倍关系,故D错误。]
2
3
题号
4
1
5
3.下列各组物质的标准燃烧热相等的是( )
A.C和CO B.红磷和白磷
C.3 mol C2H2(乙炔)和1 mol C6H6(苯) D.1 g H2和2 g H2
2
3
题号
4
1
5
√
4.下列热化学方程式正确的是(ΔH的绝对值均正确)( )
A.S(s)+O2(g)===SO2(g) ΔH=-269.8 kJ·mol-1(反应热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=57.3 kJ·mol-1(中和热)
C.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(标准燃烧热)
D.2NO2===2NO+O2 ΔH=116.2 kJ·mol-1(反应热)
2
3
题号
4
1
5
√
A [硫的燃烧是放热反应,因此ΔH<0,热化学方程式应体现物质的状态,A项正确;中和热是放热反应,即ΔH=-57.3 kJ·mol-1,B项错误;标准燃烧热是1 mol物质完全燃烧的反应热,H2O应是液态,C项错误;没有体现出物质的状态,D项错误。]
2
3
题号
4
1
5
5.(素养题)能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会人类面临的严峻课题,回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是_______(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧太可惜,应该综合利用
B.煤是发热很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时生成大量的SO2和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的利用率
2
3
题号
4
1
5
ACD
2
3
题号
4
1
5
(3)也有人认为利用氢气作为能源不太现实。你的观点呢?请说明能够支持你的观点的理由___________________________________
__________________________________________________________________________________________________________________
_______________________________________________________。
2
3
题号
4
1
5
不现实,理由是现有的制取氢气的方法
耗能太大,制取的成本太高,另外氢气的熔沸点太低,给储存和运输带来很大困难(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等)。
2
3
题号
4
1
5
基础课时3 能源的充分利用 标准燃烧热
专题1 化学反应与能量变化
第一单元 化学反应的热效应
学习任务 1.通过了解化学在解决能源危机中的重要作用,培养科学态度与社会责任的化学核心素养。
2.通过在理解反应热的基础上,从宏观上理解辨识标准燃烧热的概念,学会关于标准燃烧热的相关计算,培养宏观辨识与微观探析的化学核心素养。
3.通过学习反应热大小的比较方法,培养证据推理与模型认知的化学核心素养。
必备知识 自主预习储备
一、能源的充分利用
1.能源定义:能提供____的自然资源。
2.分类
3.我国目前使用的主要能源是________。
4.新能源的特点:资源丰富、可再生、无污染或少污染。
能量
煤
石油
化石燃料
判一判 (正确的打“√”,错误的打“×”)
(1)太阳能是可再生的新能源。 ( )
(2)现在家庭使用的天然气是清洁的新能源。 ( )
(3)我国目前使用的主要能源是新能源。 ( )
(4)化石燃料包括氢能、石油、天然气。 ( )
√
×
×
×
二、标准燃烧热和热值
1.标准燃烧热
(1)概念。
在_______下,_____物质____燃烧的______叫作该物质的标准燃烧热。
(2)完全燃烧的标准。
N→_______、H→________、C→________。
(3)单位。
标准燃烧热是反应热的一种,单位为____________________。
【特别提醒】 标准燃烧热是反应热的一种类型,标准燃烧热规定可燃物必须是1 mol,生成物必须是稳定产物。
101 kPa
1 mol
完全
反应热
N2(g)
H2O(l)
CO2(g)
kJ·mol-1或kJ/mol
2.热值
___物质完全燃烧的反应热叫作该物质的热值。
3.标准燃烧热和热值的意义
标准燃烧热或热值可以衡量燃料燃烧放出热量的大小。
1 g
判一判 (正确的打“√”,错误的打“×”)
(1)在101 kPa下,1 mol纯物质完全燃烧所放出的热量就是其标准燃烧热。 ( )
(2)1 mol H2完全燃烧生成1 mol水蒸气时放出的热量为H2的标准燃烧热。 ( )
(3)表示标准燃烧热的热化学方程式可以有无数个。 ( )
(4)标准燃烧热的数值与参与反应的可燃物的物质的量成正比。 ( )
(5)所有物质的标准燃烧热其ΔH均小于0。 ( )
×
×
×
×
√
关键能力 情境探究达成
[情境素材]
一些物质的标准燃烧热(25 ℃)
标准燃烧热的应用
名称 化学式 ΔH/(kJ·mol-1) 名称 化学式 ΔH/(kJ·mol-1)
氢气 H2(g) -285.8 乙烷 C2H6(g) -1 559.8
一氧化碳 CO(g) -283.0 乙烯 C2H4(g) -1 411.0
名称 化学式 ΔH/(kJ·mol-1) 名称 化学式 ΔH/(kJ·mol-1)
甲烷 CH4(g) -890.3 乙炔 C2H2(g) -1 299.6
甲醇 CH3OH(l) -726.5 蔗糖 C12H22O11(s) -5 640.9
乙醇 C2H5OH(l) -1 366.8 苯 C6H6(l) -3 267.5
[问题探究]
[问题1] 由上述表中数据可知甲烷的标准燃烧热为多少?意义是什么?
提示:甲烷的标准燃烧热为890.3 kJ·mol-1,或ΔH=-890.3 kJ·
mol-1,它表示25 ℃、101 kPa时,1 mol甲烷完全燃烧生成1 mol CO2(g)和2 mol H2O(l)时放出890.3 kJ的热量。
[问题2] 以H2为例,写出表示H2标准燃烧热的热化学方程式,表示标准燃烧热的热化学方程式与一般热化学方程式有什么不同?
[问题3] 利用表中数据,计算1 kg CH4在25 ℃、101 kPa时充分燃烧生成液态水放出的热量约为多少?
提示:1 kg甲烷的物质的量为62.5 mol,甲烷的标准燃烧热为890.3 kJ·mol-1,说明1 mol CH4在25 ℃、101 kPa时充分燃烧生成液态水放出的热量为890.3 kJ,则62.5 mol甲烷在25 ℃、101 kPa时充分燃烧生成液态水放出的热量为890.3 kJ·mol-1×62.5 mol≈5.56×104 kJ。
[归纳总结]
1.利用标准燃烧热可计算一定量燃料燃烧能放出多少热量,Q=n(燃料)×标准燃烧热
2.标准燃烧热和中和热的比较
标准燃烧热 中和热
相同点 能量变化ΔH及其单位 放热反应
ΔH<0,单位均为kJ·mol-1
标准燃烧热 中和热
不同点 反应物
的量 1 mol 不一定为1 mol
生成物
的量 不确定 生成液态水的量为1 mol
表示方法 标准燃烧热为a kJ·mol-1或ΔH=-a kJ·mol-1 中和热为57.3 kJ·mol-1或ΔH=-57.3 kJ·mol-1
[能力达成]
1.下列说法正确的是( )
A.1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热
B.25 ℃、101 kPa时,1 mol S和2 mol S的标准燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101 kPa时,1 mol碳燃烧所放出的热量为碳的标准燃烧热
√
B [A项,1 mol H2SO4与1 mol Ba(OH)2反应生成2 mol H2O(l),同时还有BaSO4沉淀生成,不符合中和热的定义;B项,标准燃烧热与可燃物的物质的量无关;C项,CO的燃烧属于放热反应;D项,1 mol碳燃烧不一定生成1 mol CO2。]
√
D [根据标准燃烧热的定义,碳的燃烧产物应是CO2(g);氢气燃烧是放热反应(ΔH<0)且生成液态水;25 ℃时甲烷的燃烧产物是CO2(g)和H2O(l)。]
学习效果 随堂评估自测
2
4
3
题号
1
√
1.如图为“能源分类相关图”,四组能源选项中全部符合图中阴影部分的是( )
A.煤炭、石油、潮汐能
B.水能、生物质能、天然气
C.太阳能、风能、沼气
D.地热能、海洋能、核能
C [太阳能、风能、沼气这三种能源既是新能源、可再生能源,又是来自太阳的能源。]
2
3
题号
1
4
√
2
3
题号
1
4
A [标准燃烧热是指在25 ℃、101 kPa时,1 mol物质完全燃烧的反应热。因此正丁烷完全燃烧产物应为CO2(g)和H2O(l),所以正丁烷的标准燃烧热为ΔH=-2 878 kJ·mol-1。]
2
3
题号
4
1
√
2
3
题号
4
1
2
4
3
题号
1
285.8 kJ·mol-1
2 220 kJ·mol-1
4 725.8 kJ
3∶1
2
4
3
题号
1
基础课时固基练(3) 能源的充分利用 标准燃烧热
√
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②太阳能 ③风能 ④石油 ⑤煤 ⑥生物质能 ⑦核能 ⑧氢能
A.①②③④ B.②③⑥⑧
C.①②⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
2
3
题号
4
1
5
B [煤、石油、天然气是化石能源,不是新能源,常见新能源有:太阳能、地热能、潮汐能、风能、氢能、生物质能等。]
2.燃烧是人们利用热能的重要方式。下列有关标准燃烧热的说法正确的是( )
A.标准燃烧热所指的燃烧产物一定是相应元素的最高价氧化物
B.含碳物质燃烧生成1 mol CO2时所放出的热量是标准燃烧热
C.实验测定H2的标准燃烧热时与所用H2量的多少无关
D.1 mol C燃烧生成CO2时放出的热量是生成CO时放出的热量的2倍
2
3
题号
4
1
5
√
C [A.标准燃烧热所指的燃烧产物是指25 ℃,101 kPa下稳定的物质,不一定是相应元素的最高价氧化物,如S元素的燃烧产物为SO2,故A错误;B.标准燃烧热是指在101 kPa下,1 mol物质完全燃烧的反应热,而不是生成1 mol CO2时所放出的热量,故B错误;C.实验测定H2的标准燃烧热时与所用氢气量的多少无关,最终要换算成1 mol氢气完全燃烧放出的能量,故C正确;D.1 mol C燃烧生成CO2时放出的热量与生成CO时放出的热量无法得出2倍关系,故D错误。]
2
3
题号
4
1
5
3.下列各组物质的标准燃烧热相等的是( )
A.C和CO B.红磷和白磷
C.3 mol C2H2(乙炔)和1 mol C6H6(苯) D.1 g H2和2 g H2
2
3
题号
4
1
5
√
4.下列热化学方程式正确的是(ΔH的绝对值均正确)( )
A.S(s)+O2(g)===SO2(g) ΔH=-269.8 kJ·mol-1(反应热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=57.3 kJ·mol-1(中和热)
C.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(标准燃烧热)
D.2NO2===2NO+O2 ΔH=116.2 kJ·mol-1(反应热)
2
3
题号
4
1
5
√
A [硫的燃烧是放热反应,因此ΔH<0,热化学方程式应体现物质的状态,A项正确;中和热是放热反应,即ΔH=-57.3 kJ·mol-1,B项错误;标准燃烧热是1 mol物质完全燃烧的反应热,H2O应是液态,C项错误;没有体现出物质的状态,D项错误。]
2
3
题号
4
1
5
5.(素养题)能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会人类面临的严峻课题,回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是_______(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧太可惜,应该综合利用
B.煤是发热很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时生成大量的SO2和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的利用率
2
3
题号
4
1
5
ACD
2
3
题号
4
1
5
(3)也有人认为利用氢气作为能源不太现实。你的观点呢?请说明能够支持你的观点的理由___________________________________
__________________________________________________________________________________________________________________
_______________________________________________________。
2
3
题号
4
1
5
不现实,理由是现有的制取氢气的方法
耗能太大,制取的成本太高,另外氢气的熔沸点太低,给储存和运输带来很大困难(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等)。
2
3
题号
4
1
5
