苏教版高中化学选择性必修1化学反应原理专题3第三单元基础课时20盐类水解的原理课件(共60张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1化学反应原理专题3第三单元基础课时20盐类水解的原理课件(共60张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-09 19:26:06 | ||
图片预览










文档简介
(共60张PPT)
基础课时20 盐类水解的原理
专题3 水溶液中的离子反应
第三单元 盐类的水解
学习
任务 1.通过认识盐类水解有一定限度,理解盐类水解的概念,能正确书写盐类水解的离子方程式和化学方程式,培养变化观念与平衡思想的化学核心素养。
2.通过实验分析、推理等方法认识盐类水解的实质、掌握盐溶液呈现酸、碱性的原因和规律,能根据盐的组成判断溶液的酸、碱性,培养证据推理与模型认知的化学核心素养。
必备知识 自主预习储备
一、盐溶液的酸碱性
1.探究盐溶液的酸碱性
【实验步骤】
(1)将NaCl、Na2CO3、NH4Cl、CH3COONa、AlCl3分别盛放在 5个烧杯中,加水溶解。
(2)用pH试纸分别测定五种溶液的酸碱性。
【实验记录】
【实验结论】强酸弱碱盐溶液呈酸性;强酸强碱盐溶液呈中性;强碱弱酸盐溶液呈碱性。
盐溶液 NaCl Na2CO3 NH4Cl CH3COONa AlCl3
盐的类型 ______
____ ______
____ ______
____ ______
____ ______
____
盐溶液的
酸碱性 ____ ____ ____ ____ ____
强酸强
碱盐
弱酸强
碱盐
强酸弱
碱盐
弱酸强
碱盐
强酸弱
碱盐
中性
碱性
酸性
碱性
酸性
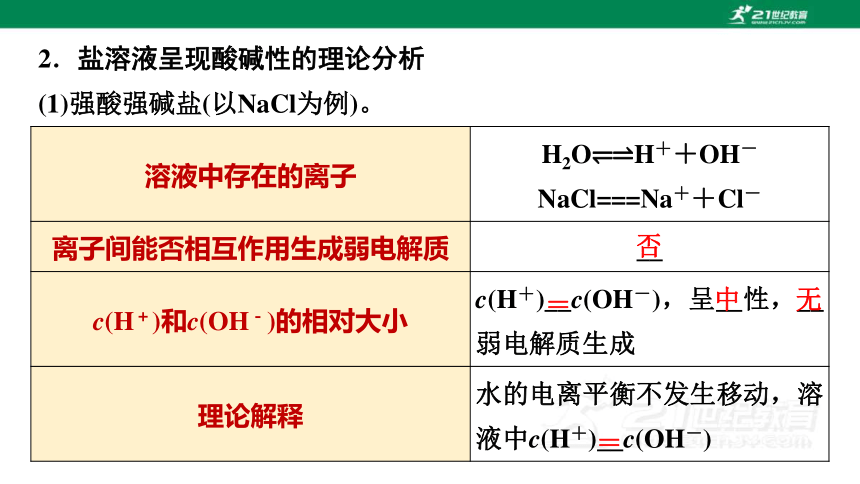
2.盐溶液呈现酸碱性的理论分析
(1)强酸强碱盐(以NaCl为例)。
溶液中存在的离子 H2O H++OH-
NaCl===Na++Cl-
离子间能否相互作用生成弱电解质 __
c(H+)和c(OH-)的相对大小 c(H+)__c(OH-),呈__性,__弱电解质生成
理论解释 水的电离平衡不发生移动,溶液中c(H+)__c(OH-)
否
=
中
无
=
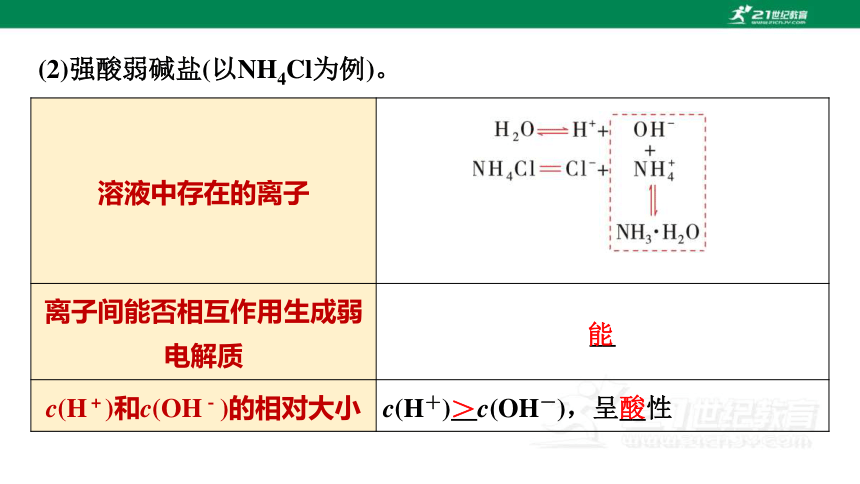
(2)强酸弱碱盐(以NH4Cl为例)。
溶液中存在的离子
离子间能否相互作用生成弱电解质 __
c(H+)和c(OH-)的相对大小 c(H+)__c(OH-),呈__性
能
>
酸
理论解释
总反应离子方程式
>
(3)强碱弱酸盐(以CH3COONa为例)。
溶液中存在的离子
离子间能否相互作用生成弱电解质 __
c(H+)和c(OH-)的相对大小 c(H+)__c(OH-),呈__性
能
<
碱
理论解释 CH3COO-和H+结合生成弱电解质__________,使水的电离平衡向_________方向移动,使溶液中
c(H+)___c(OH-)
总反应离子方程式 ______________________________________
3.盐类的水解
(1)概念:盐在水溶液中电离出来的离子与水电离出来的___或_____结合生成________的反应,称为盐类的水解。
(2)实质:生成___________,使水的电离平衡被破坏而建立起新的平衡。
CH3COOH
电离
<
CH3COO-+H2O CH3COOH+OH-
H+
OH-
弱电解质
弱酸或弱碱
(3)盐类水解的特点
【特别提醒】 盐类的水解反应可以看成酸碱中和反应的逆过程。我们可以根据生成盐的酸和碱的相对强弱,来判断盐溶液的酸碱性。
判一判 (正确的打“√”,错误的打“×”)
(1)盐类的水解过程促进了水的电离。 ( )
(2)酸式盐溶液一定显酸性。 ( )
(3)酸碱恰好中和生成的盐溶液一定显中性。 ( )
(4)盐溶液显酸性、碱性还是中性,取决于溶液中c(H+)与c(OH-)的相对大小。 ( )
(5)盐水解后,溶液不是呈酸性就是呈碱性。 ( )
√
×
×
√
×
二、盐类水解的表示方法
1.盐类水解可以用化学方程式或离子方程式表示,一般模式:盐+水 酸+碱或盐的离子+水 弱酸(或弱碱)+ OH-(或H+)。
2.分类表示
(1)盐类水解是可逆反应,是中和反应的逆反应,而中和反应趋向完全,所以盐类的水解反应是很微弱的,盐类水解程度一般很小,水解时通常不生成沉淀和气体,书写水解的化学方程式或离子方程式时,一般用“ ”连接,产物不标“↑”或“↓”。
如:CH3COONa:_________________________________________;_____________________________________。
CH3COONa+H2O CH3COOH+NaOH
CH3COO-+H2O CH3COOH+OH-
(2)多元弱酸根离子的水解分步进行,水解以第一步为主。如:
Na2CO3: ________________________________________ 、
________________________________。
(3)多元弱碱阳离子水解反应过程复杂,只要求一步写到底。如:
AlCl3:______________________________。
Al3++3H2O Al(OH)3+3H+
×
√
×
×
×
×
关键能力 情境探究达成
盐类水解的实质和规律
[情境素材]
用pH计测定下列溶液的pH与7的关系,按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类完成下表。
盐溶液 pH 盐类型 酸碱性
NaCl pH=7 强酸强碱盐 中性
Na2SO4 pH=7
盐溶液 pH 盐类型 酸碱性
Na2CO3 pH>7 强碱弱酸盐 碱性
NaHCO3 pH>7
CH3COONa pH>7
FeCl3 pH<7 强酸弱碱盐 酸性
(NH4)2SO4 pH<7
[问题探究]
[问题1] 结合情境素材分析回答以下问题:
(1)盐溶液不是中性的原因是什么?各溶液中哪种离子发生了水解?
(2)盐溶液的酸碱性与盐的类型之间有什么关系?
(3)综上(1)(2)问题分析什么类型的盐能够发生水解?
(2)强酸强碱盐不水解,如 NaCl、 KNO3,溶液显中性;强酸弱碱盐,如 NH4Cl、(NH4)2SO4水解溶液显酸性;强碱弱酸盐,如 Na2CO3、CH3COONa水解溶液显碱性。
(3)有弱才水解,如强酸弱碱盐、强碱弱酸盐或弱酸弱碱盐。
[问题2] Na2CO3和NaOH溶液都呈碱性,它们对水的电离影响是否相同?
[问题3] 已知在相同条件下NH3·H2O与CH3COOH电离程度几乎相等,CH3COOH的酸性比H2CO3强,那么NH4HCO3溶液显酸性、碱性还是中性?
[归纳总结]
1.盐类水解的规律
水解规律:水解看组成,有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性,规律要记清。
a.“有弱才水解,无弱不水解”——盐中有弱酸阴离子或弱碱阳离子才水解,若没有,则是强酸强碱盐,不发生水解反应。
b.“越弱越水解”——弱酸阴离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。
c.“都弱都水解”——弱酸弱碱盐电离出的弱酸阴离子和弱碱阳离子都发生水解,且相互促进。
d.“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐显酸性,强碱弱酸盐显碱性。
2.弱酸酸式盐水解的规律
弱酸酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
(1)若电离程度大于水解程度,溶液显酸性,如 NaHSO3、NaH2PO4 等。
(2)若电离程度小于水解程度,溶液显碱性,如 NaHCO3、Na2HPO4等。
3.比较同浓度溶液的酸碱性(pH)大小的方法
(1)首先对物质分类,pH大小规律是碱>盐>酸。
(2)同类物质的pH大小规律是
①碱:二元强碱>一元强碱>一元弱碱;
②酸:一元弱酸>一元强酸>二元强酸;
③盐:强碱弱酸盐>强酸强碱盐>强酸弱碱盐。
[能力达成]
1.在水中加入下列物质,可使水的电离平衡正向移动,且所得溶液呈酸性的是( )
A.NaCl B.NaHSO4
C.Na2CO3 D.NH4Cl
D [A项,NaCl对水的电离平衡无影响,溶液呈中性;B项,NaHSO4中的H+抑制水的电离,且溶液呈酸性;C项,Na2CO3水解促进水的电离,溶液呈碱性;D项,NH4Cl水解促进水的电离,溶液呈酸性。]
√
2.等物质的量浓度的下列物质的溶液,其pH由小到大的顺序排列正确的是( )
①CH3COONa ②NaOH ③NaNO3 ④HCl ⑤Al2(SO4)3
A.①②③④⑤ B.⑤④③②①
C.④⑤③①② D.④⑤②①③
√
[情境素材]
由于盐类的水解过程是一个可逆过程,因此在书写水解反应的化学方程式时,应用“ ”代替“===”。例如,醋酸钠的水解反应可用如下化学方程式表示:
CH3COONa+H2O CH3COOH+NaOH
或用如下离子方程式表示:
CH3COO-+H2O CH3COOH+OH-
盐类水解方程式的书写
[问题探究]
[问题] 盐类水解方程式的常见类型
一元强碱
弱酸盐 以CH3COONa为例:_____________________________
一元强酸
弱碱盐 以NH4Cl为例:__________________________________
多元强碱
弱酸盐
(正盐) 多元弱酸的阴离子水解是分步进行的,以第一步水解为主。如Na2CO3的水解:_______________、____________________
多元强酸
弱碱盐 多元弱碱的阳离子水解复杂,可看作一步水解,如AlCl3的水解:__________________________________
相互促进
水解反应
√
2.氯化铵晶体溶于重水(D2O)中,溶液呈现酸性,用离子方程式表示其原因:_________________________________________________
_____________________。
NH3·DHO+D3O+)
学习效果 随堂评估自测
2
4
3
题号
1
√
1.下列关于盐溶液呈酸碱性的说法错误的是( )
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离的c(OH-)≠c(H+)
D.水电离出的H+(或OH-)与盐中的弱酸根离子(或弱碱阳离子)结合,造成盐溶液呈碱(或酸)性
C [水电离出的c(H+)=c(OH-)一定成立,CH3COONa溶液显碱性,是由于水电离出的H+有一部分与CH3COO-结合成CH3COOH,从而使c(H+)2
3
题号
1
4
√
2.在盐类水解的过程中,下列说法正确的是( )
A.盐的电离平衡被破坏
B.水的电离程度一定会增大
C.溶液的pH一定会增大
D.c(H+)与c(OH-)的乘积一定会增大
B [大多数的盐为强电解质,在水中完全电离,A错误;盐类水解促进水的电离,B正确;强酸弱碱盐水解溶液呈酸性,pH减小,C错误;一定温度下的稀溶液中,c(H+)与c(OH-)乘积是一个常数,D错误。]
2
3
题号
4
1
√
2
3
题号
4
1
2
4
3
题号
1
4.下列化合物:
①HCl ②NaOH ③CH3COOH
④NH3·H2O ⑤CH3COONa ⑥NH4Cl
(1)溶液呈碱性的有________(填序号)。
(2)在常温下,0.01 mol·L-1HCl溶液的pH=________。
(3)在常温下,pH=11的CH3COONa溶液中由水电离产生的c(OH-)=______________。
(4)用离子方程式表示CH3COONa溶液呈碱性的原因________________________________________。
②④⑤
2
10-3mol·L-1
CH3COO-+
H2O CH3COOH+OH-
2
4
3
题号
1
题号
基础课时固基练(20) 盐类水解的原理
1
3
5
2
4
6
8
7
9
10
11
12
√
1.下列有关盐类水解的叙述正确的是( )
A.溶液呈中性的盐一定是强酸、强碱反应生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要取决于形成盐的酸和碱的相对强弱
D.强酸强碱盐的水溶液一定呈中性
题号
1
3
5
2
4
6
8
7
9
10
11
12
C [如果弱酸、弱碱的电离程度相当,生成的盐的水溶液呈中性,如CH3COONH4溶液呈中性,A错误;含有弱酸根离子的盐的水溶液不一定呈碱性,如NaHSO3溶液呈酸性,B错误;强酸强碱盐的水溶液不一定呈中性,如NaHSO4溶液呈酸性,D错误。]
题号
2
1
3
4
5
6
8
7
9
10
11
12
2.下列物质的水溶液因溶质水解呈酸性的是( )
A.FeCl3 B.Na2CO3
C.H2SO3 D.KHSO4
√
题号
3
2
4
5
6
8
7
9
10
11
12
1
√
题号
4
2
3
5
6
8
7
9
10
11
12
1
√
4.有四种物质的量浓度相等且都由一价阳离子A+和B+及一价阴离子X-和Y-组成的盐溶液。据测定常温下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7,由此判断不水解的盐可能是( )
A.BX B.AX C.AY D.BY
B [AY溶液的pH>7,说明A相对于Y显强碱性,BX溶液的pH<7,说明X相对于B显强酸性。又因AX的pH=7,故AX可能是不水解的盐,B正确。]
题号
2
4
5
3
6
8
7
9
10
11
12
1
√
5.相同温度、相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别为( )
A.NH4Cl (NH4)2SO4 CH3COONa
B.(NH4)2SO4 NH4Cl CH3COONa
C.(NH4)2SO4 NH4Cl NaOH
D.CH3COOH NH4Cl (NH4)2SO4
题号
2
4
5
3
6
8
7
9
10
11
12
1
√
6.广义的水解观认为水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化。根据以上信息,下列物质水解后的产物错误的是( )
A.BaO2的水解产物是Ba(OH)2和H2O2
B.BrCl水解的产物是HClO和HBr
C.Mg2C3水解的产物是Mg(OH)2和C3H4
D.Al2S3水解的产物是Al(OH)3和H2S
B [从题目信息可知广义水解后元素化合价不变,也可理解为化合物中显正价的水解时结合OH-,显负价的结合H+。BrCl中由于Cl的非金属性强显负价,所以BrCl水解产物为HBrO和HCl。]
题号
2
4
5
3
7
6
8
9
10
11
12
1
√
题号
2
4
5
3
8
6
7
9
10
11
12
1
√
题号
2
4
5
3
8
6
7
9
10
11
12
1
题号
9
2
4
5
3
8
6
7
10
11
12
1
√
9.物质的量浓度相同的下列各物质的溶液,由水电离出的c(H+)由大到小的顺序是( )
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A.④③②① B.①②③④ C.③②④① D.③④②①
C [水中存在电离平衡:H2O H++OH-,若将自身能电离出H+或OH-的物质加入水中,则水的电离程度减小;若将能结合水中H+或OH-的物质加入水中,则水的电离程度增大。NaHSO4抑制水的电离,Na2CO3、NaHCO3均能促进水的电离且Na2CO3比NaHCO3的促进程度更大,Na2SO4不影响水的电离。本题选C。]
题号
9
2
4
5
3
8
6
7
10
11
12
1
√
题号
9
2
4
5
3
8
6
7
10
11
12
1
题号
9
2
4
5
3
8
6
7
10
11
12
1
11.由一价离子组成的四种盐溶液:AC、BD、AD、BC各1 mol·L-1,在室温下,前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液的pH<7,则下列说法正确的是( )
A B C D
碱性 AOH>BOH AOH<BOH AOH>BOH AOH<BOH
酸性 HC>HD HC>HD HC<HD HC<HD
√
题号
9
2
4
5
3
8
6
7
10
11
12
1
题号
9
2
4
5
3
8
6
7
10
11
12
1
12.现有0.175 mol·L-1醋酸钠溶液500 mL(已知醋酸的电离常数Ka=1.75×10-5)。
(1)写出醋酸钠水解反应的化学方程式:_____________________。
(2)下列图像能说明醋酸钠的水解反应达到平衡的是_____(填字母)。
A.溶液中c(Na+)与反应时间t的关系 B.CH3COO-的水解速率与反应时间t的关系 C.溶液的pH与反应时间t的关系 D.Kw与反应时间t的关系
CH3COONa+H2O
CH3COOH+NaOH
BC
题号
9
2
4
5
3
8
6
7
10
11
12
1
CD
7.2
0.35
9
题号
9
2
4
5
3
8
6
7
10
11
12
1
[解析] (1)醋酸钠水解生成醋酸和氢氧化钠,化学方程式为CH3COONa+H2O CH3COOH+NaOH。
(2)A项,钠离子不水解,所以浓度始终不变,错误;B项,醋酸根离子开始时水解速率最大,后逐渐减小,平衡时不再变化,正确;C项,随着水解的逐渐进行,pH逐渐增大,平衡时不再发生变化,正确;D项,Kw是温度常数,温度不变,Kw不变,错误。
题号
9
2
4
5
3
8
6
7
10
11
12
1
题号
9
2
4
5
3
8
6
7
10
11
12
1
基础课时20 盐类水解的原理
专题3 水溶液中的离子反应
第三单元 盐类的水解
学习
任务 1.通过认识盐类水解有一定限度,理解盐类水解的概念,能正确书写盐类水解的离子方程式和化学方程式,培养变化观念与平衡思想的化学核心素养。
2.通过实验分析、推理等方法认识盐类水解的实质、掌握盐溶液呈现酸、碱性的原因和规律,能根据盐的组成判断溶液的酸、碱性,培养证据推理与模型认知的化学核心素养。
必备知识 自主预习储备
一、盐溶液的酸碱性
1.探究盐溶液的酸碱性
【实验步骤】
(1)将NaCl、Na2CO3、NH4Cl、CH3COONa、AlCl3分别盛放在 5个烧杯中,加水溶解。
(2)用pH试纸分别测定五种溶液的酸碱性。
【实验记录】
【实验结论】强酸弱碱盐溶液呈酸性;强酸强碱盐溶液呈中性;强碱弱酸盐溶液呈碱性。
盐溶液 NaCl Na2CO3 NH4Cl CH3COONa AlCl3
盐的类型 ______
____ ______
____ ______
____ ______
____ ______
____
盐溶液的
酸碱性 ____ ____ ____ ____ ____
强酸强
碱盐
弱酸强
碱盐
强酸弱
碱盐
弱酸强
碱盐
强酸弱
碱盐
中性
碱性
酸性
碱性
酸性
2.盐溶液呈现酸碱性的理论分析
(1)强酸强碱盐(以NaCl为例)。
溶液中存在的离子 H2O H++OH-
NaCl===Na++Cl-
离子间能否相互作用生成弱电解质 __
c(H+)和c(OH-)的相对大小 c(H+)__c(OH-),呈__性,__弱电解质生成
理论解释 水的电离平衡不发生移动,溶液中c(H+)__c(OH-)
否
=
中
无
=
(2)强酸弱碱盐(以NH4Cl为例)。
溶液中存在的离子
离子间能否相互作用生成弱电解质 __
c(H+)和c(OH-)的相对大小 c(H+)__c(OH-),呈__性
能
>
酸
理论解释
总反应离子方程式
>
(3)强碱弱酸盐(以CH3COONa为例)。
溶液中存在的离子
离子间能否相互作用生成弱电解质 __
c(H+)和c(OH-)的相对大小 c(H+)__c(OH-),呈__性
能
<
碱
理论解释 CH3COO-和H+结合生成弱电解质__________,使水的电离平衡向_________方向移动,使溶液中
c(H+)___c(OH-)
总反应离子方程式 ______________________________________
3.盐类的水解
(1)概念:盐在水溶液中电离出来的离子与水电离出来的___或_____结合生成________的反应,称为盐类的水解。
(2)实质:生成___________,使水的电离平衡被破坏而建立起新的平衡。
CH3COOH
电离
<
CH3COO-+H2O CH3COOH+OH-
H+
OH-
弱电解质
弱酸或弱碱
(3)盐类水解的特点
【特别提醒】 盐类的水解反应可以看成酸碱中和反应的逆过程。我们可以根据生成盐的酸和碱的相对强弱,来判断盐溶液的酸碱性。
判一判 (正确的打“√”,错误的打“×”)
(1)盐类的水解过程促进了水的电离。 ( )
(2)酸式盐溶液一定显酸性。 ( )
(3)酸碱恰好中和生成的盐溶液一定显中性。 ( )
(4)盐溶液显酸性、碱性还是中性,取决于溶液中c(H+)与c(OH-)的相对大小。 ( )
(5)盐水解后,溶液不是呈酸性就是呈碱性。 ( )
√
×
×
√
×
二、盐类水解的表示方法
1.盐类水解可以用化学方程式或离子方程式表示,一般模式:盐+水 酸+碱或盐的离子+水 弱酸(或弱碱)+ OH-(或H+)。
2.分类表示
(1)盐类水解是可逆反应,是中和反应的逆反应,而中和反应趋向完全,所以盐类的水解反应是很微弱的,盐类水解程度一般很小,水解时通常不生成沉淀和气体,书写水解的化学方程式或离子方程式时,一般用“ ”连接,产物不标“↑”或“↓”。
如:CH3COONa:_________________________________________;_____________________________________。
CH3COONa+H2O CH3COOH+NaOH
CH3COO-+H2O CH3COOH+OH-
(2)多元弱酸根离子的水解分步进行,水解以第一步为主。如:
Na2CO3: ________________________________________ 、
________________________________。
(3)多元弱碱阳离子水解反应过程复杂,只要求一步写到底。如:
AlCl3:______________________________。
Al3++3H2O Al(OH)3+3H+
×
√
×
×
×
×
关键能力 情境探究达成
盐类水解的实质和规律
[情境素材]
用pH计测定下列溶液的pH与7的关系,按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类完成下表。
盐溶液 pH 盐类型 酸碱性
NaCl pH=7 强酸强碱盐 中性
Na2SO4 pH=7
盐溶液 pH 盐类型 酸碱性
Na2CO3 pH>7 强碱弱酸盐 碱性
NaHCO3 pH>7
CH3COONa pH>7
FeCl3 pH<7 强酸弱碱盐 酸性
(NH4)2SO4 pH<7
[问题探究]
[问题1] 结合情境素材分析回答以下问题:
(1)盐溶液不是中性的原因是什么?各溶液中哪种离子发生了水解?
(2)盐溶液的酸碱性与盐的类型之间有什么关系?
(3)综上(1)(2)问题分析什么类型的盐能够发生水解?
(2)强酸强碱盐不水解,如 NaCl、 KNO3,溶液显中性;强酸弱碱盐,如 NH4Cl、(NH4)2SO4水解溶液显酸性;强碱弱酸盐,如 Na2CO3、CH3COONa水解溶液显碱性。
(3)有弱才水解,如强酸弱碱盐、强碱弱酸盐或弱酸弱碱盐。
[问题2] Na2CO3和NaOH溶液都呈碱性,它们对水的电离影响是否相同?
[问题3] 已知在相同条件下NH3·H2O与CH3COOH电离程度几乎相等,CH3COOH的酸性比H2CO3强,那么NH4HCO3溶液显酸性、碱性还是中性?
[归纳总结]
1.盐类水解的规律
水解规律:水解看组成,有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性,规律要记清。
a.“有弱才水解,无弱不水解”——盐中有弱酸阴离子或弱碱阳离子才水解,若没有,则是强酸强碱盐,不发生水解反应。
b.“越弱越水解”——弱酸阴离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。
c.“都弱都水解”——弱酸弱碱盐电离出的弱酸阴离子和弱碱阳离子都发生水解,且相互促进。
d.“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐显酸性,强碱弱酸盐显碱性。
2.弱酸酸式盐水解的规律
弱酸酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
(1)若电离程度大于水解程度,溶液显酸性,如 NaHSO3、NaH2PO4 等。
(2)若电离程度小于水解程度,溶液显碱性,如 NaHCO3、Na2HPO4等。
3.比较同浓度溶液的酸碱性(pH)大小的方法
(1)首先对物质分类,pH大小规律是碱>盐>酸。
(2)同类物质的pH大小规律是
①碱:二元强碱>一元强碱>一元弱碱;
②酸:一元弱酸>一元强酸>二元强酸;
③盐:强碱弱酸盐>强酸强碱盐>强酸弱碱盐。
[能力达成]
1.在水中加入下列物质,可使水的电离平衡正向移动,且所得溶液呈酸性的是( )
A.NaCl B.NaHSO4
C.Na2CO3 D.NH4Cl
D [A项,NaCl对水的电离平衡无影响,溶液呈中性;B项,NaHSO4中的H+抑制水的电离,且溶液呈酸性;C项,Na2CO3水解促进水的电离,溶液呈碱性;D项,NH4Cl水解促进水的电离,溶液呈酸性。]
√
2.等物质的量浓度的下列物质的溶液,其pH由小到大的顺序排列正确的是( )
①CH3COONa ②NaOH ③NaNO3 ④HCl ⑤Al2(SO4)3
A.①②③④⑤ B.⑤④③②①
C.④⑤③①② D.④⑤②①③
√
[情境素材]
由于盐类的水解过程是一个可逆过程,因此在书写水解反应的化学方程式时,应用“ ”代替“===”。例如,醋酸钠的水解反应可用如下化学方程式表示:
CH3COONa+H2O CH3COOH+NaOH
或用如下离子方程式表示:
CH3COO-+H2O CH3COOH+OH-
盐类水解方程式的书写
[问题探究]
[问题] 盐类水解方程式的常见类型
一元强碱
弱酸盐 以CH3COONa为例:_____________________________
一元强酸
弱碱盐 以NH4Cl为例:__________________________________
多元强碱
弱酸盐
(正盐) 多元弱酸的阴离子水解是分步进行的,以第一步水解为主。如Na2CO3的水解:_______________、____________________
多元强酸
弱碱盐 多元弱碱的阳离子水解复杂,可看作一步水解,如AlCl3的水解:__________________________________
相互促进
水解反应
√
2.氯化铵晶体溶于重水(D2O)中,溶液呈现酸性,用离子方程式表示其原因:_________________________________________________
_____________________。
NH3·DHO+D3O+)
学习效果 随堂评估自测
2
4
3
题号
1
√
1.下列关于盐溶液呈酸碱性的说法错误的是( )
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离的c(OH-)≠c(H+)
D.水电离出的H+(或OH-)与盐中的弱酸根离子(或弱碱阳离子)结合,造成盐溶液呈碱(或酸)性
C [水电离出的c(H+)=c(OH-)一定成立,CH3COONa溶液显碱性,是由于水电离出的H+有一部分与CH3COO-结合成CH3COOH,从而使c(H+)
3
题号
1
4
√
2.在盐类水解的过程中,下列说法正确的是( )
A.盐的电离平衡被破坏
B.水的电离程度一定会增大
C.溶液的pH一定会增大
D.c(H+)与c(OH-)的乘积一定会增大
B [大多数的盐为强电解质,在水中完全电离,A错误;盐类水解促进水的电离,B正确;强酸弱碱盐水解溶液呈酸性,pH减小,C错误;一定温度下的稀溶液中,c(H+)与c(OH-)乘积是一个常数,D错误。]
2
3
题号
4
1
√
2
3
题号
4
1
2
4
3
题号
1
4.下列化合物:
①HCl ②NaOH ③CH3COOH
④NH3·H2O ⑤CH3COONa ⑥NH4Cl
(1)溶液呈碱性的有________(填序号)。
(2)在常温下,0.01 mol·L-1HCl溶液的pH=________。
(3)在常温下,pH=11的CH3COONa溶液中由水电离产生的c(OH-)=______________。
(4)用离子方程式表示CH3COONa溶液呈碱性的原因________________________________________。
②④⑤
2
10-3mol·L-1
CH3COO-+
H2O CH3COOH+OH-
2
4
3
题号
1
题号
基础课时固基练(20) 盐类水解的原理
1
3
5
2
4
6
8
7
9
10
11
12
√
1.下列有关盐类水解的叙述正确的是( )
A.溶液呈中性的盐一定是强酸、强碱反应生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要取决于形成盐的酸和碱的相对强弱
D.强酸强碱盐的水溶液一定呈中性
题号
1
3
5
2
4
6
8
7
9
10
11
12
C [如果弱酸、弱碱的电离程度相当,生成的盐的水溶液呈中性,如CH3COONH4溶液呈中性,A错误;含有弱酸根离子的盐的水溶液不一定呈碱性,如NaHSO3溶液呈酸性,B错误;强酸强碱盐的水溶液不一定呈中性,如NaHSO4溶液呈酸性,D错误。]
题号
2
1
3
4
5
6
8
7
9
10
11
12
2.下列物质的水溶液因溶质水解呈酸性的是( )
A.FeCl3 B.Na2CO3
C.H2SO3 D.KHSO4
√
题号
3
2
4
5
6
8
7
9
10
11
12
1
√
题号
4
2
3
5
6
8
7
9
10
11
12
1
√
4.有四种物质的量浓度相等且都由一价阳离子A+和B+及一价阴离子X-和Y-组成的盐溶液。据测定常温下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7,由此判断不水解的盐可能是( )
A.BX B.AX C.AY D.BY
B [AY溶液的pH>7,说明A相对于Y显强碱性,BX溶液的pH<7,说明X相对于B显强酸性。又因AX的pH=7,故AX可能是不水解的盐,B正确。]
题号
2
4
5
3
6
8
7
9
10
11
12
1
√
5.相同温度、相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别为( )
A.NH4Cl (NH4)2SO4 CH3COONa
B.(NH4)2SO4 NH4Cl CH3COONa
C.(NH4)2SO4 NH4Cl NaOH
D.CH3COOH NH4Cl (NH4)2SO4
题号
2
4
5
3
6
8
7
9
10
11
12
1
√
6.广义的水解观认为水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化。根据以上信息,下列物质水解后的产物错误的是( )
A.BaO2的水解产物是Ba(OH)2和H2O2
B.BrCl水解的产物是HClO和HBr
C.Mg2C3水解的产物是Mg(OH)2和C3H4
D.Al2S3水解的产物是Al(OH)3和H2S
B [从题目信息可知广义水解后元素化合价不变,也可理解为化合物中显正价的水解时结合OH-,显负价的结合H+。BrCl中由于Cl的非金属性强显负价,所以BrCl水解产物为HBrO和HCl。]
题号
2
4
5
3
7
6
8
9
10
11
12
1
√
题号
2
4
5
3
8
6
7
9
10
11
12
1
√
题号
2
4
5
3
8
6
7
9
10
11
12
1
题号
9
2
4
5
3
8
6
7
10
11
12
1
√
9.物质的量浓度相同的下列各物质的溶液,由水电离出的c(H+)由大到小的顺序是( )
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A.④③②① B.①②③④ C.③②④① D.③④②①
C [水中存在电离平衡:H2O H++OH-,若将自身能电离出H+或OH-的物质加入水中,则水的电离程度减小;若将能结合水中H+或OH-的物质加入水中,则水的电离程度增大。NaHSO4抑制水的电离,Na2CO3、NaHCO3均能促进水的电离且Na2CO3比NaHCO3的促进程度更大,Na2SO4不影响水的电离。本题选C。]
题号
9
2
4
5
3
8
6
7
10
11
12
1
√
题号
9
2
4
5
3
8
6
7
10
11
12
1
题号
9
2
4
5
3
8
6
7
10
11
12
1
11.由一价离子组成的四种盐溶液:AC、BD、AD、BC各1 mol·L-1,在室温下,前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液的pH<7,则下列说法正确的是( )
A B C D
碱性 AOH>BOH AOH<BOH AOH>BOH AOH<BOH
酸性 HC>HD HC>HD HC<HD HC<HD
√
题号
9
2
4
5
3
8
6
7
10
11
12
1
题号
9
2
4
5
3
8
6
7
10
11
12
1
12.现有0.175 mol·L-1醋酸钠溶液500 mL(已知醋酸的电离常数Ka=1.75×10-5)。
(1)写出醋酸钠水解反应的化学方程式:_____________________。
(2)下列图像能说明醋酸钠的水解反应达到平衡的是_____(填字母)。
A.溶液中c(Na+)与反应时间t的关系 B.CH3COO-的水解速率与反应时间t的关系 C.溶液的pH与反应时间t的关系 D.Kw与反应时间t的关系
CH3COONa+H2O
CH3COOH+NaOH
BC
题号
9
2
4
5
3
8
6
7
10
11
12
1
CD
7.2
0.35
9
题号
9
2
4
5
3
8
6
7
10
11
12
1
[解析] (1)醋酸钠水解生成醋酸和氢氧化钠,化学方程式为CH3COONa+H2O CH3COOH+NaOH。
(2)A项,钠离子不水解,所以浓度始终不变,错误;B项,醋酸根离子开始时水解速率最大,后逐渐减小,平衡时不再变化,正确;C项,随着水解的逐渐进行,pH逐渐增大,平衡时不再发生变化,正确;D项,Kw是温度常数,温度不变,Kw不变,错误。
题号
9
2
4
5
3
8
6
7
10
11
12
1
题号
9
2
4
5
3
8
6
7
10
11
12
1
