苏教版高中化学选择性必修1化学反应原理专题3第三单元基础课时21影响盐类水解的因素、盐类水解的应用课件(共78张PPT)
文档属性
| 名称 | 苏教版高中化学选择性必修1化学反应原理专题3第三单元基础课时21影响盐类水解的因素、盐类水解的应用课件(共78张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 12.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-09 19:27:18 | ||
图片预览











文档简介
(共78张PPT)
基础课时21 影响盐类水解的因素、盐类水解的应用
专题3 水溶液中的离子反应
第三单元 盐类的水解
学习
任务 1.通过了解影响盐类水解平衡的因素,能多角度、动态地分析外界条件对盐类水解平衡的影响,培养变化观念与平衡思想的化学核心素养。
2.通过了解盐类水解在生产生活、化学实验、科学研究中的应用,能发现和提出有关盐类水解的问题,并设计探究方案,进行实验探究,培养科学探究与创新意识的化学核心素养。
3.通过建立溶液中粒子浓度大小比较的思维模型,掌握溶液中粒子浓度大小的比较方法,证据推理与模型认知的化学核心素养。
必备知识 自主预习储备
一、影响盐类水解平衡的因素
1.盐类的水解平衡
盐类的水解是可逆的,在一定条件(温度、浓度)下,达到了化学平衡,该化学平衡称为盐类的水解平衡。水解平衡与电离平衡一样,也是动态平衡,当外界条件改变时,平衡也发生移动。
2.影响因素
(1)内因。
盐本身的性质对盐类水解平衡的影响
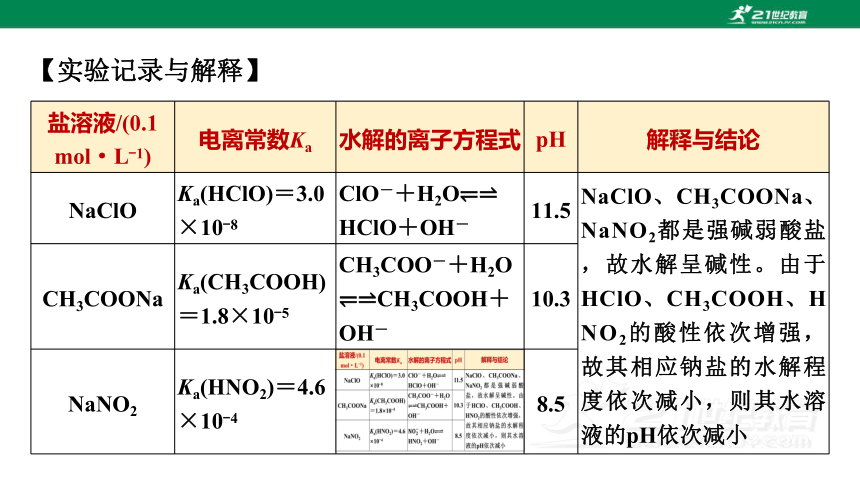
【实验记录与解释】
盐溶液/(0.1 mol·L-1) 电离常数Ka 水解的离子方程式 pH 解释与结论
NaClO Ka(HClO)=3.0
×10-8 ClO-+H2O
HClO+OH- 11.5 NaClO、CH3COONa、NaNO2都是强碱弱酸盐,故水解呈碱性。由于HClO、CH3COOH、HNO2的酸性依次增强,故其相应钠盐的水解程度依次减小,则其水溶液的pH依次减小
CH3COONa Ka(CH3COOH)=1.8×10-5 CH3COO-+H2O
CH3COOH+OH- 10.3
NaNO2 Ka(HNO2)=4.6
×10-4 8.5
(2)浓度对盐类水解平衡的影响
盐的浓度越小,电解质离子相互碰撞结合成电解质分子的概率越小,水解程度越大,但溶液的酸(或碱)性越弱;盐的浓度越大,电解质离子相互碰撞结合成电解质分子的概率越大,水解程度越小,但溶液的酸(或碱)性越强。
(3)温度、溶液的酸碱性对盐类水解的影响
①盐的水解是吸热过程,因此升高温度,促进盐的水解,平衡向右移动;降低温度,则抑制盐的水解,平衡向左移动。
②溶液的酸碱性对盐类水解的影响与盐的类型有关。强酸弱碱盐水解呈酸性,加入碱,会消耗溶液中的H+,促进盐的水解,若加酸则抑制盐的水解;强碱弱酸盐水解呈碱性,加酸促进其水解,加碱抑制其水解。
(4)同离子效应:向能水解的盐溶液中加入与水解产物相同的离子,水解被抑制。
【特别提醒】 NaHCO3溶液中,水解程度和电离程度的相对大小可以以水解常数(Kh)与电离常数(Ka2)的相对大小进行比较。
温度
√
×
√
√
×
盐酸
铁离子
沸水
增强
Al3++3H2O Al(OH)3(胶体)+3H+
√
×
×
×
×
关键能力 情境探究达成
盐类水解的应用
[情境素材]
泡沫灭火器的外壳是铁皮制成的,内装碳酸氢钠与发沫剂的混合溶液,另有一玻璃瓶内胆,装有硫酸铝水溶液。使用时将筒身颠倒过来,碳酸氢钠和硫酸铝两溶液混合后发生化学作用,产生二氧化碳气体泡沫,体积膨胀7~10倍,一般能喷射10 m左右。由于泡沫的
比重小,能覆盖在易燃液体的表面上,一方面降低了液面的温度(吸热)使液体蒸发速度降低;另一方面形成一个隔绝层,隔断氧气与液面接触,火就被扑灭。在生活、生产和科学研究中,人们还能运用盐类水解的原理来解决哪些实际问题?
[问题探究]
[问题1] 蒸干AlCl3水溶液并灼烧,得到的固体物质主要是什么?蒸干并灼烧Al2(SO4)3溶液呢?
[问题2] 如何除去MgCl2溶液中混有的少量Fe3+
提示:Fe3+水解溶液呈酸性,加入过量MgO促进Fe3+生成Fe(OH)3沉淀后过滤即可。
[归纳总结]
1.在工农业生产和日常生活中的应用
(1)热的纯碱液去油污效果更好
用纯碱溶液清洗油污时,加热能促进Na2CO3的水解,溶液中c(OH-)增大。
(2)明矾(铝盐)用作净水剂
明矾[KAl(SO4)2·12H2O]溶于水电离产生的Al3+水解,生成的Al(OH)3胶体吸附水中悬浮的杂质而使水变澄清。有关的离子方程式是Al3++3H2O Al(OH)3(胶体)+3H+。
2.在化学实验中的应用
(1)配制可水解的盐溶液
某些强酸弱碱盐在配制溶液时因水解而浑浊,需加相应的酸来抑制水解,如在配制FeCl3溶液时常加入少量盐酸来抑制FeCl3水解。
(2)可水解盐溶液的贮存
某些弱酸强碱盐水解呈碱性,用玻璃试剂瓶贮存时,不能用玻璃塞,如Na2CO3溶液、NaF溶液等不能贮存于磨口玻璃瓶中,应贮存于带橡胶塞的试剂瓶中。
3.盐溶液蒸干灼烧后所得产物的判断
(1)强酸强碱盐溶液和水解生成难挥发性酸的盐溶液,蒸干后一般得到原物质,如NaCl溶液蒸干得NaCl固体,CuSO4溶液蒸干得CuSO4固体。
(2)盐溶液水解生成易挥发性酸时,蒸干后一般得到对应的弱碱,如AlCl3、FeCl3溶液蒸干后一般得到Al(OH)3、Fe(OH)3,若灼烧则会生成Al2O3、Fe2O3。
(3)酸根阴离子易水解的强碱盐,蒸干后可得到原物质,如Na2CO3溶液蒸干得Na2CO3固体。
Fe2O3
少量盐酸
MgCO3促进了Fe3+的水解,使Fe3+转化为Fe(OH)3沉淀而除去
[解析] (1)加热蒸干FeCl3溶液时,FeCl3溶液水解生成氢氧化铁和HCl,加热促进HCl挥发,从而促进FeCl3溶液水解,蒸干时得到氢氧化铁固体,灼烧氢氧化铁固体,氢氧化铁分解生成氧化铁和水,所以最终得到Fe2O3固体。
(2)FeCl3溶液水解生成氢氧化铁和HCl,为防止氯化铁溶液水解,向溶液中滴加少量盐酸即可。
(3)铁离子水解生成氢离子,碳酸镁和氢离子反应生成二氧化碳,从而促进铁离子水解生成氢氧化铁沉淀而除去。
2.(1)(NH4)2SO4溶液蒸干得到的固体物质是_________________,原因是____________________________________________________
______________________________________________________________________。
(2)Ba(HCO3)2溶液蒸干得到的固体物质是_______________,原因是____________________________________________________________________________________________________。
(3)Na2SO3溶液蒸干得到的固体物质是________,原因是__________________________________________________。
(NH4)2SO4
为不挥发性强酸,随H2SO4浓度增大,将再与NH3·H2O反应生成(NH4)2SO4
BaCO3
由于在溶液中Ba(HCO3)2分解生成BaCO3、CO2和H2O,随着浓缩的不断进行,CO2不断逸出,最后剩余BaCO3
Na2SO4
由于蒸发过
程中Na2SO3不断被氧化,最终生成Na2SO4
[情境素材]
缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH相对稳定。不同的盐溶液因为电离、水解程度大小的不同,造成溶液中离子浓度发生变化。
溶液中离子浓度的大小比较
[问题探究]
[问题1] NaHCO3溶液中有哪些离子?其大小关系如何?
[问题2] NH4Cl溶液中存在的离子有哪些?电荷守恒、元素守恒、质子守恒如何书写?
[问题3] 物质的量浓度相同的CH3COONa溶液和NaClO溶液等体积混合,溶液中离子有哪些?浓度大小如何比较?
提示:物质的量浓度相同的CH3COONa溶液和NaClO溶液等体积混合,溶液中的溶质为CH3COONa、NaClO,溶液中存在的离子有Na+、ClO-、CH3COO-、H+、OH-。
由于ClO-的水解程度大于CH3COO-的水解程度,所以溶液中离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+)。
[归纳总结]
一、溶液中的守恒关系
1.电荷守恒
电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数相等。即电荷守恒,溶液呈电中性。
(1)解题方法。
①分析溶液中所有的阴、阳离子。
②阴、阳离子浓度乘以自身所带的电荷数建立等式。
2.元素守恒
在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化,就该离子所含的某种元素来说,其质量在反应前后是守恒的,即元素守恒。
(1)解题方法。
①分析溶质中的特定元素的原子或原子团间的定量关系(特定元素除H、O元素外)。
②找出特征元素在水溶液中的所有存在形式。
如:Na2CO3溶液中
得质子(H+) 失去质子(H+)
2.弱酸溶液中离子浓度大小比较
(1)HClO溶液中存在的电离平衡有:HClO H++ClO-、H2O H++OH-,溶液中微粒有H2O、HClO、H+、OH-、ClO-,由于HClO电离程度小,且H2O的电离程度更小,所以溶液中微粒浓度由大到小的顺序(H2O除外)是c(HClO)>c(H+)>c(ClO-)>c(OH-)。
(2)分子的电离程度小于对应离子的水解程度。
在0.1 mol·L-1的HCN和0.1 mol·L-1的NaCN混合溶液中:由于HCN的电离程度小于CN-的水解程度,导致溶液呈碱性。溶液中各离子浓度的大小顺序为c(Na+)>c(CN-)>c(OH-)>c(H+),且c(HCN)>c(Na+)=0.1 mol·L-1。
√
A [该混合溶液中存在Na+、A-、OH-与H+ 4种离子,根据c(Na+)>c(A-),再结合电荷守恒知溶液中c(OH-)>c(H+),溶液呈碱性,pH>7,说明HA为弱酸,且A-的水解程度较大,故A项错误,B项正确;由物料守恒可知,C项正确;因n(Na+)=0.01 mol,利用电荷守恒可知,D项正确。]
2.在25 ℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
√
D [pH=11的NaOH溶液中c(NaOH)=c(OH-)=10-3 mol·L-1,而pH=3的CH3COOH溶液中c(H+)=10-3 mol·L-1,c(CH3COOH)远远大于10-3 mol·L-1。两者等体积混合后,形成CH3COOH与CH3COONa的混合液,且c(CH3COOH)远大于c(CH3COONa),溶液呈酸性,电荷守恒关系为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),离子浓度大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。]
学习效果 随堂评估自测
2
4
3
题号
1
√
1.对滴有酚酞试液的下列溶液,下列操作后颜色变深的是( )
A.明矾溶液加热
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.小苏打溶液中加入少量NaCl固体
2
4
3
题号
1
B [明矾溶液中Al3+水解,溶液呈酸性,加热水解平衡向右移动,c(H+)增大,溶液仍无色,A项错误;CH3COONa溶液呈碱性,加热促进水解,溶液碱性增强,溶液红色加深,B项正确;氨水中加入少量NH4Cl(固体),抑制NH3·H2O的电离,溶液红色变浅,C项错误;小苏打溶液呈弱碱性,加入NaCl对溶液酸碱性无影响,D项错误。]
2
3
题号
1
4
√
2.下列说法正确的是( )
A.AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C.用加热的方法可除去KNO3溶液中混有的Fe3+
D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
2
3
题号
1
4
2
3
题号
4
1
√
2
3
题号
4
1
2
4
3
题号
1
√
题号
基础课时固基练(21) 影响盐类水解的因素、盐类水解的应用
1
3
5
2
4
6
8
7
9
10
11
√
C [水解平衡常数只受温度影响,温度不变,水解平衡常数不变,A项错误;水解是吸热反应,升高温度,平衡正向移动,HS-的浓度增大,S2-的浓度减小,所以HS-的浓度和S2-的浓度的比值增大,B项错误;通入H2S,H2S会结合水解出的OH-,使平衡正向移动,HS-的浓度增大,C项正确;加入氢氧化钠固体,溶液的碱性增强,溶液pH增大,D项错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
题号
2
1
3
4
5
6
8
7
9
10
11
2.下列实验操作能达到目的的是( )
①用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体
②用加热蒸发K2CO3溶液的方法获得K2CO3晶体
③用Na2S溶液和CuSO4溶液反应制取CuS固体
④加热MgCl2溶液制取MgCl2固体
A.①② B.②③ C.③④ D.①③
√
B [Al3+和S2-在水溶液中会彻底水解得不到Al2S3;MgCl2在水溶液中水解,蒸发过程中水解生成的HCl会挥发,最后得到Mg(OH)2而不是MgCl2。]
题号
3
2
4
5
6
8
7
9
10
11
1
√
题号
4
2
3
5
6
8
7
9
10
11
1
√
题号
4
2
3
5
6
8
7
9
10
11
1
A [常温下物质的量浓度相同的这几种溶液,溶液的pH大小顺序:碱>强碱弱酸盐>强酸强碱盐>强酸弱碱盐>强酸强碱酸式盐;①是强碱弱酸盐,溶液的pH>7;②NaOH为强碱,溶液的pH=13;③NaHSO4为强碱酸式盐,且NaHSO4电离出的c(H+)最大,溶液的pH最小;④NH4Cl为强酸弱碱盐,溶液的pH<7,但是大于③;⑤NaNO3为强酸强碱盐,溶液的pH=7,所以溶液的pH由小到大的排列顺序是:③<④<⑤<①<②,故答案为A。]
题号
2
4
5
3
6
8
7
9
10
11
1
√
题号
2
4
5
3
6
8
7
9
10
11
1
题号
2
4
5
3
6
8
7
9
10
11
1
√
题号
2
4
5
3
6
8
7
9
10
11
1
题号
2
4
5
3
6
8
7
9
10
11
1
题号
2
4
5
3
7
6
8
9
10
11
1
√
题号
2
4
5
3
7
6
8
9
10
11
1
题号
2
4
5
3
8
6
7
9
10
11
1
√
题号
2
4
5
3
8
6
7
9
10
11
1
A [醋酸钠溶液中醋酸根离子水解促进水的电离,醋酸是酸,抑制水的电离;等浓度等体积混合后,溶液中醋酸电离程度大于醋酸根离子水解程度,溶液显酸性,醋酸根浓度最大。]
题号
9
2
4
5
3
8
6
7
10
11
1
√
9.(素养题)常温下,分别向10 mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.1 mol·L-1的一元酸HA和HB溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
A.HA的酸性强于HB的酸性
B.V(酸)=10 mL时,两溶液中c(B-)=c(A-)
C.a点时,c(A-)>c(Na+)>c(OH-)>c(H+)
D.b、c点时,c(A-)+c(HA)=2c(Na+)=c(HB)+c(B-)
题号
9
2
4
5
3
8
6
7
10
11
1
D [A项,当V(酸)=10 mL时,酸碱恰好完全反应得到等物质的量浓度的NaA溶液、NaB溶液,NaA溶液的pH(8.7)大于NaB溶液的pH(7.8),根据盐类水解的规律“越弱越水解”可知,HA的酸性弱于HB的酸性,错误;B项,由上述A项中的分析可知,A-的水解能力大于B-的水解能力,两溶液中c(B-)>c(A-),错误;C项,a点加入10 mL的HA溶液,得到NaA溶液的pH=8.7,由于A-的水解使溶液呈碱性,溶液中离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+),错误;D项,b点加入20 mL的HA溶液得到等物质的量浓度的NaA和HA的混合液,由物料守恒可得c(A-)+c(HA)=2c(Na+),c点加入20 mL的HB溶液得到等物质的量浓度的NaB和HB的混合液,由物料守恒可得c(B-)+c(HB)=2c(Na+),b、c两点溶液中c(Na+)相等,则c(A-)+c(HA)=2c(Na+)=c(B-)+c(HB),正确。]
题号
9
2
4
5
3
8
6
7
10
11
1
√
题号
9
2
4
5
3
8
6
7
10
11
1
题号
9
2
4
5
3
8
6
7
10
11
1
题号
9
2
4
5
3
8
6
7
10
11
1
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为_________________;若上述关系中④是正确的,则溶液中的溶质为________________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______(填“大于”“小于”或“等于”)c(NH3·H2O),混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)
________c(OH-)。
NH4Cl
①
NH4Cl和NH3·H2O
NH4Cl和HCl
小于
大于
题号
9
2
4
5
3
8
6
7
10
11
1
基础课时21 影响盐类水解的因素、盐类水解的应用
专题3 水溶液中的离子反应
第三单元 盐类的水解
学习
任务 1.通过了解影响盐类水解平衡的因素,能多角度、动态地分析外界条件对盐类水解平衡的影响,培养变化观念与平衡思想的化学核心素养。
2.通过了解盐类水解在生产生活、化学实验、科学研究中的应用,能发现和提出有关盐类水解的问题,并设计探究方案,进行实验探究,培养科学探究与创新意识的化学核心素养。
3.通过建立溶液中粒子浓度大小比较的思维模型,掌握溶液中粒子浓度大小的比较方法,证据推理与模型认知的化学核心素养。
必备知识 自主预习储备
一、影响盐类水解平衡的因素
1.盐类的水解平衡
盐类的水解是可逆的,在一定条件(温度、浓度)下,达到了化学平衡,该化学平衡称为盐类的水解平衡。水解平衡与电离平衡一样,也是动态平衡,当外界条件改变时,平衡也发生移动。
2.影响因素
(1)内因。
盐本身的性质对盐类水解平衡的影响
【实验记录与解释】
盐溶液/(0.1 mol·L-1) 电离常数Ka 水解的离子方程式 pH 解释与结论
NaClO Ka(HClO)=3.0
×10-8 ClO-+H2O
HClO+OH- 11.5 NaClO、CH3COONa、NaNO2都是强碱弱酸盐,故水解呈碱性。由于HClO、CH3COOH、HNO2的酸性依次增强,故其相应钠盐的水解程度依次减小,则其水溶液的pH依次减小
CH3COONa Ka(CH3COOH)=1.8×10-5 CH3COO-+H2O
CH3COOH+OH- 10.3
NaNO2 Ka(HNO2)=4.6
×10-4 8.5
(2)浓度对盐类水解平衡的影响
盐的浓度越小,电解质离子相互碰撞结合成电解质分子的概率越小,水解程度越大,但溶液的酸(或碱)性越弱;盐的浓度越大,电解质离子相互碰撞结合成电解质分子的概率越大,水解程度越小,但溶液的酸(或碱)性越强。
(3)温度、溶液的酸碱性对盐类水解的影响
①盐的水解是吸热过程,因此升高温度,促进盐的水解,平衡向右移动;降低温度,则抑制盐的水解,平衡向左移动。
②溶液的酸碱性对盐类水解的影响与盐的类型有关。强酸弱碱盐水解呈酸性,加入碱,会消耗溶液中的H+,促进盐的水解,若加酸则抑制盐的水解;强碱弱酸盐水解呈碱性,加酸促进其水解,加碱抑制其水解。
(4)同离子效应:向能水解的盐溶液中加入与水解产物相同的离子,水解被抑制。
【特别提醒】 NaHCO3溶液中,水解程度和电离程度的相对大小可以以水解常数(Kh)与电离常数(Ka2)的相对大小进行比较。
温度
√
×
√
√
×
盐酸
铁离子
沸水
增强
Al3++3H2O Al(OH)3(胶体)+3H+
√
×
×
×
×
关键能力 情境探究达成
盐类水解的应用
[情境素材]
泡沫灭火器的外壳是铁皮制成的,内装碳酸氢钠与发沫剂的混合溶液,另有一玻璃瓶内胆,装有硫酸铝水溶液。使用时将筒身颠倒过来,碳酸氢钠和硫酸铝两溶液混合后发生化学作用,产生二氧化碳气体泡沫,体积膨胀7~10倍,一般能喷射10 m左右。由于泡沫的
比重小,能覆盖在易燃液体的表面上,一方面降低了液面的温度(吸热)使液体蒸发速度降低;另一方面形成一个隔绝层,隔断氧气与液面接触,火就被扑灭。在生活、生产和科学研究中,人们还能运用盐类水解的原理来解决哪些实际问题?
[问题探究]
[问题1] 蒸干AlCl3水溶液并灼烧,得到的固体物质主要是什么?蒸干并灼烧Al2(SO4)3溶液呢?
[问题2] 如何除去MgCl2溶液中混有的少量Fe3+
提示:Fe3+水解溶液呈酸性,加入过量MgO促进Fe3+生成Fe(OH)3沉淀后过滤即可。
[归纳总结]
1.在工农业生产和日常生活中的应用
(1)热的纯碱液去油污效果更好
用纯碱溶液清洗油污时,加热能促进Na2CO3的水解,溶液中c(OH-)增大。
(2)明矾(铝盐)用作净水剂
明矾[KAl(SO4)2·12H2O]溶于水电离产生的Al3+水解,生成的Al(OH)3胶体吸附水中悬浮的杂质而使水变澄清。有关的离子方程式是Al3++3H2O Al(OH)3(胶体)+3H+。
2.在化学实验中的应用
(1)配制可水解的盐溶液
某些强酸弱碱盐在配制溶液时因水解而浑浊,需加相应的酸来抑制水解,如在配制FeCl3溶液时常加入少量盐酸来抑制FeCl3水解。
(2)可水解盐溶液的贮存
某些弱酸强碱盐水解呈碱性,用玻璃试剂瓶贮存时,不能用玻璃塞,如Na2CO3溶液、NaF溶液等不能贮存于磨口玻璃瓶中,应贮存于带橡胶塞的试剂瓶中。
3.盐溶液蒸干灼烧后所得产物的判断
(1)强酸强碱盐溶液和水解生成难挥发性酸的盐溶液,蒸干后一般得到原物质,如NaCl溶液蒸干得NaCl固体,CuSO4溶液蒸干得CuSO4固体。
(2)盐溶液水解生成易挥发性酸时,蒸干后一般得到对应的弱碱,如AlCl3、FeCl3溶液蒸干后一般得到Al(OH)3、Fe(OH)3,若灼烧则会生成Al2O3、Fe2O3。
(3)酸根阴离子易水解的强碱盐,蒸干后可得到原物质,如Na2CO3溶液蒸干得Na2CO3固体。
Fe2O3
少量盐酸
MgCO3促进了Fe3+的水解,使Fe3+转化为Fe(OH)3沉淀而除去
[解析] (1)加热蒸干FeCl3溶液时,FeCl3溶液水解生成氢氧化铁和HCl,加热促进HCl挥发,从而促进FeCl3溶液水解,蒸干时得到氢氧化铁固体,灼烧氢氧化铁固体,氢氧化铁分解生成氧化铁和水,所以最终得到Fe2O3固体。
(2)FeCl3溶液水解生成氢氧化铁和HCl,为防止氯化铁溶液水解,向溶液中滴加少量盐酸即可。
(3)铁离子水解生成氢离子,碳酸镁和氢离子反应生成二氧化碳,从而促进铁离子水解生成氢氧化铁沉淀而除去。
2.(1)(NH4)2SO4溶液蒸干得到的固体物质是_________________,原因是____________________________________________________
______________________________________________________________________。
(2)Ba(HCO3)2溶液蒸干得到的固体物质是_______________,原因是____________________________________________________________________________________________________。
(3)Na2SO3溶液蒸干得到的固体物质是________,原因是__________________________________________________。
(NH4)2SO4
为不挥发性强酸,随H2SO4浓度增大,将再与NH3·H2O反应生成(NH4)2SO4
BaCO3
由于在溶液中Ba(HCO3)2分解生成BaCO3、CO2和H2O,随着浓缩的不断进行,CO2不断逸出,最后剩余BaCO3
Na2SO4
由于蒸发过
程中Na2SO3不断被氧化,最终生成Na2SO4
[情境素材]
缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH相对稳定。不同的盐溶液因为电离、水解程度大小的不同,造成溶液中离子浓度发生变化。
溶液中离子浓度的大小比较
[问题探究]
[问题1] NaHCO3溶液中有哪些离子?其大小关系如何?
[问题2] NH4Cl溶液中存在的离子有哪些?电荷守恒、元素守恒、质子守恒如何书写?
[问题3] 物质的量浓度相同的CH3COONa溶液和NaClO溶液等体积混合,溶液中离子有哪些?浓度大小如何比较?
提示:物质的量浓度相同的CH3COONa溶液和NaClO溶液等体积混合,溶液中的溶质为CH3COONa、NaClO,溶液中存在的离子有Na+、ClO-、CH3COO-、H+、OH-。
由于ClO-的水解程度大于CH3COO-的水解程度,所以溶液中离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+)。
[归纳总结]
一、溶液中的守恒关系
1.电荷守恒
电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数相等。即电荷守恒,溶液呈电中性。
(1)解题方法。
①分析溶液中所有的阴、阳离子。
②阴、阳离子浓度乘以自身所带的电荷数建立等式。
2.元素守恒
在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化,就该离子所含的某种元素来说,其质量在反应前后是守恒的,即元素守恒。
(1)解题方法。
①分析溶质中的特定元素的原子或原子团间的定量关系(特定元素除H、O元素外)。
②找出特征元素在水溶液中的所有存在形式。
如:Na2CO3溶液中
得质子(H+) 失去质子(H+)
2.弱酸溶液中离子浓度大小比较
(1)HClO溶液中存在的电离平衡有:HClO H++ClO-、H2O H++OH-,溶液中微粒有H2O、HClO、H+、OH-、ClO-,由于HClO电离程度小,且H2O的电离程度更小,所以溶液中微粒浓度由大到小的顺序(H2O除外)是c(HClO)>c(H+)>c(ClO-)>c(OH-)。
(2)分子的电离程度小于对应离子的水解程度。
在0.1 mol·L-1的HCN和0.1 mol·L-1的NaCN混合溶液中:由于HCN的电离程度小于CN-的水解程度,导致溶液呈碱性。溶液中各离子浓度的大小顺序为c(Na+)>c(CN-)>c(OH-)>c(H+),且c(HCN)>c(Na+)=0.1 mol·L-1。
√
A [该混合溶液中存在Na+、A-、OH-与H+ 4种离子,根据c(Na+)>c(A-),再结合电荷守恒知溶液中c(OH-)>c(H+),溶液呈碱性,pH>7,说明HA为弱酸,且A-的水解程度较大,故A项错误,B项正确;由物料守恒可知,C项正确;因n(Na+)=0.01 mol,利用电荷守恒可知,D项正确。]
2.在25 ℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
√
D [pH=11的NaOH溶液中c(NaOH)=c(OH-)=10-3 mol·L-1,而pH=3的CH3COOH溶液中c(H+)=10-3 mol·L-1,c(CH3COOH)远远大于10-3 mol·L-1。两者等体积混合后,形成CH3COOH与CH3COONa的混合液,且c(CH3COOH)远大于c(CH3COONa),溶液呈酸性,电荷守恒关系为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),离子浓度大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。]
学习效果 随堂评估自测
2
4
3
题号
1
√
1.对滴有酚酞试液的下列溶液,下列操作后颜色变深的是( )
A.明矾溶液加热
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.小苏打溶液中加入少量NaCl固体
2
4
3
题号
1
B [明矾溶液中Al3+水解,溶液呈酸性,加热水解平衡向右移动,c(H+)增大,溶液仍无色,A项错误;CH3COONa溶液呈碱性,加热促进水解,溶液碱性增强,溶液红色加深,B项正确;氨水中加入少量NH4Cl(固体),抑制NH3·H2O的电离,溶液红色变浅,C项错误;小苏打溶液呈弱碱性,加入NaCl对溶液酸碱性无影响,D项错误。]
2
3
题号
1
4
√
2.下列说法正确的是( )
A.AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C.用加热的方法可除去KNO3溶液中混有的Fe3+
D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
2
3
题号
1
4
2
3
题号
4
1
√
2
3
题号
4
1
2
4
3
题号
1
√
题号
基础课时固基练(21) 影响盐类水解的因素、盐类水解的应用
1
3
5
2
4
6
8
7
9
10
11
√
C [水解平衡常数只受温度影响,温度不变,水解平衡常数不变,A项错误;水解是吸热反应,升高温度,平衡正向移动,HS-的浓度增大,S2-的浓度减小,所以HS-的浓度和S2-的浓度的比值增大,B项错误;通入H2S,H2S会结合水解出的OH-,使平衡正向移动,HS-的浓度增大,C项正确;加入氢氧化钠固体,溶液的碱性增强,溶液pH增大,D项错误。]
题号
1
3
5
2
4
6
8
7
9
10
11
题号
2
1
3
4
5
6
8
7
9
10
11
2.下列实验操作能达到目的的是( )
①用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体
②用加热蒸发K2CO3溶液的方法获得K2CO3晶体
③用Na2S溶液和CuSO4溶液反应制取CuS固体
④加热MgCl2溶液制取MgCl2固体
A.①② B.②③ C.③④ D.①③
√
B [Al3+和S2-在水溶液中会彻底水解得不到Al2S3;MgCl2在水溶液中水解,蒸发过程中水解生成的HCl会挥发,最后得到Mg(OH)2而不是MgCl2。]
题号
3
2
4
5
6
8
7
9
10
11
1
√
题号
4
2
3
5
6
8
7
9
10
11
1
√
题号
4
2
3
5
6
8
7
9
10
11
1
A [常温下物质的量浓度相同的这几种溶液,溶液的pH大小顺序:碱>强碱弱酸盐>强酸强碱盐>强酸弱碱盐>强酸强碱酸式盐;①是强碱弱酸盐,溶液的pH>7;②NaOH为强碱,溶液的pH=13;③NaHSO4为强碱酸式盐,且NaHSO4电离出的c(H+)最大,溶液的pH最小;④NH4Cl为强酸弱碱盐,溶液的pH<7,但是大于③;⑤NaNO3为强酸强碱盐,溶液的pH=7,所以溶液的pH由小到大的排列顺序是:③<④<⑤<①<②,故答案为A。]
题号
2
4
5
3
6
8
7
9
10
11
1
√
题号
2
4
5
3
6
8
7
9
10
11
1
题号
2
4
5
3
6
8
7
9
10
11
1
√
题号
2
4
5
3
6
8
7
9
10
11
1
题号
2
4
5
3
6
8
7
9
10
11
1
题号
2
4
5
3
7
6
8
9
10
11
1
√
题号
2
4
5
3
7
6
8
9
10
11
1
题号
2
4
5
3
8
6
7
9
10
11
1
√
题号
2
4
5
3
8
6
7
9
10
11
1
A [醋酸钠溶液中醋酸根离子水解促进水的电离,醋酸是酸,抑制水的电离;等浓度等体积混合后,溶液中醋酸电离程度大于醋酸根离子水解程度,溶液显酸性,醋酸根浓度最大。]
题号
9
2
4
5
3
8
6
7
10
11
1
√
9.(素养题)常温下,分别向10 mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.1 mol·L-1的一元酸HA和HB溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
A.HA的酸性强于HB的酸性
B.V(酸)=10 mL时,两溶液中c(B-)=c(A-)
C.a点时,c(A-)>c(Na+)>c(OH-)>c(H+)
D.b、c点时,c(A-)+c(HA)=2c(Na+)=c(HB)+c(B-)
题号
9
2
4
5
3
8
6
7
10
11
1
D [A项,当V(酸)=10 mL时,酸碱恰好完全反应得到等物质的量浓度的NaA溶液、NaB溶液,NaA溶液的pH(8.7)大于NaB溶液的pH(7.8),根据盐类水解的规律“越弱越水解”可知,HA的酸性弱于HB的酸性,错误;B项,由上述A项中的分析可知,A-的水解能力大于B-的水解能力,两溶液中c(B-)>c(A-),错误;C项,a点加入10 mL的HA溶液,得到NaA溶液的pH=8.7,由于A-的水解使溶液呈碱性,溶液中离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+),错误;D项,b点加入20 mL的HA溶液得到等物质的量浓度的NaA和HA的混合液,由物料守恒可得c(A-)+c(HA)=2c(Na+),c点加入20 mL的HB溶液得到等物质的量浓度的NaB和HB的混合液,由物料守恒可得c(B-)+c(HB)=2c(Na+),b、c两点溶液中c(Na+)相等,则c(A-)+c(HA)=2c(Na+)=c(B-)+c(HB),正确。]
题号
9
2
4
5
3
8
6
7
10
11
1
√
题号
9
2
4
5
3
8
6
7
10
11
1
题号
9
2
4
5
3
8
6
7
10
11
1
题号
9
2
4
5
3
8
6
7
10
11
1
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为_________________;若上述关系中④是正确的,则溶液中的溶质为________________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______(填“大于”“小于”或“等于”)c(NH3·H2O),混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)
________c(OH-)。
NH4Cl
①
NH4Cl和NH3·H2O
NH4Cl和HCl
小于
大于
题号
9
2
4
5
3
8
6
7
10
11
1
