8.2.1 常见的酸 教学课件(共27张PPT 内嵌视频) 初中化学科粤版(2024)九年级下册教学课件(共28页)
文档属性
| 名称 | 8.2.1 常见的酸 教学课件(共27张PPT 内嵌视频) 初中化学科粤版(2024)九年级下册教学课件(共28页) |  | |
| 格式 | pptx | ||
| 文件大小 | 109.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-09 19:52:46 | ||
图片预览








文档简介
(共27张PPT)
8.2.1 常见的酸
核心素养目标
一、化学观念
能认识常见酸(盐酸、硫酸、硝酸)的性质和用途,理解浓硫酸脱水性、
吸水性、腐蚀性等特性,形成 “结构决定性质,性质决定用途” 的化学观念。
二、科学思维
通过观察浓硫酸相关实验,如脱水性实验和稀释实验,提升分析、推理
和归纳总结的思维能力,能从微观角度理解浓硫酸的化学变化。
三、科学态度与责任
认识到浓硫酸的危险性,树立严谨的科学态度和安全意识,理解正确操
作的重要性,增强实验安全的社会责任。
学习重难点
重点:
1. 常见酸的性质与用途;
2. 浓硫酸的特性(脱水性、吸水性、腐蚀性);
3. 稀释浓硫酸的正确方法。
难点:
1. 理解浓硫酸脱水性的本质;
2. 掌握稀释浓硫酸的正确操作及原理。
新课导入
同学们,在化学发展的历史长河中,有很多有趣的故事。曾经有一位化学家在做实验时,不小心将浓硫酸溅到了自己的衣服上,当时他并没有太在意,可没过多久,衣服就出现了破洞。这是为什么呢?另外,在工业革命时期,酸在很多生产领域发挥了关键作用,极大地推动了生产的发展。那常见的酸都有哪些,它们在生产生活中是怎样发挥作用的呢?接下来,就让我们深入了解常见的酸。
常见的酸
PART 01
1. 常见的酸
常见的酸有:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)。
硝酸在光照下容易分解,保存于棕色瓶中。
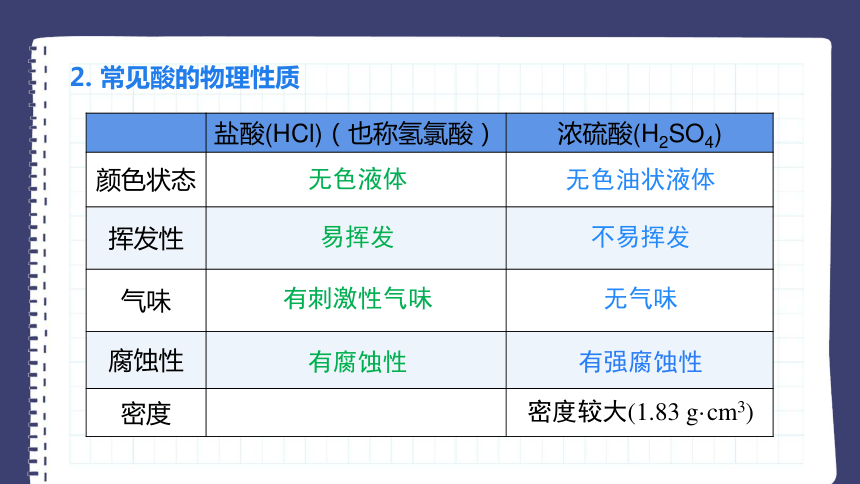
2. 常见酸的物理性质
盐酸(HCl)(也称氢氯酸) 浓硫酸(H2SO4)
颜色状态
挥发性
气味
腐蚀性
密度
无色液体
无色油状液体
易挥发
不易挥发
有刺激性气味
无气味
有强腐蚀性
密度较大(1.83 g·cm3)
有腐蚀性
1. 打开浓盐酸的试剂瓶瓶盖后为什么会出现白雾?
思考讨论
盐酸是氯化氢气体的水溶液,具有挥发性,浓度越大,温度越高,挥发性越强。打开盛浓盐酸的试剂瓶瓶盖,瓶口出现白雾是因为挥发出的氯化氢气体与空气中的水蒸气结合,形成了盐酸小液滴。
3. 常见酸的用途
盐酸(HCl)(也称氢氯酸) 浓硫酸(H2SO4)
用途
电镀、除锈、食品加工、化工生产
车用电池、化肥制造、农药生产、石油精炼
电镀
除锈
车用电池
4. 浓硫酸的特性——脱水性
[目的]
知道浓硫酸具有脱水性
观察活动
4. 浓硫酸的特性——脱水性
[目的]
知道浓硫酸具有脱水性
观察活动
实验操作 实验现象 图示
用蘸有浓硫酸的玻璃棒,在放于表面皿中的纸上写字,观察变化。
取20g蔗糖放入小烧杯中,加少量水使它润湿后,注入10mL浓硫酸,搅拌,观察现象。
蔗糖先变黑,然后迅速膨胀形成 “黑面包” 状物质,同时有热量放出和刺激性气味产生。
纸上显出黑色字迹
[实验结论]
浓硫酸能使纸张、蔗糖等物质脱水变成炭,有强脱水性。浓硫酸对衣物、皮肤等都有强腐蚀性。
4. 浓硫酸的特性——脱水性
[目的]
知道浓硫酸具有脱水性
观察活动
4. 浓硫酸的特性——强腐蚀性
浓硫酸是危险品,保管和使用都要格外小心,应保存在专用的试剂柜中。
[危险处理]
如果皮肤不慎沾上浓硫酸,应立即用大量水冲洗,然后图上3%~5%的碳酸氢钠溶液。
4. 浓硫酸的特性——强吸水性
浓硫酸具有吸水性,可用作干燥剂,用来干燥不能与其反应的酸性或中性气体,如CO2、HCl、O2、H2等,不能干燥NH3等碱性气体。气体通入方法“长导管进气、短导管出气”
气体
1. 浓硫酸吸水性与脱水性有什么区别?
思考讨论
吸水性是指能吸收物质中所含的水分,属于物理性质;脱水性是指能将组成原物质的氢元素和氧元素按水的组成比脱去,使物质碳化,属于化学性质。
拓展延伸
物质 浓盐酸 浓硫酸
性质 挥发性 吸水性
不同点 溶质质量
溶剂质量
溶液质量
相同点 溶质质量分数
变化类型
减小
不变
不变
增大
增大
减小
减小
物理变化
减小
物理变化
敞口放置在空气中的浓盐酸和浓硫酸的比较
☆都需要密封保存
5. 浓硫酸的稀释
[目的]
知道稀释浓硫酸的正确操作
观察活动
5. 浓硫酸的稀释
[目的]
知道稀释浓硫酸的正确操作
观察活动
操作示意图 操作 现象 解释
正确:将浓硫酸沿着器壁缓慢地注入水中,并不停地搅拌。 将密度大的浓硫酸缓慢地注入水中,及时搅拌,使产生的热得以迅速扩散。
用手触碰烧杯外壁,感觉发烫,且温度计的数值升高。
5. 浓硫酸的稀释
操作示意图 操作 现象 解释
错误:为说明图a中错误操作的危害,在图b中的特定装置内,把少量水滴进浓硫酸中。 水的密度比浓硫酸小,当水滴入浓硫酸时会产生大量热使水立即沸腾,带着硫酸液滴向四周飞溅,十分危险。
锥形瓶内的液体向四周飞溅,用手触摸锥形瓶外壁,感觉发烫。
5. 浓硫酸的稀释
[目的]
知道稀释浓硫酸的正确操作
观察活动
[实验结论]
稀释浓硫酸时,一定要将浓硫酸沿着容器壁缓慢注入水中,并不断搅拌,切不可将水倒进浓硫酸中。
[其他的酸]
拓展延伸
醋酸
碳酸
柠檬酸
草酸
乳酸
总结归纳
1. 下列有关酸的说法中,错误的是( )
A. 稀盐酸和稀硫酸都可以用来除铁锈
B. 浓硫酸需要需要密封保存是为了防止其吸收空气中的水分
C. 浓盐酸在敞口容器中放置一段时间后,其溶液质量减小 D. 打开盛有浓盐酸和浓硫酸的试剂瓶瓶盖,瓶口都出现白雾
随堂练习
D
2. 稀释浓硫酸时,必须把浓硫酸沿着器壁慢慢注入水里,并不断搅动,原因是( )
A. 加快稀释速度
B. 浓硫酸具有脱水性
C. 浓硫酸具有吸水性
D. 浓硫酸溶于水放出大量热并且密度比水大
随堂练习
D
随堂练习
3. 对比是学习化学的重要方法,下列关于和的比较中错误的是( )
A. 打开试剂瓶的瓶塞,放在空气中观察,可以鉴别浓盐酸和浓硫酸
B. 实验室用块状石灰石和稀盐酸或稀硫酸反应,制取二氧化碳
C. 盐酸可用除锈,硫酸可用于车用电池
D. 浓盐酸、浓硫酸敞口放置一段时间后,溶质质量分数均会变小
B
随堂练习
4. 下列有关浓盐酸和浓硫酸的说法不正确的是( )
A. 浓盐酸在空气中会冒白烟
B. 浓盐酸有刺激性气味
C. 浓硫酸有强烈的腐蚀性
D. 浓硫酸溶于水时放出大量的热
A
谢谢观看
8.2.1 常见的酸
核心素养目标
一、化学观念
能认识常见酸(盐酸、硫酸、硝酸)的性质和用途,理解浓硫酸脱水性、
吸水性、腐蚀性等特性,形成 “结构决定性质,性质决定用途” 的化学观念。
二、科学思维
通过观察浓硫酸相关实验,如脱水性实验和稀释实验,提升分析、推理
和归纳总结的思维能力,能从微观角度理解浓硫酸的化学变化。
三、科学态度与责任
认识到浓硫酸的危险性,树立严谨的科学态度和安全意识,理解正确操
作的重要性,增强实验安全的社会责任。
学习重难点
重点:
1. 常见酸的性质与用途;
2. 浓硫酸的特性(脱水性、吸水性、腐蚀性);
3. 稀释浓硫酸的正确方法。
难点:
1. 理解浓硫酸脱水性的本质;
2. 掌握稀释浓硫酸的正确操作及原理。
新课导入
同学们,在化学发展的历史长河中,有很多有趣的故事。曾经有一位化学家在做实验时,不小心将浓硫酸溅到了自己的衣服上,当时他并没有太在意,可没过多久,衣服就出现了破洞。这是为什么呢?另外,在工业革命时期,酸在很多生产领域发挥了关键作用,极大地推动了生产的发展。那常见的酸都有哪些,它们在生产生活中是怎样发挥作用的呢?接下来,就让我们深入了解常见的酸。
常见的酸
PART 01
1. 常见的酸
常见的酸有:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)。
硝酸在光照下容易分解,保存于棕色瓶中。
2. 常见酸的物理性质
盐酸(HCl)(也称氢氯酸) 浓硫酸(H2SO4)
颜色状态
挥发性
气味
腐蚀性
密度
无色液体
无色油状液体
易挥发
不易挥发
有刺激性气味
无气味
有强腐蚀性
密度较大(1.83 g·cm3)
有腐蚀性
1. 打开浓盐酸的试剂瓶瓶盖后为什么会出现白雾?
思考讨论
盐酸是氯化氢气体的水溶液,具有挥发性,浓度越大,温度越高,挥发性越强。打开盛浓盐酸的试剂瓶瓶盖,瓶口出现白雾是因为挥发出的氯化氢气体与空气中的水蒸气结合,形成了盐酸小液滴。
3. 常见酸的用途
盐酸(HCl)(也称氢氯酸) 浓硫酸(H2SO4)
用途
电镀、除锈、食品加工、化工生产
车用电池、化肥制造、农药生产、石油精炼
电镀
除锈
车用电池
4. 浓硫酸的特性——脱水性
[目的]
知道浓硫酸具有脱水性
观察活动
4. 浓硫酸的特性——脱水性
[目的]
知道浓硫酸具有脱水性
观察活动
实验操作 实验现象 图示
用蘸有浓硫酸的玻璃棒,在放于表面皿中的纸上写字,观察变化。
取20g蔗糖放入小烧杯中,加少量水使它润湿后,注入10mL浓硫酸,搅拌,观察现象。
蔗糖先变黑,然后迅速膨胀形成 “黑面包” 状物质,同时有热量放出和刺激性气味产生。
纸上显出黑色字迹
[实验结论]
浓硫酸能使纸张、蔗糖等物质脱水变成炭,有强脱水性。浓硫酸对衣物、皮肤等都有强腐蚀性。
4. 浓硫酸的特性——脱水性
[目的]
知道浓硫酸具有脱水性
观察活动
4. 浓硫酸的特性——强腐蚀性
浓硫酸是危险品,保管和使用都要格外小心,应保存在专用的试剂柜中。
[危险处理]
如果皮肤不慎沾上浓硫酸,应立即用大量水冲洗,然后图上3%~5%的碳酸氢钠溶液。
4. 浓硫酸的特性——强吸水性
浓硫酸具有吸水性,可用作干燥剂,用来干燥不能与其反应的酸性或中性气体,如CO2、HCl、O2、H2等,不能干燥NH3等碱性气体。气体通入方法“长导管进气、短导管出气”
气体
1. 浓硫酸吸水性与脱水性有什么区别?
思考讨论
吸水性是指能吸收物质中所含的水分,属于物理性质;脱水性是指能将组成原物质的氢元素和氧元素按水的组成比脱去,使物质碳化,属于化学性质。
拓展延伸
物质 浓盐酸 浓硫酸
性质 挥发性 吸水性
不同点 溶质质量
溶剂质量
溶液质量
相同点 溶质质量分数
变化类型
减小
不变
不变
增大
增大
减小
减小
物理变化
减小
物理变化
敞口放置在空气中的浓盐酸和浓硫酸的比较
☆都需要密封保存
5. 浓硫酸的稀释
[目的]
知道稀释浓硫酸的正确操作
观察活动
5. 浓硫酸的稀释
[目的]
知道稀释浓硫酸的正确操作
观察活动
操作示意图 操作 现象 解释
正确:将浓硫酸沿着器壁缓慢地注入水中,并不停地搅拌。 将密度大的浓硫酸缓慢地注入水中,及时搅拌,使产生的热得以迅速扩散。
用手触碰烧杯外壁,感觉发烫,且温度计的数值升高。
5. 浓硫酸的稀释
操作示意图 操作 现象 解释
错误:为说明图a中错误操作的危害,在图b中的特定装置内,把少量水滴进浓硫酸中。 水的密度比浓硫酸小,当水滴入浓硫酸时会产生大量热使水立即沸腾,带着硫酸液滴向四周飞溅,十分危险。
锥形瓶内的液体向四周飞溅,用手触摸锥形瓶外壁,感觉发烫。
5. 浓硫酸的稀释
[目的]
知道稀释浓硫酸的正确操作
观察活动
[实验结论]
稀释浓硫酸时,一定要将浓硫酸沿着容器壁缓慢注入水中,并不断搅拌,切不可将水倒进浓硫酸中。
[其他的酸]
拓展延伸
醋酸
碳酸
柠檬酸
草酸
乳酸
总结归纳
1. 下列有关酸的说法中,错误的是( )
A. 稀盐酸和稀硫酸都可以用来除铁锈
B. 浓硫酸需要需要密封保存是为了防止其吸收空气中的水分
C. 浓盐酸在敞口容器中放置一段时间后,其溶液质量减小 D. 打开盛有浓盐酸和浓硫酸的试剂瓶瓶盖,瓶口都出现白雾
随堂练习
D
2. 稀释浓硫酸时,必须把浓硫酸沿着器壁慢慢注入水里,并不断搅动,原因是( )
A. 加快稀释速度
B. 浓硫酸具有脱水性
C. 浓硫酸具有吸水性
D. 浓硫酸溶于水放出大量热并且密度比水大
随堂练习
D
随堂练习
3. 对比是学习化学的重要方法,下列关于和的比较中错误的是( )
A. 打开试剂瓶的瓶塞,放在空气中观察,可以鉴别浓盐酸和浓硫酸
B. 实验室用块状石灰石和稀盐酸或稀硫酸反应,制取二氧化碳
C. 盐酸可用除锈,硫酸可用于车用电池
D. 浓盐酸、浓硫酸敞口放置一段时间后,溶质质量分数均会变小
B
随堂练习
4. 下列有关浓盐酸和浓硫酸的说法不正确的是( )
A. 浓盐酸在空气中会冒白烟
B. 浓盐酸有刺激性气味
C. 浓硫酸有强烈的腐蚀性
D. 浓硫酸溶于水时放出大量的热
A
谢谢观看
